Стратегия здоровья.
В последние годы растёт понимание того, что опухоль, наряду с многими другими заболеваниями, является результатом основных дисбалансов организма. Одним из них является дисбаланс поступающих в организм или вырабатывающихся в нём жизненно необходимых веществ.
Обеспечение организма необходимыми ему строительными и энергетическими материалами – макро- и микроэлементами, происходит через пищу и питьё.
Макроэлементы требуются организму для построения тканей, поддержания постоянства осмотического давления, ионного и кислотно-щелочного баланса. Микро- и ультрамикроэлементы участвуют в построении и работе ферментов, гормонов, витаминов и биологически активных веществ. Незначительный недостаток или избыток химических элементов может не замечаться до тех пор, пока эта аномалия не станет слишком явной.
Для организма разница между недостатком и дефицитом микронутриентов состоит лишь в степени расстройства здоровья. Недостаток микронутриентов может длительное время не замечаться, но в то же время скрытно способствовать появлению многих болезненных состояний необъяснимой природы. Дефицит микронутриентов рано или поздно приводит к явному нарушению функций клеток и органов.
Дефицит микронутриентов может привести к генетическим повреждениям клетки *. Недостаток витаминов В12, В6, С и Е; фолиевой кислоты; ниацина и цинка по своей возможности окислительного повреждения ДНК может быть сравним с воздействием радиации *. А недостаток жирных кислот омега-3 как фактор смерти от всех причин может быть сравним с курением. Добавки недостающих элементов могут снизить риск заболеваемости, усилить терапевтический эффект основного лечения, обеспечить безопасное метаболирование эстрогенов. А также предотвратить другие дегенеративные заболевания и улучшить состояние здоровья в целом.
Хронический дисбаланс или дефицит в организме любых макро- и микроэлементов, необходимых для каждой ткани и органа человека, в конечном итоге приводит к появлению дисбаланса физиологических процессов и нарушениям функций организма, проявляющихся в виде разнообразных заболеваний. Это заставляет самым серьёзным образом отнестись к составлению своего рациона, и его корректировке за счёт добавок тех веществ, недостаток которых испытывает организм.
Значительную часть добавок, рассмотренных ниже, составляют незаменимые вещества, дефицитные для большинства населения Украины. Незаменимыми они называются потому, что человеческий организм не способен синтезировать их самостоятельно из других молекул, и поэтому вынужден получать извне. Идеальный источник обеспечения организма достаточным количеством всех необходимых незаменимых веществ – это разумные объёмы сбалансированной диеты. К сожалению, очень часто они поступают в организм в количествах, недостаточных для нормального метаболизма. В таких случаях требуется коррекция питания в виде добавок, и поэтому такие добавки называются корректирующими.
Одни из незаменимых веществ могут быть недостаточны по географическим причинам – это такие, как йод, селен или витамин D. Другие – по причине нарушения метаболизма или вследствие бактериального дисбаланса в кишечнике. Третьи – по причине несбалансированного питания. В результате возникает опасение, что намеченное нами ограничение суточной калорийности питания 2'200 килокалориями может не обеспечивать адекватного поступления необходимых, в том числе незаменимых веществ.
В самом деле, анализ четырёх самых популярных в США научно разработанных систем питания * показал реальность такой угрозы. Все эти диеты оказались несбалансированными, и не смогли обеспечить достаточного уровня потребления с пищей витаминов В4, В5, В7, E, D, цинка, йода и хрома. Для того, чтобы удовлетворить рекомендуемые нормы потребления витаминов и минералов, продукты, включённые в эти диеты, придётся потреблять в таких количествах, которые обеспечат 3'500 ккал в сутки. Что чуть ли не вдвое превышает рекомендуемые Американским институтом питания 2'000 ккал/сут.
Увеличение количества потребляемой пищи не означает автоматического улучшения полноценности питания, если структура рациона не будет скорректирована. Согласно данным Центра по контролю и профилактике заболеваний (Center for Disease Control and Prevention) от 2012 года *, заметная часть населения США испытывает дефицит определённых витаминов и минералов, потребляя при этом избыток калорий.
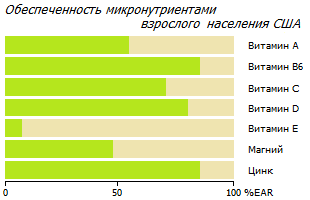
Согласно данным Национального исследования здоровья и питания США (NHANES), в 2005 году 93 % взрослого населения США не удовлетворяли расчетной средней потребности (EAR) в витамине E, 56 % – в магнии, 44 % – в витамине A, 31 % – в витамине C, 14 % – в витамине B6 и 12 % – в цинке *. Кроме того, мировой проблемой является дефицит витамина D. По оценкам, 1 миллиард человек в мире страдает либо дефицитом, либо недостаточностью витамина D *.
Анализ питания † групп стран с разной заболеваемостью раком груди показывает, что даже в «благополучных» странах недостаточное поступление с пищей некоторых витаминов (A, β-каротина, B2, B9, D, E) и химических элементов (кальция, йода, фтора) является широко распространённой проблемой. И если пищевой дефицит витамина D можно компенсировать солнечным облучением, то с другими веществами проблему можно решить только путём дополнительного их потребления.
Необходимость в добавках может возрасти при некоторых заболеваниях, а также при многих популярных ныне диетах. Попытка снизить калорийность питания за счёт уменьшения её объёма также может привести к сокращению обеспечения организма незаменимыми веществами, что заставляет более тщательно отнестись к составлению номенклатуры рациона. Несмотря на то, что пищевые продукты являются более выгодным источником минералов и витаминов, чем добавки, полное обеспечение норм поступления микронутриентов из пищи представляется проблематичным.
Действительно, довольно сложно составить полноценный рацион с калорийностью уже в 2'500 ккал, а тем более с калорийностью в 1'600 ккал. И даже при идеально составленном рационе приходится строго следить за ним, чтобы избежать недостатка или дисбаланса микронутриентов, что также довольно непросто, хлопотно и некомфортно.
Кроме того, в отдельных случаях могут иметься индивидуальные генетические особенности, вынуждающие прибегать к той или иной добавке. Следует учесть, что если дефицит того или иного элемента или незаменимого вещества является следствием генетических проблем или какой-то болезни (диабет, ацидоз, хроническое системное воспаление и т.п.), то их добавки поддержат организм, но не решат проблему принципиально.
Наконец, существует проблема, называемая кризисом среды обитания. Наша пища год от года становится всё беднее минералами и микроэлементами *, что связано с истощением плодородной почвы вследствие интенсификации сельского хозяйства. Современный человек не получает такого количества микронутриентов, которые получал человек каких-то двести-триста лет назад, при тех же объёмах или при той же калорийности пищи. Всё это также склоняет к необходимости компенсации недостатки пищевого потребления путём приёма тех или иных добавок.
К критическому недостатку в организме тех или иных метаболически важных агентов способны приводить разнообразные однонуклеотидные полиморфизмы (SNP). Чаще всего встречаются следующие негативные аномалии и/или их комбинации:
- плохое поглощение витамина В12 – полиморфизмы rs602662 (A;G), (G;G), rs601338 (A;G), (G;G),
- плохой метаболизм фолиевой кислоты – полиморфизмы rs1801133 (T;T),( C;T), rs1801131 (C;C), (A;C),
- плохой синтез витамина В – полиморфизмы rs10741657 (G;G), rs12794714 (А;А), rs2060793 (А;А),
- плохой синтез витамина А – полиморфизмы rs7501331 (С;Т) (Т;Т), rs12934922 (А;Т) (Т;Т),
- плохой синтез фосфатидилхолина – полиморфизмы rs7946 (Т;Т) (С;Т), rs174548 (G;G) (C;G),
- плохое преобразование ALA в EPA – полиморфизм rs1535 (G;G),
- нарушенный метаболизм жирных кислот – полиморфизмы rs429358 (C;T), rs7412 (C;C), rs429358 (C;C), rs7412 (C;C).
Выявить их можно путем геномного анализа. Таким людям следует вместе со специалистом серьёзно рассмотреть вопрос приёма соответствующих добавок на постоянной основе.
Как показывает опыт Центра интегративного лечения рака Кейта Блока, использование комплекса витаминов, минералов, микроэлементов в сочетании со здоровой диетой и образом жизни позволяет примерно вдвое увеличить выживаемость пациентов с запущенным метастатическим раком груди по сравнению с пациентами с одним только традиционным лечением *.
Неясным, однако, остаётся вопрос, какие именно нужно принимать добавки конкретному пациенту, в каких дозах, с какой продолжительностью, и нужно ли ему принимать их вообще. Несмотря на типичные региональные дефициты, каждый человек может иметь специфические индивидуальные дефициты и/или дисбалансы витаминов и минералов, определить которые можно лишь с помощью анализов, и то не всегда достаточно точно. Таким образом, вопрос приёма добавок решается строго индивидуально.
При этом следует остерегаться бездумного и бесконтрольного потребления добавок. Незаменимые вещества должны поступать в организм в достаточных, но не в чрезмерных количествах.
Витамины. На сегодня известны несколько незаменимых веществ, называемых витаминами. Каждый из витаминов, как правило, является кофактором большого количества ферментативных процессов, поэтому дефицит даже одного из них способен вызвать целый спектр заболеваний.
Витамины разделяются на водо- и жирорастворимые.
Витамин C и витамины группы B являются водорастворимыми. Они легко всасываются из пищи и не требуют для транспортировки кровью специальных белков-переносчиков (за исключением витамина B12). Избыточное количество этих витаминов не приводит к негативным последствиям; оно быстро выводятся почками, а витамины B9 и B12 выделяются с желчью.
Витамины A, D, E, и K являются жирорастворимыми. За исключением витамина K, они могут накапливаться в печени и жировой ткани организма, обеспечивая определённый буферный запас, и поэтому могут потребляться не так регулярно, как водорастворимые витамины. Для всасывания в лимфатическую систему жирорастворимым витаминам требуется желчь, поступающая из кишечника.
При адекватном питании и метаболизме организм способен получать витамины в необходимых объёмах. Некоторые витамины могут в достаточных количествах вырабатываться кишечной микрофлорой при благоприятных для соответствующих кишечных бактерий условиях. Это, главным образом, витамины B1, B2, B6, B7, B9, B12, C, K, а также никотиновая и пантотеновая кислоты.
Проблемой, однако, являются как адекватное питание, так и адекватная микрофлора, что может вызвать необходимость временного приёма добавок и/или пребиотиков/пробиотиков. Болезненное состояние организма, период лактации, генетические аномалии или преклонный возраст также могут вызывать повышенную потребность в тех или иных витаминах или химических элементах. Кроме того, значительная часть витаминов теряется при рафинировании цельных продуктов и при термообработке пищи.
Несмотря на свою потенциальную пользу, витаминные добавки в принципе не являются хорошей идеей, и не должны заменять здоровую пищу в качестве источника необходимых питательных веществ. Но так же, как костыли бывают нужны при переломах ноги, добавки могут понадобиться либо временно – при пищевых дефицитах витаминов или химических элементов, либо постоянно – при дефицитах, обусловленных генетически.
Нормы физиологической потребности каждого из витаминов для женщин в возрасте 18-60 лет представлены в таблице выше. Для других возрастных групп они могут быть несколько иными *. Рекомендации Министерства охраны здоровья Украины и Европейского агентства по безопасности пищевых продуктов * очень близки к рекомендациям Национальной Академии США (RDA/AI) *, и Института медицины США *, на которые мы и будем ориентироваться далее.
Заранее заметим, что понятие «нормы потребления» витаминов весьма лукавое. Эти нормы выведены в результате обсуждений, а не в результате каких-то экспериментов или вычислений *. Научные методы определения нормы потребления отсутствуют. В самом деле, никто не может эмпирически вычислить, какое количество того или иного витамина требуется для обеспечения всех тех биохимических реакций организма, в которых они участвуют. И в тех состояниях, в которых организм находится.
Те нормы, которые предлагаются медицинскими организациями, выведены из уровней потребления, которые позволяют избежать явного дефицита витаминов и появления связанных с этим болезней, таких, как цинга или бери-бери у 97-98 % населения. Но это совсем не значит, что их окажется достаточно для адекватного выполнения некоторых метаболических функций.
Анализ уровня витаминов в организме обычно осуществляют по их уровню в крови, а не по их уровню внутри клеток, где они действительно работают в качестве коферментов внутриклеточных ферментов. Насколько концентрация витаминов в крови соответствует их концентрации внутри клеток, остаётся вопросом открытым.
Кроме того, в рекомендациях этих норм не учитывается, что основным источником некоторых витаминов (например, многих витаминов группы В) является не пища, а кишечные бактерии. При здоровой микрофлоре толстого кишечника и достаточном питании кишечных бактерий добавки таких витаминов, скорее всего, и не потребуются. И наоборот, при нездоровой микрофлоре предлагаемые нормы могут оказаться недостаточными. Другими словами, при определении дозировки добавок витаминов нужно учитывать не только их базовый уровень в организме, но также учитывать состояние здоровья всего организма. К счастью, безопасная доза водорастворимых витаминов группы В в десятки раз выше рекомендуемых норм. Однако того же нельзя сказать обо всех остальных витаминах и витаминоподобных веществах.
Попробуем сравнить рекомендуемый минимум потребления витаминов с фактическим их потреблением у наших предков.
По расчётным оценкам, человек позднего палеолита ежесуточно потреблял ~ 600 мг витамина С, что 8 раз выше рекомендуемой нормы. В сравнении с современным человеком, он потреблял больше: каротина – в 1,7 раза; витамина А – в 2,7 раза; рибофлавина – в 3,6 раза; фолата – в 1,5 раза; тиамина – в 2,6 раза; аскорбата – в 8,4 раза; витамина Е – в 3,1 раза *. Хотя формально такие данные не являются доказательством необходимости потребления высоких доз этих витаминов, они заставляют засомневаться в убедительности рекомендаций, предложенных официальными органами.
Относительно рака могут быть рассмотрены три периода коррекции пищевыми добавками: 1) профилактика; 2) время обычного лечения после постановки диагноза и 3) послетерапевтический период.
Витамины для профилактики. Жирорастворимые витамины имеют, как правило, плохое усвоение. А водорастворимые витамины имеют склонность быстро выводиться из организма, что требует их постоянного потребления с пищей. В противном случае может возникнуть сначала недостаток, а затем и дефицит многих витаминов, что может повысить риск различных заболеваний.
• Витамин A *. С пищей в организм могут попадать две формы витамина А: 1) предварительно сформированный витамин А, который содержится в продуктах животного происхождения (например, печень, цельное молоко) и абсорбированный в виде ретинола; и 2) каротиноиды провитамина А, полученные из фруктов и зелёнолистных овощей и превращённые в ретинол уже после приёма внутрь. Большинство добавок содержат предварительно сформированный витамин А.
У пожилых женщин β-каротина в значительной мере обратно связан с уровнями эстрадиола *. Соответственно, в пременопаузе более высокие концентрации в плазме α- и β-каротина ассоциируются с более низким риском ER– подтипов рака груди * *. Кроме того, γ- и δ-токоферолы также являются эффективными натуральными средствами для профилактики и лечения эстроген-чувствительных подтипов рака молочной железы *. Правда, не все исследования согласны с таким выводом *.
Два широко известных клинических исследования обнаружили отрицательную роль сверхвысоких доз витамина А у курильщиков. В первом исследовании добавки 30 мг (50'000 МЕ) бета-каротина плюс 7,5 мг (25'000 МЕ) витамина А (ретинола пальмитат) увеличивали у курильщиков, и у людей, подверженных воздействию асбеста, риск рака лёгких на 28 % и смертность на 17 % по сравнению с контролем *. А во втором исследовании добавки 20 мг (33'333 МЕ) бета-каротина повышали риск рака лёгких более, чем на 16 % у людей, куривших не менее 5 сигарет в день *. Интересно, что у женщин, принимавших участие в исследовании, показатели риска рака, риска инфаркта и показатели смертности были вдвое выше, чем у мужчин.
При этом допустимый верхний уровень потребления (UL) для витамина А составляет 3 мг/сут, т.е. в 7-10 раз ниже. Таким образом, полученный в этих исследованиях негативный результат говорит, скорее, о вреде передозировки витамина А, чем о вреде его как такового. Умеренные дозы ретинола, в отличие от избыточных доз бета-каротина, не увеличивают риск рака *, а скорее, уменьшают его *.
Дополнительные исследования пролили новый свет на парадоксальный эффект витамина А. Негативные эффекты приёма синтетического альфа-токоферола наблюдались лишь у курильщиков, продолжавших курить во время лучевой терапии. Курение сигарет до или после лучевой терапии не влияло на действие добавок альфа-токоферола (400 МЕ/сут) и бета-каротина (30 мг/сут). Однако среди куривших во время лучевой терапии риск рецидива был в 2,4 раза выше, а риск смертности от всех причин – в 3,4 раза выше *.
• Витамины B2 *, B6 *, B9 * и B12 *. Результаты обзоров и мета-анализов показывают, что повышеное потребление витаминов B2, B6 и B9 может снизить риск рака груди, хотя фактически их влияние не было значительным * *. При этом фолиевая кислота и витамин B6 могут снизить риск ER– и PR–, но не ER+ и PR+ подтипов рака груди. Например, увеличение потребления фолиевой кислоты на 100 мкг/день соответствует 7 %-ному снижению риска смерти от ER–/PR–-рака груди.
Одной из причин такой замечательной ассоциации является способность этих витаминов держать на низкой отметке уровень гомоцистеина, который является провоспалительной молекулой. Преобразование получаемого из белковой пищи метионина в гомоцистеин и обратно осуществляется с участием витаминов B12, B9, B6. Недостаток любого из них влечёт за собой накопление гомоцистеина, повреждающего клетки и ткани, и связанного с этим повышение воспалительного уровня.
В специальном исследовании оптимальными были названы следующие профилактические дозы: B2 – 3 мг/сут; B6 – 2-4 мг/сут; B9 – 350-550 мкг/сут; B12 – 8-10 мкг/сут. Т.е. такие, которые вдвое превышают текущие рекомендации *.
• Витамин B3 (ниацин, никотинамид, ниацинамид, витамин PP) * известен как мощный усилитель врожденной иммунной системы, помогающий справляться с устойчивыми к антибиотикам бактериальными инфекциями, включая золотистый стафиллококк *. Ввиду того, что воспаление, вызванное инфекцией, является фактором, продвигающим опухоль, никотинамид потенциально способен снижать риск заболеваемости раком. Предполагается также, что ниацин является эпигенетическим модулятором, и усиливает экспрессию специфических антимикробных генов *.
Известно, что никотинамид (500-1'500 мг/сут) предотвращает ослабление кожного иммунитета, вызванного ультрафиолетовым излучением *, что снижает риск немеланомных видов рака кожи * и увеличивает эффективность местной фотодинамической терапии *. Доклинические исследования дают основания предположить профилактическую пользу никотинамида также при опухолях кишечника и мочевого пузыря *, поджелудочной железы *, печени *, лёгких * *, а также при аденокарциноме молочной железы *. Но клинических исследований профилактического действия витамина B3 в отношении рака молочной железы пока не обнаружено.
Одна из форм витамина B3 – рибозид никотинамида (2×500 мг), как показывают клинические исследования, улучшает митохондриальное дыхание клеток, добавляя им энергии * *.
Рекомендуемая суточная доза B3 составляет 16 мг, которая при здоровой микрофлоре кишечника может быть обеспечена адекватным питанием. В качестве профилактического средства (при отсутствии противопоказаний) допускается до 25 мг/сут. Однако для проявления упомянутого выше терапевтического эффекта требуется многократно большая доза, которую невозможно обеспечить из пищевых источников.
Хотя передозировка витамина B3 обычно не вызывает негативных последствий, делать это длительное время или в профилактических целях не рекомендуется. Дозировка такой формы витамина, как ниацинамид, считается токсичной при превышении 3 г/сут; а ниацин проявляет токсичность при ещё более низких дозах – примерно 2 г/сут.
• Витамин С, так же, как витамин A и ретиноиды, заметно снижает риск рака груди.
- Широкомасштабное многолетнее исследование резюмировало, что люди с более высоким уровнем витамина C в крови подвергаются значительно меньшему риску сердечно-сосудистых заболеваний и смерти от рака, и имеют до 25 % ниже риск смерти от всех причин
*.
- Потребление 300 мг/сут витамина С демонстрирует последовательную обратную связь с риском рака груди, особенно у женщин в постменопаузе (относительный риск для наивысшего и наинизшего квинтилей составляет 31 %)
*.
- Женщины пременопаузного возраста с семейной предрасположенностью к раку молочной железы, но потребляющие с пищей около 200 мг/сут витамина C, имеют на 63 % ниже риск рака молочной железы, в сравнении с женщинами, потребляющими около 70 мг/день
*.
- У женщин с избыточным весом, потреблявших 110 мг/сут витамина C, риск рака молочной железы был на 39 % ниже по сравнению с женщинами, потреблявших 30 мг/сут
*.
- Женщины с наивысшим потреблением витамина C до постановки диагноза рака молочной железы, на 25 % реже умирают от него, чем женщины с наинизшим его потреблением
*.
- По оценкам, общее потребление 380 мг/сут витамина С способно снизить риск рака груди у женщин в постменопаузе на 16 %
*.
Результаты всех этих исследований могут указывать на то, что современный человек потребляет недостаточное количество витамина C.
• Поливитамины. Существуют некоторые признаки того, что поливитаминные добавки могут снизить риск рака молочной железы у женщин, потребляющих более 10 г/сут алкоголя, а также снизить риск ER–/PR–-опухолей у всех женщин *. Тем не менее, результаты множества исследований связи между профилактическим потреблением некоторых витаминов и риском рака остаются либо неубедительными, либо противоречивыми *.
В одном из широкомасштабных исследований (SU.VI.MAX Study) изучалось влияние многолетнего приёма комбинации 120 мг аскорбиновой кислоты, 30 мг витамина Е, 100 мл селена, 6 мг β-каротина и 20 мг цинка. В качестве профилактики заболеваемости раком, добавки оказались более полезными для мужчин, чем для женщин, что было связано с изначально более низким у мужчин уровнем антиоксидантов *. Но это не означает, что все женщины не испытывают дефицита антиоксидантов в целом, и конкретных витаминов и/или минералов в частности.
Важно также отметить, что во всех отмеченных выше исследованиях не был измерен изначальный уровень витаминов и антиоксидантов в организме. Возможно, положительный эффект являлся результатом достижения рекомендуемого уровня потребления витаминов у пациентов, или незначительного их превышения. В то время как 20-30-кратный их избыток, как это было в обоих рассмотренных выше исследованиях курильщиков, принимавших витамин А, лишь ухудшает ситуацию.
Действительно, более высокое потребление витаминов может заметно снизить заболеваемость раком по сравнению с более низким их потреблением * *, но это, похоже, касается случаев их дефицита. Потому что добавки витаминов в дозировках, превышающих рекомендуемое пищевое потребление (RDA), не снижают риск развития рака * * *. Более того, некоторые исследования сообщили о росте риска рака молочной железы у женщин, принимавших поливитамины в качестве профилактической меры *. Тем не менее, последний результат требует уточнения, что не все витамины опасны при передозировке.
На основе такой неоднозначной теоретической базы, для профилактики рака Онкологическое общество США (American Cancer Society) рекомендует в качестве источника витаминов только полноценную пищу *. В самом деле, адекватное питание, которое рассмотрено ранее †, теоретически способно удовлетворить физиологическую потребность в витаминах и обеспечить организм множеством биологически активных веществ, действующих синергично, чего не может обеспечить никакая единичная добавка.
К сожалению, на практике, в силу различных причин, даже здоровая пища может не покрывать дефицит незаменимых веществ *, к которым относятся и витамины. Сегодня у большей части людей потребление некоторых микронутриентов (витамины A, B6, C и D; фолиевая кислота; цинк и магний) из пищи ниже, чем рекомендованная суточная норма (RDA).
В таком случае приём витаминных добавок может быть оправдан в качестве профилактического или поддерживающего средства – для предупреждения или ликвидации витаминного дефицита. Это особенно важно для пожилых людей по причине того, что с возрастом неуклонно падает способность организма и синтезировать витамин D под действием солнечного света, а также способность усваивать витамин В12 из пищи. Не удивительно, что около половины людей в возрасте старше 51 года принимает добавки ежедневно *.
Приём витаминных добавок может быть оправдан также тем, что не только неадекватная диета, но и неадекватная микрофлора кишечника, а также многие терапевтические средства способны снижать поступление некоторых витаминов до уровня ниже физиологического. К примеру, длительный приём высоких доз метформина (≥ 850 мг) может до 20 % снизить усвоение витамина B12 у 10-30 % пациентов *, что влечёт серьёзные побочные эффекты, включая риск болезни Альцгеймера.
В целом, в качестве профилактики, добавки того или иного витамина будут безусловно полезными в случае их недостатка, однако в случае их значительной передозировки они не дадут никакой выгоды, а в некоторых случаях могут принести вред. Для определения адекватной дозировки любой из добавок следует ориентироваться не столько на рекомендуемые нормы потребления, сколько на лабораторный анализ их уровня в организме.
Несмотря на то, что лучший витаминный комплекс – это растительная пища, содержащая натуральные, а не синтезированные витамины, приём готового комплекса в виде добавок позволяет контролировать уровень принимаемых веществ. Некоторые мультивитаминные комплексы содержат в требуемом количестве все перечисленные витамины (например, OptiMen® для мужчин и OptiWomen® для женщин), хотя не всегда состав предлагаемых комплексов соответствует потребностям конкретной особы.
Витамины для лечения. Хотя добавки поливитаминов и минералов могут оказаться полезными после постановки диагноза рака груди, а также у выживших * * * *, среди клиницистов до сих пор нет единой позиции по поводу пользы приёма тех или иных добавок.
Считается, что раковые клетки нуждаются в заметно бо́льших количествах витаминов, чем нормальные клетки. Некоторые известные организации, занимающиеся исследованием рака, не советуют использовать какие-либо добавки для выживших после рака * и для предупреждения рака *. Это, например, Американское онкологическое общество (American Cancer Society), Всемирный фонд исследований рака (World Cancer Research Fund) и Американский институт исследований рака (American Institute for Cancer Research).
Тем не менее, рак часто сопровождается дефицитом многих питательных веществ, в том числе витаминов. Соответственно, нормальные клетки испытывают в них повышенную потребность. Логично предположить, что адекватное обеспечение клеток должно способствовать процессу заживления хронической раны, которой является опухоль. Однако и здесь важным обстоятельством будет дозировка, потому что мегадозы некоторых (но не всех) витаминов действительно могут не только не улучшить * *, но даже ухудшить такой показатель лечения, как выживаемость пациентов *.
Не будем также забывать о генетически обусловленных дефицитах тех или иных витаминов, что безусловно требует их регулярного приёма. В любом случае, витамины в рекомендуемых суточных дозах (или близких к ним) не являются лекарствами, и могут быть лишь вспомогательным средством.
• Комплексы витаминов и минералов. Широкомасштабное проспективное исследование показало, что у женщин с инвазивным раком молочной железы, которые принимали антиоксиданты (витамин Е, витамин C, поливитамины) в первые 6 месяцев после диагностирования заболевания, был ниже риск общей смертности на 18 % и риск рецидивов – на 22 %. Такая обратная связь наблюдалась независимо от того, использовались ли витамины одновременно с химиотерапией или нет, однако она наблюдалась только среди тех пациентов, которые не подвергались лучевой терапии *.
В другом исследовании пациенты, принимавшие высокодозовые дополнения, показали вчетверо бо́льший срок выживаемости, чем не принимавшие их *. Здесь использовались витамин C (12 г/сут), витамин В3 (ниацин, ниацинамид) – 1,5-3 г/сут, витамин В6 (пиридоксин) – 250 мг/сут, фолиевая кислота – 5-10 мг/сут, бета-каротин – 15-30 мг/сут, витамин Е – 0,5 мг/сут, селен, сульфат цинка, кальций, магний и другие добавки.
Сообщалось также, что влияние поливитаминных добавок может зависеть от величины опухоли молочной железы. При размере опухоли до 2 см, поливитамины снижали риск её развития, а при размере более 2 см, наоборот – повышали *.
Многие витамины работают в комплексе, и их совместный приём обеспечивает синергическое действие. Это, например, сочетание витаминов С и Е, D и К. У женщин в постменопаузе комбинация витамина C (500 мг/сут) с витамином Е (400 мг/сут) восстанавливает уровень антиоксидантов и уменьшает повреждение ДНК при химиотерапии рака молочной железы
*,
а также защищает от перекисного окисления липидов, вызванного лечением тамоксифеном (при 10 мг тамоксифена дважды в сутки)
*.
Комбинация витаминов С и К может повышать чувствительность раковых клеток к обычной химиотерапии
*
(5'000 мг С и 50 мг К3 в сутки
*).
Комбинация магния (100 мг), цинка (4 мг), кальция (400 мг) и витамина D (200 МЕ), принимаемая женщинами с синдромом поликистозных яичников дважды в день в течение 12 недель, оказывала сильное благотворное влияние на гормональные профили, биомаркёры воспаления и окислительный стресс
*.
Критически важные витамины при раке. Многие исследования показывают, что ткани раковых больных обычно обеднены некоторыми витаминами и минералами. Как минимум, это касается таких витаминов, как D и С, а также таких химических элементов, как йод, селен и цинк. Впрочем, их недостаток широко распространён и среди практически здоровых людей, подвергая их риску многих дегенеративных заболеваний.
При раке груди в разряд дефицитных чаще всего попадают витамины A, D, C, E, B2 и B9.
• Витамин А (ретинола пальмитат) * и его метаболиты регулируют рост, апоптоз и дифференцировку эпителиальных клеток, поэтому дефицит этого витамина может иметь трагические последствия для развития рака. Дефицит витамина A может также заметно ухудшить как врожденный, так и приобретённый иммунитет * *, особенно это касается активности клеток натуральных киллеров * *.
Кроме того, результаты некоторых исследований свидетельствуют о том, что такой метаболит, как ATRA (полностью транс-ретиноевая кислота), наделён антиэстрогенными свойствами, благодаря чему ER+-клетки обычно чувствительны к лечению ретиноидами *.
У женщин с раком груди на ранних стадиях, более высокое содержание каротиноидов в крови ассоциируется с более высоким показателем выживаемости в течение ближайших 7 лет *.
Ретиноевая кислота способна препятствовать восстановлению ДНК повреждённых излучением раковых клеток более эффективно, чем восстановлению ДНК нормальных клеток *. У пациентов с метастатическим раком груди в постменопаузе мега-дозы витамина A (350'000-500'000 МЕ/сут), принимавшиеся во время химиотерапии, значительно увеличивали количество полных ответов *. Однако после курса терапии продолжение приёма витамина A в таких высоких дозах, скорее всего, принесёт только вред. Добавки уже 5'000 МЕ/сут (1'500 мкг/сут) любого витамина А, кроме бета-каротина, могут, например, увеличить риск остеопороза.
В организме витамин А находится в пяти формах: ретинол, ретиналь, ретиноевая кислота, ретинилпальмитат и бета-каротин. Каждая из этих форм витамина А важна, потому что она выполняет функции, которые другие формы выполнить не способны. Ретинол поддерживает здоровье кожи, ретиналь – зрения, ретиноевая кислота – кожи и эпителиальной ткани, ретинилпальмитат нужен для сберегания запасов витамина А в печени. Бета-каротин может расщепляться, превращаясь в любую из перечисленных форм витамина А.
Существует много натуральных источников витамина A. Преобразованный витамин A (ретиниловые эфиры) содержится в некоторых продуктах животного происхождения, в то время как провитамин A (каротины) содержатся в тёмных цветных овощах и фруктах, а также в красном пальмовом масле. Потребность в витамине A при адекватном питании обычно легко удовлетворяется.
Рекомендуемая суточная доза витамина A составляет 1 мг, что требует не менее 12 мг бета-каротина. Допустимый верхний уровень потребления витамина A для взрослых установлен на уровне 3 мг/сут *. Тем не менее, исследования показывают, что потребление бета-каротина ниже 3,4 мг/сут увеличивает относительный риск рака молочной железы, как минимум, на 15 % *. С другой стороны, длительная многократная передозировка витамина A, как уже отмечалось выше, также может иметь негативные последствия. Помимо уже упомянутых негативных явлений, передозировка витамина A может свести на нет пользу для здоровья от приёма витамина D *.
Достаточность в организме витамина A можно уверенно определить лишь по его запасам в печени (до 1'400 мкг/г) при помощи биопсии, но такая процедура, естественно, неприемлема. Концентрация ретинола в плазме строго контролируется и начинает падать лишь тогда, когда его запасы в печени истощатся до уровня 20 мкг/г и ниже, что будет указывать на его катастрофический дефицит. Состояние здоровья может оказывать влияние на показатели ретинола в плазме, что делает прямой контроль его уровня проблематичным. Для этого используют менее точные косвенные методы.
• Витамин В8 (мио-инозитол, гексафосфат инозитола): до 1-2 г/сут
*.
Мио-инозитол проявляет выраженное профилактическое антиканцерогенное действие
*
*,
подавляет злокачественные преобразования
*,
способствует дифференцировке раковых клеток
*,
усиливает антипролиферативное действие адриамицина и тамоксифена
*,
радикально снижает уровень С-реактивного белка
*,
значительно снижает метастатические способности раковых клеток
*
*;
противодействует слипанию эритроцитов и смягчает побочные эффекты химиотерапии в отношении формулы крови
*.
При этом его антипролиферативный эффект и способность снижать образование колоний раковых клеток не зависят от подтипа рака молочной железы
*.
У пациентов, получавших 2×3 г смеси инозитола и IP6 (гексафосфат инозитола) в течение 6 месяцев химиотерапии (флюорацил, эпидоксирубицин и циклофосфамид), не наблюдалось изменения количества лейкоцитов и тромбоцитов в процессе лечения *. Нанесение 4 %-ного геля гексафосфат инозитола на грудь также значительно ослабляет побочные эффекты химиотерапии и улучшает показатели лейкоцитов и тромбоцитов *.
Комплекс, содержащий босвеллию (50 мг), мио-инозитол (200 мг), бетаин (175 мг), N-ацетилцистеин и витамины В2, В6, В9 и В12, в течение 6 месяцев уменьшает у женщин в пременопаузе размер фиброаденомы, не проявляя негативных побочных эффектов *. У курильщиков с дисплазией лёгких мио-инозитол (18 г/сут) в течение 6 месяцев значительно задерживал превращение доброкачественной опухоли в злокачественную *. Сообщалось также о случае 3-летней ремиссии метастатической меланомы после курса лечения IP6+инозит *.
Рекомендуемая профилактическая доза смеси инозитола и гексафосфат инозитола составляет 1-2 г/сут, а терапевтическая доза при раке составляет 8-12 г/сут *. Суточная доза 18 г перорального мио-инозитола в течение 3 месяцев не вызывает заметных негативных побочных эффектов *. Известным натуральным источником инозитола является мука бобов рожкового дерева (кэроб).
• Витамины В9 * и В12 *. Дефицит как первого, так и второго, широко распространены у населения «богатых» стран. Хотя обычно мы получаем достаточное количество витаминов группы В из пищи, во многих случаях может наблюдаться недостаток В12. Это может привести к уменьшению неканцерогенных метаболитов эстрогена и увеличению его канцерогенных метаболитов. Дефицит цинка, витаминов B6, B9 и B12 может привести к таким же сильным хромосомным поломкам, как и повышенная радиация *.
Более высокое потребление пищевого фолата может снизить риск рака молочной железы, однако степень снижения риска зависит от статуса менопаузы и статуса эстрогенового рецептора * *.
Высказываются опасения о пролиферативных последствиях приёма витаминов В6, В9 и В12. Например, фолаты способствуют метилированию оснований ДНК, влияя на уровни экспрессии различных генов (эпигенетический контроль). Это несколько объясняет их сложную роль, которая может нести как выгоду, так и вред. Однако широкомасштабные исследования свидетельствуют скорее об их сложной позитивной, чем о негативной роли.
Сообщалось о прямой связи между низким уровнем пищевого потребления фолатов и раком молочной железы *, однако относительно дозировки его добавок нет общего мнения. Американские общественные рекомендации составляют 400 мкг/сут фолиевой кислоты. Некоторые врачи даже рекомендуют увеличить её потребление до 2'500-5'000 мкг/сут * ради снижения уровня системного воспаления и сопутствующих ему заболеваний. Однако другие разумно предостерегают от таких безумно высоких дозировок, поскольку фолат, проникая через барьер кровь/мозг, может при высоких концентрациях вызывать конвульсии *.
В одном исследовании увеличение потребления фолата на 100 мкг/сут было связано с 23 %-ным снижением риска смерти от рака молочной железы *. В других исследованиях общее потребление 200-300 мкг/сут фолиевой кислоты снижает риск рака молочной железы, а 400 мкг/сут и более, наоборот, увеличивает его *. В одном из исследований, 800 мг фолиевой кислоты и 400 мг В12 увеличивали риск рака на 20-30 % *. Эти результаты, однако, оспариваются ретроспективным исследованием, охватившим 23 центра в 10 странах *.
Независимо от статуса менопаузы и гормональных рецепторов *, ежедневный приём 220 мкг фолата связан с более низким риском рака молочной железы *, а приём более 400 мкг – с более высоким риском *. Однако эти цифры, видимо, справедливы только для тех стран, где были проведены данные исследования, потому что в разных регионах пищевое потребление фолата может существенно отличаться. Тем не менее, общим правилом будет то, что как недостаток, так и избыток фолата в крови (выше 15,8 нг/мл *) повышает риск рака молочной железы *. Высокие концентрации фолата в плазме более опасны для женщин с мутацией генов BRCA1/2 *.
Во всех этих исследованиях, как во множестве подобных им, обращалось внимание лишь на конечные результаты, без учёта исходного уровня обоих витаминов. По причине этого, были сделаны противоречивые выводы, в результате чего не было выработано общего согласия относительно пользы и дозировки добавок В9 и В12 при раке молочной железы.
Ежедневный приём даже 100 мкг метилфолата и 2 мкг метилкобаламина значительно уменьшает риски заболеваний, которые связаны с дефектом гена MTHFR, наблюдаемого примерно у половины населения планеты, и снижает уровень гомоцистеина – одного из виновников воспаления. Метформин *, антациды, алкоголь *, высокий уровень эстрогенов * несколько истощают запасы витаминов B12 и B6, необходимых для метилирования ДНК и эстрогенов, что может сделать целесообразным приём этих витаминов. Строгая веганская диета может быть ещё одним основанием для приёма B12 (от 5 мкг/сут).
Проспективное исследование Национального обследования здоровья и питания (NHANES) показывает, что адекватное усвоение незаменимых веществ из пищи более эффективно, чем их усвоение из добавок *. Натуральные фолаты пищи отличаются от химической структуры синтетической фолиевой кислоты, используемой для обогащения пищевых продуктов, что определяет различный метаболизм *. Поэтому готовые натуральные фолаты, содержащиеся в пище, будут более удачным выбором, чем фолиевая кислота.
Для метаболизма фолиевой кислоты в фолаты требуется фермент дигидрофолатредуктаза. Но поскольку фолиевая кислота – это синтетическая форма фолатов, которая не содержится в натуральных продуктах, этот фермент дефицитен в печени человека *. Таким образом, скорость метаболирования фолиевой кислоты очень низка, особенно у людей с её невысокой активностью. А польза от её использования ограничена тем количеством дигидрофолатредуктазы, которую может предоставить печень пациента.
Неплохими пищевыми источниками витамина B9 являются: тёмно-зелёные листовые овощи, дыня, печень, авокадо, шпинат, спаржа и брюссельская капуста. Диета с высоким содержанием этих овощей может избавить от необходимости дополнительного приёма витаминов группы В. Если же фолатов из пищи поступает недостаточно, то лучше принимать их в виде добавок, чем испытывать их дефицит. Пищевыми источниками витамина B12 являются моллюски, мясо, яйца и кисломолочные продукты.
При использовании добавок, некоторые специалисты рекомендуют витамин B12 в метилированной форме (например, метилтетрагидрофолат), поскольку у значительной части населения имеется дефект гена, который связан с ферментом, метилирующим витамины группы B. Благодаря метилированной форме, организм сможет гарантированно получить B12 из добавки.
В общем случае, 250 мкг/сут фолиевой кислоты и 5 мкг/сут метилкобаламина будут, скорее всего, безопасны, хотя, возможно, и малоэффективны. Опять же, эти рекомендации относятся к населению «богатых» стран, т.е. к той группе населения, где в среднем наблюдается недостаточность этих витаминов. Однако даже в этих популяциях может наблюдаться значительный разброс требуемой величины добавок.
Витамины группы B являются водорастворимыми, и по этой причине очень трудно добиться их передозировки. Поэтому можно смело принимать в качестве добавки 5-10 мкг метилкобаламина ежедневно; избыток его просто перейдёт в мочу. Метилкобаламин полностью готов к усвоению, тогда как цианокобаламин требует предварительного метаболирования с участием антиоксидантного фермента (глутатиона). В то же время цианокобаламин более стабилен, тогда как метилкобаламин намного легче разрушается, особенно под воздействием света.
Считается, что содержание В12 в крови должно быть не менее 250 пг/мл *. Однако точно так же, как это имеет место с многими другими веществами, уровни B12 в крови не совсем соответствуют уровням B12 в клетках. На самом деле может быть серьезная скрытая функциональная недостаточность витамина B12, несмотря на то, что его уровень в крови нормальный. Непосредственное измерение уровня гомоцистеина или метилмалоновой кислоты будет более точным отражением функционального уровня витамина B12.
Достаточность поступления этих витаминов, так же, как и других нутриентов, косвенно и весьма приблизительно можно оценить, проанализировав состав своего рациона при помощи специализированных программ, таких как Diet Pro *, DietMaster *, DietOrganizer *, «Мой здоровый рацион» *. Метилкобаламин, в отличие от цианокобаламина, является более предпочтительной формой витамина В12.
• Витамин C * (L-аскорбиновая кислота, аскорбат калия, аскорбат натрия, аскорбат кальция): до 100-200 мг/сут.
Витамин C является незаменимым веществом и участвует в ряде критически важных биологических процессов. В частности, он принимает активное участие в митохондриальном дыхании клеток. Организм человека не способен синтезировать витамин C, и поэтому нуждается в постоянном его притоке. Уменьшение объёма сырой растительной пищи в рационе человека за последние столетие привело к существенному сокращению поступления в организм витамина C.
Дозировка витамина C может оказывать различное, и даже противоположное действие. Так, низкие его концентрации в крови действуют антиоксидантно, а высокие – прооксидантно. Соответственно, различают низко- и высокодозовую терапию витамином C.
Низкодозовая терапия. Воспалительные и опухолевые процессы сопровождаются образованием больших количеств свободных радикалов, что повышает потребность здоровых тканей в таких антиоксидантах, как витамины С и Е, с целью снижения окислительной нагрузки.
Любое серьёзное заболевание «сжигает» витамин C, потому что он активно расходуется на преодоление возникшей стрессовой ситуации. Исследования показывают, что у больных раком средний уровень витамина C в плазме ниже, чем у здоровых людей * *, что проявляется в виде гиповитаминоза (< 23 мкМ) или непосредственно дефицита (< 11 мкМ), причём по мере развития опухоли его уровень, как правило, неуклонно падает *. Показательно, что животные, способные синтезировать витамин C в своей печени, в условиях опухолевой нагрузки повышают уровень производства своего эндогенного витамина C * *, что может свидетельствовать о его повышенной потребности при раке.
Частое употребление витамина С и витамина Е после постановки диагноза рака груди было связано со снижением вероятности рецидива * *. После диагностирования заболевания витамин C обеспечивает 15 %-ное снижение относительного риска смерти от рака молочной железы в случае приёма его в виде добавки (400 мг/сут), а также обеспечивает 22 %-ное снижение в случае увеличения его потребления из пищевых источников (на 100 мг/сут) *. Последнее легко достигается при адекватном уровне потребления свежей растительной пищи, что избавляет от потребности в добавках витамина C.
Логично было бы предположить, что из-за своей антиоксидантной деятельности аскорбат может противодействовать эффективности лучевой и химиотерапии. Однако мета-обзоры проспективных исследований не подтверждают такую версию, и говорят, скорее, об обратном *. Это даёт основания полагать, что витамин C может защищать здоровые клетки от окислительного повреждения, не защищая при этом раковые клетки. Тем не менее, до сих пор существуют противоположные мнения по поводу дозировки, способу введения и уместности введения витамина С при терапии рака.
Химиотерапия с использованием таких препаратов, как цисплатин *, фторурацил *, нилотиниб *, интерлейкин-2 (IL-2) * и некоторых других, может значительно истощить уровень витамина C у онкологических больных. И хотя концентрация витамина C в плазме обычно возвращается к базовым значениям примерно через месяц после химиотерапии * *, она чаще всего остаётся значительно ниже оптимального.
В рандомизированном 5-месячном исследовании добавки витамина C (500 мг/сут) и витамина E (400 мг/сут) восстанавливали антиоксидантный статус организма, который был снижен во время химиотерапии *. В других исследованиях были сделаны аналогичные выводы после внутривенного введения витамина С * *. Учитывая важность витамина C для клеточного здоровья, приём низкодозовых добавок витамина C после постановки диагноза выглядит вполне оправданным. Но всё ещё остаётся спорным во время противоопухолевой терапии.
При гормональной терапии женщин с раком молочной железы в постменопаузе с применением тамоксифена добавки витамина C (500 мг/сут) с витамином E (400 мг/сут) в течение 3 месяцев ослабляли негативный эффект тамоксифена на уровни липидов и липопротеинов в плазме *. Комбинирование витамина C с витамином E тем более оправдано, поскольку вместе они работают лучше, чем порознь; а, кроме того, витамин E классифицируется как т.н. митокан, т.е. вещество, позволяющее отбраковывать нефункциональные митохондрии *.
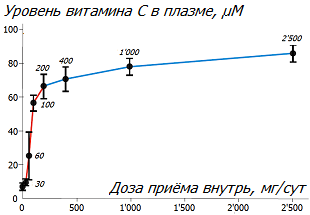
Степень поглощения аскорбата из кишечника в кровь зависит от величины принимаемой дозы *. Превышение однократной пероральной дозировки в 200 мг аскорбата обычно не даёт дальнейшего заметного увеличения концентрации витамина C в крови *, и имеет мало смысла. Такой эффект подводит к мысли, что это и есть требуемый для организма уровень потребления витамина C.
Поскольку витамин C очень быстро выводится из организма (период полувыведения ~ 1,5 часа), разработаны его т.н. буферированные варианты. Примером хорошего выбора является аскорбат кальция, который имеет нейтральную кислотность, быстрое клеточное поглощение и длительное удержание в крови (~ 8 часов).
В последнее время появляются новые выгодные предложения; например липосомальный витамин С, который при той же дозировке позволяет увеличить его усвоение в 5 раз по сравнению с чистым витамином С *.
Высокодозовая терапия. Витамин C может быть использован также как самостоятельное или дополнительное терапевтическое средство, однако для этого потребуются его высокая концентрация в крови, которая может быть достигнута лишь путём внутривенного введения. Высокая концентрация аскорбата создаёт большие количества перекиси водорода в межклеточном пространстве, что действует губительно на раковые клетки, у которых наблюдается дефицит антиоксидантных ферментов. Как видно из приведенного здесь рисунка, неопухолевые клетки успешно выдерживают такую концентрацию витамина C, которая для раковых клеток оказывается токсичной.

Кроме прооксидантного действия, аскорбат способствует восстановлению аэробного дыхания * путём снижения активности фермента лактатдегидрогеназа, который отвечает за преобразование пирувата в лактат *. Исследования in vitro показали, что аскорбат, особенно в комбинации с селеном, способствует возвращению клеток, находящихся в пред-раковом состоянии, к нормальному метаболизму * * *. Одной из возможных причин этого называлась дифференцировка клеток *.
В то время, как концентрацию аскорбата в крови можно относительно просто регулировать, его поступление внутрь клетки регулируется самой клеткой. И оно мало зависит от внеклеточной концентрации аскорбата. Тем не менее, высокие концентрации витамина C в микроокружении опухоли будут оказывать на неё губительное действие. В богатой кислородом среде кровеносных сосудов, аскорбат окисляется до дегидроаскорбата. А дегидроаскорбат проявляет окислительную токсичность в аэробных условиях. То есть, в таких, которые наблюдаются внутри опухоли, но не в нормальной ткани *.
Проникновение внутрь раковых клеток будет для витамина C менее проблематичным, чем внутрь нормальных клеток. Многие типы клеток транспортируют аскорбат в его окисленной форме (дегидроаскорбат) посредством облегчённых переносчиков глюкозы *. А поскольку раковые клетки имеют повышенную потребность в глюкозе, для её удовлетворения они увеличивают количество переносчиков глюкозы *.
Было проведено несколько клинических испытаний высокодозовой терапии витамином С. В одном из них аскорбат внутривенно (1,5 г/кг трижды в неделю) использовался в сочетании со стандартной химиотерапией. В исследовании принимали участие 14 безнадёжных пациентов, которым онкологи прогнозировали возможность положительного объективного ответа не более, чем 33 %. Тем не менее, у 6 пациентов высокодозовая терапия аскорбатом обеспечила кратковременную или длительную стабилизацию состояния с симптоматическим улучшением *.
Ещё одни клинические испытания показали, что большие дозы аскорбата по сравнению с его низкими дозами значительно увеличивают время выживания пациентов (246 дней против 43) *. Тем не менее, другие клинические испытания и исследования случай-контроль при различных условиях проведения не показали однозначной пользы аскорбатной монотерапии *.
Несколько клинических исследований свидетельствуют о синергическом эффекте сочетания аскорбата со стандартными химиопрепаратами при различных типах опухолей *. Текущие рекомендации высокодозовой витаминотерапии включают в себя следующие пункты: дозировка аскорбата должна составлять около 1 г/кг не менее 2 инфузий в неделю и на протяжении не менее 2 месяцев, а предпочтительно 3 месяца, и лишь после этого периода можно оценивать её эффективность *.
• Витамин D3 * (холекальциферол): 600-2'000 МЕ/сут (15-50 мкг/сут) летом, и 800-4'000 МЕ/сут (20-100 мкг/сут) зимой.
Витамин D является одним из ключевых компонентов нормального функционирования эндокринной, сердечно-сосудистой, нервной, иммунной и других систем и органов
*.
Витамин D регулирует также пролиферацию клеток. Одно из основных назначений витамина D – регулирование уровней кальция, магния и фосфатов организме. В активном состоянии ядерный рецептор витамина D (VDR) влияет на транскрипцию не менее 913 генов и влияет на многочисленные биологические процессы
*.
В отношении рака груди, витамин D обладает широкими возможностями. Он регулирует экспрессию генов, участвующих в развитии рака; стимулирует дифференцировку и апоптоз клеток; подавляет пролиферацию, ангиогенез, инвазию и воспаление; снижает метастатический потенциал опухоли; а также подавляет активность ароматазы, снижая тем самым уровень эстрогенной нагрузки * *.
Витамин D может действовать двумя путями: во-первых, проникая внутрь ядра клетки, и затем участвуя в экспрессии тех или иных генов *; и во-вторых, связываясь со своими рецепторами на поверхности клеток, и участвуя в клеточной сигнализации *. Войти в клетку и в клеточное ядро ему не составляет сложности, поскольку фактически витамин D является стероидоподобным гормоном.
Для того, чтобы витамин D мог проявлять свою активность, холекальциферол должен сперва преобразоваться в печени в 25(OH)D3 (25-гидроксивитамин D), называемый кальцидиолом. А далее, в основном, в почках, он должен превратиться в 1,25(OH)2D3 (1,25-дигидроксивитамин D), называемый кальцитриолом. При этом 25(OH)D3 является формой, запасаемой организмом для хранения, а 1,25(OH)2D3 является водорастворимой формой, активно участвующей в биохимических процессах организма.
В опухолевых клетках витамин D стимулирует апоптоз и дифференцировку, а также тормозит ангиогенез и пролиферацию *. Витамин D активирует иммунные Т-клетки и способствует их дифференцировке *. Соединения витамина D также обладают способностью регулировать в раковых клетках молочной железы фактор роста и передачу сигналов цитокинов *. Витамин D3 и его аналоги подавляют пролиферативную активность IGF-1 в раковых клетках молочной железы за счёт увеличения экспрессии белков, связывающих IGF-1 *.
Кроме того, витамин D способствует повышению кишечного всасывания фосфора и кальция, что ограничивает потерю костной массы *, в том числе, вызванную отменой тамоксифена *. Наконец, витамин D снижает воспаление *, уменьшает жёсткость кровеносных сосудов *, способствуя снижению кровяного давления, а также снижает инсулинорезистентность *.
Различают дефицит витамина D (< 20 нг/мл, т.е. < 50 нМ/л), его недостаточность (20-30 нг/мл, т.е. < 75 нМ/л), и оптимальные уровни в сыворотке (30-80 нг/мл, т.е. 75-125 нМ/л). Токсичным считается уровень выше 250 нМ/л.
Имеющиеся данные позволяют предположить прямую зависимость между недостаточностью витамина D в организме и заболеваемостью раком молочной железы. Из приведенного здесь графика ассоциации концентрации 25(OH)D в крови и заболеваемостью раком груди очевидно, что наименьший показатель заболеваемости достигается при уровне ~ 100-125 нМ/л, т.е. ~ 40-50 нг/мл. Ни в одной стране мира средние значения концентрации 25(OH)D в сыворотке не превышают этого значения. Данные графика подтверждаются результатами многочисленных исследований * * * *.
Метаанализы показывают, что более высокие уровни витамина D против более низких его уровней коррелируют со статистически значимым снижением риска развития рака и снижением риска смерти раковых пациентов
*
*
*.
Снижение относительного риска было вдвое больше среди женщин в постменопаузе, и оно не зависело от статуса гормонального рецептора опухоли
*
*.
Уровни 25(OH)D выше 75 нМ/л против уровня ниже 50 нМ/л ассоциируются с понижением риска рака молочной железы в ближайшие 7 лет – на 20 % у женщин до 60 лет, и на 36 % у женщин старше 60 лет
*.
Женщины с уровнем 25(OH)D в крови выше 40 нг/мл, по сравнению с женщинами с уровнем ниже 20 нг/мл, имели на 44 % ниже риск рака молочной железы
*.
А женщины с уровнем 25(OH)D выше 60 нг/мл, по сравнению с женщинами с уровнем ниже 20 нг/мл, имели уже в 5 раз ниже риск рака молочной железы
*.
В другом аналогичном исследовании эта разница была ещё более выразительной – 6,8 раза
*.
Ещё в одном подобном исследовании было показано, что концентрация витамина D в плазме > 50 нМ/л по сравнению с концентрацией < 50 нМ/л, снижает риск заболеваемости раком молочной железы в 3,5 раза
*. Однако это были самые выразительные цифры из всех подобных исследований; остальные исследования показали намного менее благоприятные результаты.
Мета-анализ показывает, что каждые 4 нг/мл повышения уровня 25(OH)D линейно снижает риск смерти от рака молочной железы на 6 %, а каждые 10 нг/мл повышения уровня 25(OH)D – на 14 %
*.
Наконец, в 4-летнем двойном слепом клиническом исследовании, добавки 27,5 мкг/сут (900 МЕ) витамина D и 1'500 мг/сут кальция снижали у женщин в постменопаузе риск заболеваемости на 77 % по сравнению с контролем
*.
Дефицит витамина D широко распространён у женщин с раком молочной железы
*,
и растущее число фактов указывает на то, что существует весьма значимая линейная дозозависимая связь между уровнем циркулирующего 25(OH)D и общей выживаемостью у пациентов с раком молочной железы
*.
Низкая концентрация витамина D в крови ассоциируется не только с повышением заболеваемости раком молочной железы
*
*,
но также с более агрессивными его типами и с более неблагоприятным прогнозом
*.
При уже имеющемся раке молочной железы, уровни 25(OH)D выше 30 нг/мл ассоциируются со снижением смертности пациентов более, чем на треть по сравнению с уровнем ниже 20 нг/мл
*.
В одном исследовании ранее лечившиеся от рака молочной железы женщины с высоким уровнем витамина D в крови показали на 28 % более высокую 8-летнюю выживаемость, чем женщины с низким уровнем
*.
В другом исследовании женщины с дефицитом витамина D на момент диагностики рака молочной железы имели на 94 % больше вероятности дальнейшего распространения опухоли, и на 73 % больше вероятности умереть в течение следующих 10 лет, по сравнению с женщинами с достаточным уровнем витамина D
*.
И наборот, женщины с высоким уровнем 25(OH)D в плазме летом (выше 32 нг/мл), по сравнению с женщинами с его низким уровнем (ниже 17 нг/мл), имели значительно более низкий риск развития рака молочной железы
*.
Тот факт, что у афроамериканок заболеваемость
*
и агрессивность
*
рака груди значительно хуже, чем у белых американок, может, среди прочего, объясняться более восприимчивой к ультрафиолету светлой кожи у белых людей и, соответственно, более высоким уровнем 25(OH)D у светлокожих американцев.
Данные мета-анализа показывают, что при уровне 30 нг/мл показатель смертности в течение 9 лет после постановки диагноза примерно вдвое ниже по сравнению с уровнем 17 нг/мл – средним уровнем, наблюдающимся у пациентов с раком молочной железы в США на момент диагностики
*.
У женщин с инвазивным раком молочной железы в возрасте 50-80 лет постоянные добавки более 400 МЕ/сут витамина D после постановки диагноза уже через год были связаны с заметным снижением смертности
*.
Рак молочной железы является одним из немногих видов рака, диагностика которых имеет сезонный характер, с самыми высокими показателями диагностики весной и осенью. Предполагается, что выработка витамина D под действием солнечного ультрафиолета снижает риск рака молочной железы летом, а более высокие концентрации мелатонина снижают риск зимой
*.
Дефицит витамина D связан не только с риском рака молочной железы. Мета-анализ наблюдательных исследований сообщил об обратной корреляции уровня 25(OH)D в сыворотке с заболеваемостью 12 типами рака. Анализ показателей заболеваемости раком 25(OH)D позволяет предположить, что достижение уровня 80 нг/мл (200 нМ/л) по сравнению с 10 нг/мл (25 нМ/л) снизит уровень заболеваемости раком ~ на 70% *.
Крупное десятилетнее когортное исследование показало, что у лиц с дефицитом (30-50 нМ/л) или глубоким дефицитом витамина D (< 30 нМ/л), общая смертность выше, соответственно, в 1,17 и в 1,71 раза по сравнению с лицами, не имеющими его дефицита (> 50 нМ/л). Дефицит витамина D оказался связан с более высокой сердечно-сосудистой смертностью (в 1,39 раза), а также смертностью от рака (в 1,42 раза) и от респираторных заболеваний (в 2,5 раза) *. Ассоциация между концентрацией витамина D в сыворотке и смертностью от рака была выявлена даже в тех метаанализах, которые не подтвердили ассоциацию между витамином и заболеваемостью раком * *.
Отрицательная связь концентрации 25(OH)D в сыворотке со смертностью от всех причин выявилась нелинейной, резко увеличиваясь при концентрациях 25(OH)D < 75 нМ/л *, и совпадая с порогом роста заболеваемости раком груди. С дефицитом витамина D ассоциируется не только рак, но также диабет II типа *, болезнь Альцгеймера *, деменция * и рассеянный склероз * *. Риск гипертонии также возрастает при снижении уровня 25(OH)D в сыворотке. У лиц с недостатком витамина D (< 75 нМ/л) этот риск вдвое выше, чем у лиц с его безопасным уровнем (> 100 нМ/л) *.
Нехватка витамина D является серьёзной глобальной проблемой * *. Недостаток витамина D наблюдается у 70 % населения Европы * *. Во Франции, например, недостаток витамина испытывает около 80 % населения, а его дефицит – 35 %; причём к концу зимнего периода эти цифры становятся ещё драматичнее. Лишь около 20 % взрослых французов имеет уровень 25(OH)D в сыворотке выше 30 нг/мл *. Исследование почти 56 тысяч человек в Европе, показало, что 40,4 % из них имели дефицит 25(OH)D, особенно люди с более тёмной кожей *. Во всем мире 37,3 % имеют дефицит 25(OH)D, причём его статус не показал зависимость от географической широты *. Жители многих африканских стран имеют такой же дефицит, как и жители европейских стран, если даже не ещё больший *.
Особо важен адекватный уровень витамина D в период полового созревания, когда грудь развивается, и в период от менархе до первой беременности, когда клетки груди ещё окончательно не созрели. У девочек-подростков с самым высоким уровнем в крови витамина D, риск рака молочной железы во взрослом возрасте оказывается на 50 % ниже, чем у девочек с самым низким его уровнем *. Здесь достаточный уровень потребления витамина D был оценён в 25 мкг/сут, т.е. в полтора раза выше рекомендуемой нормы.
С годами способность кожи синтезировать витамин D неуклонно снижается. В возрасте 60 лет его производство падает в 4 раза по сравнению с 20-летним возрастом, поэтому по мере старения организма необходимость в добавках витамина D возрастает. Потребность в поступлении витамина D увеличивается также при неадекватном его усвоении, тёмном цвете кожи, недостаточном солнечном облучении, а также при избытке жировых запасов в организме. Многие инфекционные болезни могут подавлять рецепторы витамина D, блокируя его усвоение. Инсулинорезистентность, избыточный вес, недостаток желчных кислот, приём блокаторов усвоения жира из пищи также ухудшают усвоение витамина D, и легко могут вызывать его дефицит.
Кроме того, химиотерапия снижает уровень витамина D в организме *, вынуждая нас компенсировать его недостаток за счёт добавок *. Наконец, некоторые генетические полиморфизмы могут ухудшать способность организма вырабатывать витамин D. Людям с подобными генетическими особенностями приём витамина D является вопросом жизни.
Пополнять запасы витамина D можно эндогенно – путём выработки его в коже под действием ультрафиолетового облучения (~ 295-315 нм), либо экзогенно – путём потребления пищи с высоким содержанием витамина D, или путём приёма специализированных добавок. Первый вариант пищевого поступления витамина D предпочтительнее *, однако пищевых источников для пополнения в организме запасов витамина D может оказаться недостаточно, потому что для этого придётся потреблять их в чрезмерных объёмах. Например, для обеспечения адекватного уровня витамина D потребуется съедать около 400 г жирной сельди ежедневно, а это может повлечь за собой другие дисбалансы в организме.
Солнечный свет – естественный и наилучший способ повысить уровень витамина D в организме. Это намного лучше, чем получать его в виде добавок. Солнечный свет также позволяет естественно управлять другими гормонами, такими как мелатонин, серотонин, кальцитонин и меланоцит-стимулирующий гормон; регулировать циркадные ритмы, снижать общий воспалительный уровень и благоприятно влиять на иммунную систему. В летнее время ежедневное полуденное солнечное облучение всего тела в течение 20-30 минут может привести у белых людей к выделению примерно 10'000 МЕ витамина D *, который способен запасаться в жировой ткани на зимнее время. Однако если солнцу доступны лишь лицо и руки, производство витамина D будет ниже в 20 и более раз, что будет явно недостаточно для его адекватного синтеза. При недостатке в организме магния и калия витамин D будет вырабатываться под воздействием солнечных лучей ещё хуже.
Широко распространено мнение, что следует избегать прямых солнечных лучей, чтобы не спровоцировать появление меланомы или старения кожи. Конечно, лучевые ожоги представляют для кожи канцерогенный фактор, и их следует избегать. Тем не менее, солнцезащитные кремы нужны лишь как временная защита не защищённой загаром кожи в начале летнего сезона. Постоянное же их использование снижает выработку витамина D, что является канцерогенным фактором для всех остальных органов.
На самом деле, страх перед солнечным облучением не имеет рациональной основы. Если солнечная радиация не вызывает ожогов или раздражения кожи, она вряд ли будет вредной. Кроме того, нет никакой необходимости пребывания под прямыми солнечными лучами; достаточно длительного приглушённого или рассеянного света. В конце концов, как свидетельствует статистика, риск умереть от рака кожи вследствие чрезмерного солнечного облучения в несколько раз ниже, чем риск умереть от рака груди, вызванного нехваткой витамина D вследствие недостаточного солнечного облучения.
В Украине солнце активно лишь 3 месяца в году, а острая нехватка интенсивного ультрафиолетового спектра продолжается с октября по апрель. Зимой в Украине обычно пасмурно, а площадь тела, выставленная под солнечный свет, минимальна. В этот период альтернативой естественному воздействию ультрафиолета может стать посещение солярия. Однако стоит заметить, что облучение тела ярким светом (естественным или искусственным) должно происходить в первой половине дня, чтобы следовать естественному циркадному циклу день:ночь.
В случаях, когда ультрафиолетовое облучение под солнцем или в солярии оказывается либо недостаточным, либо невозможным, а пищевых источников витамина D недостаточно, то для ликвидации его нехватки приходится прибегать к применению добавок. Тем не менее, экзогенные источники витамина D не решают проблему дефицита солнечного света, обладающего более широким физиологическим действием, чем просто синтез витамина D *.
Витамин D лучше всего принимать на завтрак, т.е. во время трапезы, в которой рекомендуется наибольшее количество жиров. Это может значительно улучшить его поглощение. Кроме того, мелатонин, уровень которого повышается к вечеру, ухудшает усвоение витамина D. В жирорастворимой форме витамин D может приниматься один раз в неделю (недельная доза разово).
Существуют две основные доступные формы витамина D: D2 (эргокальциферол) и D3 (холекальциферол). Витамин D2 синтезируется в промышленных масштабах путём светового облучения дрожжей; и он должен быть преобразован организмом в D3, что не всегда случается. А витамин D3 под действием облучения синтезируется кожей животных, а также содержится в животной пище, и биологически идентичен человеческому.
Витамин в форме D2 малоэффективен * *, а его высокие дозы могут вызывать неблагоприятные побочные эффекты, такие как гиперкальциемия, в то время как в форме D3 даже бо́льшие дозы витамина, похоже, не дают побочных эффектов. Когда различные формы витамина D оценивались отдельно, то среди них только лишь витамин D3 статистически значимо снижал смертность от всех причин * *. В качестве удачного примера добавки можно назвать препарат Аквадетрим® *.
Естественно, возникает вопрос о дозировке добавок витамина D. Современные рекомендации составляют всего 15 мкг/сут, что явно недостаточно *. Рекомендации различных специалистов различаются в несколько раз. Как бы там ни было, основным показателем, определяющим дозировку витамина D, должна быть его концентрация в крови. Эндокринное общество (Endocrine Society) считает оптимальной концентрацию 25(OH)D у взрослых людей не ниже 75 нМ/л (30 нг/мл), и рекомендует принимать добавки витамина D в дозировке 1'500-2'000 МЕ/сут, но не более 10'000 МЕ/сут; хотя людям с ожирением норма должна быть увеличена *.
В то же время, возможность накопления витамина D в организме появляется при значении 25(OH)D в крови не ниже 40 нг/мл *. Кроме того, значение 50-55 нг/мл (125-140 нМ/л), похоже, обеспечивает наилучшую иммунную стойкость против вирусов; в частности, против SARS-CoV-19 *. Однако уровень витамина D, видимо, не должен превышать 100 нг/мл *. Специальная международная консенсусная конференция 2020 года посчитала верхним приемлемым уровнем 25(OH)D значение 125 нМ/л *.
Интересно отметить, что у приматов (павиан, горилл, шимпанзе), которые содержатся в европейских зоопарках, также наблюдается недостаточный уровень витамина D (30-40 нМ/л). Причём этот недостаток невозможно было компенсировать путём добавок. В то время как после перевоза этих шимпанзе на солнце на Гавайях, их средний уровень 25(OH)D поднимался до 97 нМ/л *. Средний уровень 25(OH)D у приматов в дикой природе колеблется от вида к виду. Например, у павиан он составляет 150-315 нМ/л. Однако это не означает, что такое значение должно быть целевым для человека.
Таким образом, уровень 25(OH)D, к которому следует стремиться – 40-50 нг/мл (100-125 нМ/л) *. Именно такого среднего уровня достигают коренные жители экваториальной зоны Африки * *, тогда как жители Украины зимой имеют в среднем около 12 нг/мл *, т.е. фактически испытывают серьёзный дефицит. В условиях, когда естественное солнечное облучение является основным единственным источником витамина D, для достижения его уровня 50 нМ/л зимой требуется, что летом его уровень достигал 100 нМ/л * *.
Как можно определить дозировку добавок для ликвидации этого дефицита?
Прежде чем начать обсуждение дозировок, обратим внимание на то, что витамин D, вырабатываемый под влиянием ультрафиолета, и получаемый в виде добавок внутрь, имеет разную биологическую ценность. Это факт может быть причиной расхождений в выводах исследований, в которых не делалось различие между ними. Механизмы транспорта и обработки из этих двух источников совершенно различаются. Избыточное потребление добавок витамина D (> 10'000 МЕ/сут) может вызывать гиперкальциемическую токсичность, в то время как эндогенное его производство под действием ультрафиолета не грозит никакими негативными последствиями. Эксперименты на животных показали, что длительный пероральный приём витамина D в явно нетоксичных количествах вызывает атеросклероз в крупных артериях *.
Это, конечно, говорит не о вреде самого витамина D, а о необходимости получать его естественным путём – от солнечного света. И только когда достижение требуемой концентрации 25(OH)D в крови невозможно получить этим путём, приходится допускать его поступление в виде добавок. Потому что его дефицит может иметь более пагубные последствия. При этом, наилучшим путём введения добавок витамина D является чрескожный, то есть наиболее близкий естественному пути его поступления. Фармацевтическая промышленность уже наладила выпуск кремов с холекальциферолом, однако процент его усвоения через кожу не известен.
Более точно определить необходимость приема добавок и их дозировку для каждого конкретного случая можно только после анализа уровня 25(OH)D в сыворотке крови. Согласно эмпирическому правилу, потребление 1'000 МЕ/сут витамина D приводит к увеличению концентрации 25(OH)D примерно на 10 нг/мл, хотя эта зависимость не является линейной *. Таким образом, зимой для достижения минимального уровня (30 нг/мл) среднестатистическому жителю Украины придётся ежедневно принимать дополнительно примерно 1'800 МЕ (45 мкг) витамина D, т.е. втрое выше официально рекомендованой суточной дозы. Для достижения оптимального уровня (40 нг/мл) потребуется добавка 2'800 МЕ (70 мкг) витамина D. А для достижения целевого уровня (60 нг/мл) – не менее 4'800 МЕ (120 мкг), что предположительно позволит вдвое снизить заболеваемость раком молочной железы *. Для понимания, 100 мкг витамина D можно получить, побывав всем телом на ярком летнем солнце не менее 10 минут в день, или же съев 100 г печени трески зимой.
Но эти расчёты относятся к среднему уровню в популяции. Более точно определить необходимость добавок и их дозировку для каждого конкретного случая можно лишь после анализа уровня 25(OH)D в сыворотке крови. Для расчёта требуемой дозы витамина D, можно использовать следующую методику: из целевого уровня (60 нг/мл) нужно вычесть текущий уровень и умножить полученное значение на 100. Например, если текущий уровень составляет 20 нг/мл, то 60-20=40, 40×100=4'000; т.е. требуемая дозировка витамина D составит 4'000 МЕ.
Такой расчёт применим к большинству здоровых людей. Людям преклонного возраста, с избыточной массой тела, а также редко бывающим на солнце, наверняка потребуется увеличение дозы. Исследование VITAL обнаружило, что люди с нормальным весом, получавшие 2'000 МЕ/сут витамина D, в конечном итоге имели на 24 % меньшую заболеваемость раком в течение пяти лет *. Однако люди с избыточным весом или с ожирением не имели никакой пользы от приёма витамина D из-за более высоких потребностей таких людей в витамине D. Людям с лишним весом может потребоваться доза в 2-3 раза выше (3'000-6'000 МЕ/сут), чтобы достичь такой же его концентрации в крови. Кроме того, существуют генетические и приобретённые заболевания, связанные с нарушением регуляции метаболизма витамина D, которые могут изменить потребность в витамине D *.
Приём профилактических доз витамина D (600-800 МЕ/сут), скорее всего, не потребует контрольной проверки уровня 25(OH)D *, однако при приёме высоких, т.е. лечебных доз (2'000-4'000 МЕ/сут и выше) было бы лучше периодически проверять его уровень, чтобы можно было избегать как недостатка, так и избытка 25(OH)D.
Контроль уровня 25(OH)D в сыворотке рекомендуют проводить каждые 3 месяца от начала его приёма; а его дозу корректировать сразу же по достижению оптимального уровня. К сожалению, проблема с анализом уровня витамина D в крови в том, что одна и та же проба, обработанная в различных лабораториях, может давать большой разброс полученных результатов * *. Такое обстоятельство, безусловно, очень снижает информативность анализа.
Хотя витамин D наименее токсичен, чем другие жирорастворимые витамины, его избыток может представлять не меньшую опасность, чем его недостаток. Ранее сообщалось, что сывороточные уровни 25(OH)D более 60 нг/мл (150 нМ/л) начинают ассоциироваться с повышением смертности от всех причин у госпитализированных пациентов *. Обновлённый метаанализ показывает, что наилучшие показатели смертности от всех причин достигаются при концентрации 25(OH)D в сыворотке 90-150 нМ/л *. Такие концентрации не считаются токсичными *. Однако проблемы неизбежно появятся при концентрации > 250 нМ/л, которую можно достичь при длительных постоянных суточных дозах, превышающих 10'000-20'000 МЕ (в зависимости от исходного уровня) *.
К счастью, получить избыток витамина D из обычных пищевых продуктов или от солнца крайне затруднительно. Поэтому это предостережение скорее относится к приёму добавок таких форм витамина D, как эргокальциферол (D2), кальцидиол или кальцитриол. Их усвоение линейно растёт с их потреблением; тогда как с увеличением потребления обычно предписываемого холекальциферола его усваиваемость ухудшается, естественно ограничивая поступление витамина D в организм.
Токсичность высоких доз витамина D может быть вызвана дефицитом витаминов A *, K *, E, а также дефицитом кальция, магния и селена *. Например, магний обеспечивает активацию витамина D, полученного из пищи/добавок или выработанного под воздействием солнечного света. Он также обеспечивает его адекватный метаболизм и транспортировку по всему телу * *. Без достаточного количества магния (что очень распространено) приобретённый витамин D может оказаться «мёртвым», даже если его очень много.
Биоактивная форма витамина D активирует матричный белок GLA *, который препятствует кальцификации сосудов. Однако активированный GLA требует витамина К для обеспечения этого эффекта. Дефицит либо витамина D, либо витамина K препятствует адекватной работе этого белка. Т.о. высокая концентрация витамина D при недостатке витамина К создаёт опасность кальцификации мягких тканей и сосудов. Кроме того, значительное усиление поступления в организм кальция, обеспечиваемое высокими дозами витамином D, требует одновременного увеличения потребления магния, чтобы не допускать дисбаланса между этими минералами.
Последние факты заставляют обратить внимание на то, что изучение влияния любого витамина самого по себе, без учёта его совместного действия с другими витаминами и минералами, может оказаться некорректным *. Добавки любого из них без добавок его метаболических помощников могут привести совсем не к тем эффектам, которые ожидались.
• Витамин K * : до 100 мкг/сут. Существует две формы витамина К. Витамин К1 (филлохинон) содержится в зелени и зелёных овощах (петрушка, браунколь, шпинат, брокколи) и растительных маслах (оливковое). Витамин К2 (менахинон) вырабатывается кишечными бактериями из К1 в процессе ферментации, а также содержится в продуктах животного происхождения (яичные желтки, печень, мозг, молочный жир) и ферментированных продуктах (натто, квашеная капуста, необезжиреный сыр и йогурт) *. Физиологически оба они играют различную роль в организме, но похоже, что только К2 обладает интересующей нас терапевтической эффективностью * *.
Витамин К2 вызывает дифференцировку и апоптоз в широком спектре линий раковых клеток человека. Он вызывает апоптоз за счёт усиления окислительного повреждения митохондрий, вызываемого увеличением внутриклеточной концентрации АФК. Главным образом, это те АФК, которые участвуют в апоптозе – супероксид и перекись водорода. Поскольку для раковых клеток характерен дефицит таких антиоксидантных ферментов, как каталаза *, супероксиддисмутаза * и глутатионпероксидаза *, витамин K осуществляет избирательное поражение раковых, но не нормальных клеток * *. По этой же причине проапоптотическое действие витамина К может отменяться такими антиоксидантами, как каталаза * или α-токоферол *, сохраняя таким образом жизнеспособность раковых клеток.
Человек эволюционировал в условиях достаточно большого потребления витамина K из пищи и, возможно, поэтому он плохо усваивается и накапливается. Богатыми растительными источниками витамина K являются листовая капуста, турнепс, шпинат, кале, брокколи *. Диета современного человека в развитых странах бедна зеленью, что способствует недостаточному поступлению в организм витамина K. И хотя обычно в организме человека нет дефицита витамина K, в некоторых случаях приём его добавок может быть оправдан.
В организме витамин K действует синергично с витамином D. Без достаточного количества витамина К, витамин D в рекомендуемых дозах может не реализовать свой потенциал в полной мере. Витамин D поддерживает минерализацию и здоровую структуру костей, а витамин K является ключевым фактором метаболизма костных белков * * *. В то время, как витамин D обеспечивает достаточность кальция в крови, витамин K обеспечивает накопление кальция в костях и зубах, но не в мягких тканях, таких как кровеносные сосуды. Рекомендуемое весовое соотношение принимаемого витамина D к витамину К2 примерно 2,5:1, т.е 100 мкг витамина К2 на 10'000 МЕ витамина D.
В ряде исследований in vitro сообщалось о сильном противораковом эффекте сочетания витамина C и провитамина K3 (менадиона) при их молярном соотношении 100:1, т.е. при их весовом соотношении 40:1. Вместе они образуют сильную окислительно-восстановительную пару, способную предотвратить дисфункцию митохондрий, восстановить окислительное фосфорилирование, модулировать окислительно-восстановительный гомеостаз, устранить гипоксию и вызвать апоптоз и гибель раковых клеток *. Что весьма ценно, такая комбинация оказалась способной предотвратить повторный рост клеток глиомы после прекращения действия основного терапевтического средства *.
Характерной особенностью апоптоза, вызванного комбинацией витаминов C и K, является его медленный характер; требуется не менее 3 дней, чтобы можно было заметить результат. Возможно, это связано с тем, что требуется время для увеличения до критического уровня концентрации витамина C в опухолях, которые склонны к его накоплению * * *.
В опытах на мышах, введение комбинации витаминов C и K отчётливо усиливало действие всех 6 исследованных препаратов химиотерапии при опухолях печени *, лейкемии и карциноме *. Кроме того, предварительная обработка мышей комбинацией витаминов C и K вызывала статистически значимое усиление эффективности лучевой терапии *. Общая и местная токсичность, сопровождающая химиотерапию рака, при этом не увеличивались *.
Хотя предложения использовать такую терапию дополнительно к лучевой или химиотерапии впервые прозвучали около 20 лет назад, публикаций о клинических исследованиях на эту тему до сих пор не обнаружено. В доклинических исследованиях синергия обоих витаминов позволяла снизить их концентрацию в 2,5-5 раз для достижения такого же антипролиферативного эффекта, как при использовании каждого из них в отдельности *. Здесь концентрации витаминов в растворе приблизительно соответствовали тем, которые можно достичь путём приёма внутрь 1 г витамина С и 40 мг витамина К3; однако поскольку оба они быстро метаболируются, это потребует частого их приёма in vivo.
Несмотря на то, что такая доза витамина К в сотни раз превышает рекомендуемую, он не токсичен даже в таких количествах. Дозировки в 45 мг/сут использовалась в ряде успешных клинических исследований, которые оценивали влияние витамина К на прочность костей *. Стоит лишь оговориться, что синтетический провитамин К3 может вызывать повреждение клеток печени *, и его, видимо, стоит заменить на витамин К2. В пилотном проекте аналог витамина К2 (45 мг/сут) заметно снижал рецидив заболевания * и улучшал показатели выживаемости у пациентов с гепатоцеллюлярной карциномой *.
Исходя из этого, можно прийти к выводу, что если для профилактики заболевания может быть достаточно пищевого потребления витамина К, то для терапии придётся использовать готовые добавки К2. Поскольку витамин К участвует в процессе свёртывания крови, то приём его добавок пациентами, использующими антикоагулянты, нуждается в одобрении лечащего врача.
Эффективность добавок витаминов зависит от множества факторов.
Дефицит того или иного витамина может быть вызван многими иными причинами, кроме как недостаточное его поступление извне. Например, недостаток витамина B3 может вызываться недостатком триптофана, железа, витаминов B2 и B6. Снижение уровня витамина (фактически, гормона) D может произойти из-за недостаточного солнечного облучения тела; из-за приёма средств, снижающих уровень холестерина (статины); а также из-за хронически высокого уровня инсулина и неадекватного гидроксилирования витамина D, поступившего с пищей.
Наконец, дефицит ферментов, обеспечивающих внутренний синтез витаминов, может быть результатом индивидуальных генетических особенностей. Впрочем, последняя причина витаминной недостаточности статистически гораздо менее вероятна, чем причина их нехватки в пище.
Кроме того, важную роль играют особенности усвоения принимаемых добавок. Рассмотрим в качестве примера витамин C. Его концентрация в плазме и тканях человека строго контролируется, в том числе через активность усвоения. При пероральной дозировке 100 мг/сут, усвоение и насыщаемость витамина C высокие, а при увеличении дозировки выше 200 мг/сут они увеличиваются очень слабо * *. Кроме того, если исходная концентрация витамина C близка к насыщению, то его пероральные добавки вряд ли произведут заметное изменение показателей здоровья *. Организм просто откажется их принимать путём всасывания через кишечную стенку. Однако внутривенное введение витамина C позволяет добиться многократно большего насыщения ним крови, чем пероральное применение.
Свободные радикалы, против которых работает витамин C, играют двойственную роль, которая зависит от их концентрации в тканях организма. При низких уровнях они, похоже, не оказывают никакого заметного влияния; при умеренных уровнях они могут способствовать инициации и развитию опухолевого процесса; а при очень высоких уровнях они становятся избирательно цитотоксичными для опухолевых клеток *. Соответственно, при каждом из этих условий одни и те же антиоксидантные добавки, в том числе витамин C, даже при одной и той же дозировке, будут проявлять совершенно разные эффекты, а при различных дозировках – тем более.
С этой позиции, все исследовательские попытки определить оптимальную дозировку добавок антиоксидантов, витаминов или минералов без учёта индивидуальных особенностей человека грешат серьёзной методологической ошибкой – измерением их потребления вместо измерения их концентрации в ткани. Поэтому принципиальные выводы этих исследований могут быть противоречивы и некорректны, а вытекающие из них рекомендации по применению и дозировке антиоксидантов и весьма приблизительны.
Приведенные выше рекомендации приёма добавок витамина D, витамина B9, йода и селена не является исключением. Они основаны исключительно на широкой распространённости в Украине дефицита этих веществ, а их рекомендуемая дозировка носит лишь общий и ориентировочный характер. Основанием для приёма добавок может быть недостаток в организме того или иного витамина, определённый лабораторным анализом.
Расходы, связанные с приёмом витаминов, можно значительно сократить, если покупать сертифицированное сырьё на развес *, и фасовать его самостоятельно, используя ювелирные весы, ручной капсулятор и желатиновые капсулы. Такое решение заодно позволяет составлять рецепт комплекса витаминов и других добавок индивидуально для каждого пользователя.
Химические элементы. Отклонение от нормы основных элементов, таких как O, C, H, N, Ca, P, вызывает электролитные аномалии, а отклонение от нормы 10 микроэлементов, таких как Fe, F, Si, Zn, Sr, Rb, Br, Pb, Mn, Cu (составляющих порядка одну миллионную) и 14 ультра-микроэлементов, таких как Al, Cd, Sn, Ba, Hg, Se, I, Mo, Ni, B, Cr, As, Co, V (составляющих порядка одну миллиардную), приводит к функциональным расстройствам ферментов и физиологически активных веществ в организме * *.
Минералы составляют лишь 4 % общего состава тела, из которых 2 % приходится на кальций, около 1 % – на фосфор, а оставшийся 1 % – на все остальные минералы вместе взятые. Физиологическая потребность каждого из минералов для женщин в возрасте 18-60 лет * приведены в таблице ниже. Однако они отражают, похоже, скорее уровни, которые необходимы для отсутствия явных симптомов болезней, чем уровни, которые необходимы для полного здоровья.
Кажется маловероятным, чтобы люди на порядок отличались от других высших приматов потребностями в микронутриентах. Самая грубая оценка, в пересчёте на человеческий масштаб, показывает, что приматы в дикой природе потребляют с пищей: кальция в 20 раз больше, фосфора – в 5 раз больше, калия – в 10 раз больше, натрия – в 2 раза меньше, хлора – в 4 раза больше, магния – в 15 раз больше, негемового железа – 10 раз больше, и марганца – в 40 раз больше, чем рекомендованые для человека нормы * *.
В сравнении с современным человеком, человек позднего палеолита потреблял с пищей: железа – в 5,8 раза больше; кальция – в 1,7 раза больше; цинка – в 2,7 раза больше; калия – в 3 раза больше; натрия – в 7 раз меньше *. Даже если допустить значительную избыточность потребления минералов, и их плохую усваиваемость из-за большого количества клетчатки, такие цифры подталкивают к выводу, что рекомендуемые системой здравохранения нормы могут быть занижены от реальной потребности человеческого организма. И что они могут для большинства населения исключить риск заболеваний, вызванных явным дефицитом незаменимых веществ, но не обеспечить тех значений, при которых организм чувствует себя комфортно.
Несмотря на это, предполагается, что при адекватном рационе мы должны получать достаточное количество химических элементов из пищи. При этом, существуют региональные особенности, связанные с дефицитом или избытком в почве тех или иных элементов, что отражается на их содержании в растительной пище. А следовательно, и на их поступлении в организм.
Большое количество критически важных элементов содержится в овощах и оболочке зерновых (зародышах и отрубях). Однако рафинирование злаков в процессе их обработки значительно снижает содержание в них микронутриентов. После обдирки зёрна теряют зародыши и оболочку, поэтому содержат в среднем на 78 % меньше клетчатки, на 74 % меньше витамина Е и витаминов группы В, и на 69 % меньше таких важных элементов, как цинк, селен, кальций и калий.
Кроме того, за последние полвека интенсификация сельского хозяйства привела к минеральному истощению почв. И как следствие – к обеднению урожая питательными веществами. По этой причине даже полностью растительное питание оставляет опасность недостаточного обеспечения организма микроэлементами *. Особенно эта проблема касается людей пожилого возраста. Недостаточная доля растительной пищи в рационе или ограничительные диеты могут усугубить положение настолько, что это потребует приёма добавок.
Наибольший риск оказаться дефицитным у таких элементов, как йод, цинк, магний, калий и селен. Марганец, медь и цинк входят в состав группы антиоксидантных ферментов под названием супероксиддисмутаза. Хром, кобальт и медь, наряду с йодом, селеном, железом и цинком, участвуют в здоровом функционировании щитовидной железы, играющей ведущую роль в гормональном балансе организма. Но говоря об опасности недостатка этих элементов, не будем забывать и об опасности их чрезмерного избытка.
• Калий (K): 1-2 г/сут
*,
и натрий (Na) – два самых распространённых в организме щелочных элемента.
Ион калия является основным внутриклеточным катионом тканей различных органов, и участвует в наиболее важных функциях клетки. А ион натрия является основным внеклеточным катионом. Таким образом, оба эти элемента являются своего рода биохимическими антагонистами.
Рекомендуемая суточная доза потребления калия составляет ~ 5'000 мг, а натрия – ~ 1'500 мг, тогда как фактическое среднее потребление калия с пищей в Украине составляет ~ 4'000 мг/сут *. Однако оптимальное потребление калия с пищей в действительности может быть значительно бо́льшим, чем рекомендуемое ныне. В 159 ретроспективных исследованиях диеты людей каменного века потребление калия составляло в среднем 400 мЭкв/сут, что превышает текущие и рекомендуемые дозы более чем в 4 раза * *.
Согласно современным представлениям, оптимальное соотношение натрия к калию, поступающих с пищей и водой, должно составлять не менее, чем 1:3,5. Однако при многих условиях (например, усиленное потоотделение, диурез, недостаток овощей в пище, избыток пищевой соли, приём некоторых лекарств) этот баланс может быть легко нарушен в пользу натрия, потому что организм гораздо легче расстаётся с калием, чем с натрием.
Охотники-собиратели времён палеолита каждый день потребляли примерно 11 граммов калия из фруктов, овощей, листьев, цветов, корней и других растительных источников, и примерно 700 мг натрия. Таким образом, соотношение натрий:калий в их рационе составлял 1:16. В рационе современного человека больше натрия (3'400 мг/сут), чем калия (2'500 мг/сут), а их соотношение составляет примерно 1,36:1 *. Т.е. по сравнению с палеолитическим периодом, оно инвертировано и изменено в 20 раз!
Оценить достаточность калия в организме так же непросто, как и магния, потому что они, в основном, находятся внутри клеток. И поскольку уровень запаса калия в тканях слабо коррелирует с его насыщенностью в крови, анализ крови не в состоянии объективно оценить его запасы. Если концентрация калия начинает снижаться уже в крови, то это, скорее всего, означает, что в тканях его недостаёт ещё больше, и он начинает изыматься из крови. Поэтому предварительно оценивать насыщенность клеток калием будет лучше по кислотности слюны. Однако для получения точной картины потребуются более сложные лабораторные анализы.
К сожалению, современная диета очень обеднена овощами, которые могли бы обеспечить достаточный уровень калия. В то же время данные экспериментальных и наблюдательных исследований свидетельствуют многочисленных положительных эффектах дополнительного потребления калия. В частности, калий снижает риск развития мозгового инсульта * *, нормализует артериальное давление * * и сердечный ритм *.
При достаточном уровне потребления овощей заметного дефицита калия не наблюдается. В то же время обычно наблюдается некоторый избыток натрия, поступающего с поваренной солью, что создаёт дисбаланс между калием и натрием, и даёт основания для рекомендации ограничить потребление соли 3-4 граммами в сутки (2 щепотки) и даже менее. Основным пищевым источником калия являются овощи (картофель, бобовые, бананы, авокадо, томаты *), а натрия – поваренная соль.
Таким образом, в добавках натрия обычно нет необходимости, в отличие от добавок калия. Достаточный уровень снабжения калием легко обеспечивается за счёт богатых калием овощей. Если же потребовался приём добавок, то при выборе между различными источниками калия лучше выбирать такие, которые обеспечивают медленное его высвобождение. Ликвидация недостатка калия будет более эффективна с одновременными добавками магния *, а также аспарагиновой кислоты, которая обладает выраженной способностью повышать проницаемость клеточных мембран для ионов магния и калия.
Для среднего жителя Украины разница между суточным потреблением калия и рекомендованной дозой составляет около 1 грамма. Т.о., ежедневной добавки 1 чайной ложки бикарбоната калия будет вполне достаточно, чтобы ликвидировать этот разрыв. В 1 чайной ложке содержится около 5 граммов порошка, из которых 2 грамма приходится на калий и 3 грамма – на бикарбонат. Однако при выраженном дефиците дозировка калия может возрасти до 5 г/сут (~ 1 столовая ложка на 2 стакана воды). Другие источники калия – цитрат, глюконат, карбонат и фосфат калия. Однако наилучшим источником калия остаются овощи.
• Кальций (Ca): до 600 мг/сут
*.
Кальций – щелочноземельный элемент. Ион кальция Ca2+ – второй по распространённости внеклеточный катион.
Кальций является самым распространённым минералом, присутствующим в человеческом теле, что указывает на его многостороннюю, жизненно важную роль. Практически весь кальций организма сосредоточен в костной ткани, однако он требуется также и другим тканям. Кальций принимает участие в гормональной, ферментной, нервной, мышечной и пищеварительной системах. Кроме того, кровеносная и иммунная системы также требуют достаточного количества кальция для своего успешного функционирования.
Когда уровень кальция в организме удовлетворительный, поступающий из пищи кальций при помощи кальцитонина откладывается на долгосрочное хранение в костную ткань. Однако когда уровень кальция в крови падает, например, вследствие хронического кислотного стресса, кальций извлекается из костей в кровь, стремясь возместить недостаток кальция в крови. Если при этом имеются проблемные (например, воспалённые) места, они захватывают и удерживают кальций, что приводит к местной кальцификации. Результатом могут быть артрит, атеросклероз, кальцификатные образования (в том числе в молочной железе), гипертония, почечно-каменная болезнь и многие другие заболевания.
Недостаточное потребление кальция наблюдается в некоторых странах, особенно в Юго-Восточной Азии (Таиланд, Китай, Индонезия, Вьетнам, Малайзия, Филиппины) *. Некоторые исследования показывают определённую связь кальция с риском рака молочной железы *. Так, пищевое потребление 1'250 мг/сут кальция незначительно снижает у женщин общий риск рака * и, в частности, риск рака молочной железы *. Ежедневное общее потребление 600 мг кальция + 400 МЕ витамина D (обеспечивающего 30-50 нг/мл сывороточного витамина D) может снизить риска рака молочной железы у женщин в пременопаузе *, но не в постменопаузе * *. Однако многие другие исследования не находят пользы в добавках кальция * * *. К сожалению, в этих исследованиях не учитывались как исходные уровни кальция, так и сывороточные уровни магния, поэтому невозможно сделать определённый вывод о пользе добавок кальция.
При рекомендуемой норме 600 мг/сут, среднее потребление кальция с пищей в Украине – около 900 мг/сут *. Это делает неразумным приём добавок кальция для подавляющего большинства населения, какими бы благими намерениями это не оправдывалось. При этом проблемой является обеспечение баланса между кальцием и магнием, поскольку кальций является в некотором роде биохимическим антагонистом магния. Добиться требуемого соотношения Ca:Mg только лишь за счёт варьирования современной диетой проблематично. Лишь немногие растительные источники могут обеспечить адекватный баланс Ca:Mg.
Таким образом, небольшие добавки кальция могут быть оправданы, если организм действительно нуждается в кальции, однако при этом не следует забывать об обеспечении баланса Ca:Mg. Необходимость приёма и дозировку можно приблизительно оценить при помощи соответствующих программ, таких как «Мой здоровый рацион» *.
Тем не менее, даже адекватного потребления кальция с пищей может оказаться недостаточно, если в организме ощущается недостаток витамина D, который усиливает всасывание кальция в кишечнике; а также при недостатке белка, магния, тестостерона, витамина E; или же при избытке фосфора и других кислотных веществ *. Точно также необходимо достаточное обеспечение цинком, селеном, серой, фтором, витаминами A, С, Е, F и группы B. Это ещё раз указывает на важность комплексного подхода к устранению минерало- и витаминодефицита в организме человека.
Максимальное поглощение добавок кальция достигается в разовой дозировке 500 мг *. Не стоит забывать про достаточность магния, потому что без него кальций плохо усваивается организмом. Оценивая суточное потребление кальция, следует учитывать его поступление из пищи. Самыми богатыми пищевыми источниками кальция являются мак, кунжут, чиа, морская капуста, рыба с костями, тёмно-зелёные листовые овощи, кисломолочные продукты *.
Карбонат кальция имеет самую высокую концентрацию кальция среди других солей кальция, но для оптимального поглощения его рекомендуется принимать во время еды *. Усвоение кальция улучшается при его совместном приёме с витамином D, магнием, кремнием и витамином К2. Высокое потребление растительной пищи, содержащей клетчатку, фитиновую и щавелевую кислоты, может значительно ухудшить биодоступность добавок кальция. Кроме того, у пожилых людей обычно ухудшается абсорбция кальция из кишечника. Любая из этих причин может вызвать необходимость увеличения принимаемой дозы.
Женщины в большей степени нуждаются в кальции, чем мужчины, однако даже в случае дефицита кальция нет особого смысла увеличивать дозировку его добавок выше 500 мг/сут, а его общее потребление – выше 1'000 мг/сут *. Избыток кальция снижает уровень магния и активного витамина D в крови * *. Избыток кальция может быть легко создан даже умеренным уровнем потребления молочных продуктов.
Кроме того, несбалансированная перегрузка кальцием негативно сказывается на митохондриальной функции. Чрезмерное поступление кальция приводит к тому, что он начинает откладываться в нежелательных местах. Систематический избыток кальция или нарушение его метаболизма могут быть причиной камней в почках, кальцификации многих органов и сосудистой системы, приводя к ухудшению зрения и повышению риска инсульта и инфаркта.
• Магний (Mg): 300-500 мг/сут.
Магний – ещё один щелочноземельный элемент, естественный физиологический антагонист кальция
*.
Ион магния – четвёртый по распространённости катион в организме и второй по распространённости внутриклеточный катион
*.
Роль магния трудно переоценить. Большинство биохимических реакций в клетках организма требует подвода энергии к реагирующим молекулам – ферментам и коферментам. Эта энергия образуется при отщеплении крайней фосфатной группы от молекулы АТФ. Находясь в комплексах с АТФ, ион магния обеспечивает высвобождение энергии через активность Mg2+-зависимых АТФаз, которые отщепляют от АТФ фосфатную группу (высвобождают энергию), а также создаёт уникальные условия для химической реакции её обратного присоединения (заряжают молекулы энергией) *.
Магний обеспечивает управляемость обоих этих процессов. Он дополнительно связывает две последние фосфатные группы и обеспечивает отщепление последней фосфатной группы АТФ исключительно под действием фермента, а не произвольным образом. Таким образом, недостаток магния может нарушить нормальный ход производства и расходования клеточной энергии. Распадающаяся в случайном порядке АТФ может активировать неконтролируемые биохимические реакции, а с другой стороны, может возникать дефицит энергии для жизненно важных биохимических реакций.
Магний необходим для удвоения и репарации ДНК, и его дефицит способствует канцерогенным мутациям ДНК. Магний также помогает держать уровень активного витамина D в оптимальном диапазоне. При недостатке магния любые попытки восполнить потери калия окажутся неэффективными *. В целом же магний участвует более, чем в трёхстах жизненно важных ферментативных процессах, связанных с энергетическим метаболизмом, синтезом белков и нуклеиновых кислот *. Без магния жизнь была бы принципиально невозможна *.
При этом дефицит магния, наряду с дефицитом йода и цинка, наблюдается более, чем у половины населения Украины. В США получают с пищей недостаточное количество магния ~ 64 % мужчин и 67 % женщин. А в возрасте старше 71 года недостаточное поступление магния наблюдается, соответственно, ~ у 81 % и 82 % *. Недостаточное потребление овощей и цельнозерновых продуктов, смягчение и фильтрация питьевой воды, интенсивная потеря воды организмом, стресс и употребление алкоголя резко снижают запасы магния в организме человека. Недостаток магния усугубляется высоким потреблением кальция, в основном из молочных продуктов.
Концентрация магния в сыворотке линейно и обратно пропорциональна риску развития сердечно-сосудистых событий *. Кроме того, более высокий уровень потребления магния (550 мг/сут) по сравнению с более низким его потреблением (350 мг/сут) ассоциируется с заметным замедлением старения мозга у пожилых людей *. О недостаточном потребления магния современным человеком может свидетельствовать тот факт, что каждые 100 мг/сут дополнительного магния в пище ассоциируются с 5 %-ным снижением смертности от рака и с 6 %-ным снижением смертности от всех причин *.
Более высокое потребление магния с пищей женщинами с раком груди было ассоциировано с более низким риском смертности от всех причин, особенно у женщин в постменопаузе. Пациенты с наивысшим уровнем потребления магния имели вдвое меньший показатель смертности по сравнению с пациентами с наинизшим уровнем его потребления *. Наиболее сильно этот эффект проявлялся у женщин в постменопаузе и у женщин с высоким соотношением Ca:Mg.
У египетских женщин с раком груди дефицит магния наблюдался в 49 % случаев против 4 % случаев в контрольной здоровой группе *. Степень снижения магния в сыворотке положительно коррелирует с прогрессированием стадии злокачественного новообразования *. Высокие уровни магния в сыворотке (1,78 мМ) против низких его уровней (0,24 мМ) ассоциируются с 40 %-ным снижением относительного риска смерти от всех причин и сердечно-сосудистых смертей, а также с 50 %-ным снижением смертей от рака *.
Референсные значения уровня магния в сыворотке крови находятся на уровне 0,7-1,0 мМ, но целевым, видимо, следует считать показатель не ниже 1,1 мМ, т.е. 2,7 мг/дл. Дело в том, что анализ уровня магния в крови недостаточно информативен. В крови может наблюдаться удовлетворительный уровень магния при его истощении в основных местах накопления – митохондриях, мышцах и костях. Т.о. нижний порог «нормального» показателя содержания магния в сыворотке крови может свидетельствовать не о его недостатке, а о его крайнем дефиците в тканях и митохондриях, где он участвует в процессе производства клеточной энергии *. Для достоверного определения достаточности магния в организме придётся проводить более сложные исследования (например, магний в слюне, в суточной моче, в волосах, а также в цельной крови, плазме и сыворотке крови и отдельно в эритроцитах). Если мы хотим определить адекватность потребления магния, лучше всего оценивать уровень его выведения с мочой (не менее 100 мг/сут).
В то время как рекомендуемая норма потребления магния для взрослых женщин составляет около 420 мг/сут, среднее пищевое потребление магния в Украине находится ниже этой рекомендации, и составляет около 380 мг/сут *. Стоит также учитывать, что из всего потребляемого с пищей магния усваивается лишь третья часть. Недостаточное потребление овощей и цельнозерновой пищи, смягчение и фильтрация питьевой воды, интенсивная потеря организмом воды, стресс и потребление алкоголя серьёзно снижают запасы магния в человеческом теле.
Добавки магния лучше принимать на ночь и утром, чтобы предупредить его обычный утренний дефицит. Дозировка добавки магния зависит от уровня его антагониста – кальция, поскольку важен не только уровень магния, но и соотношение в сыворотке кальций:магний, которое должно составлять примерно 2,3:1 для женщин. Это соотношение так же важно, как и соотношение калия к натрию. Изменения в соотношении Ca:Mg могут привести к увеличению числа заболеваний и рецидивов рака молочной железы *. В постменопаузе наблюдается небольшое увеличение соотношения Ca:Mg в сыворотке у женщин с раком (4,9:1) по сравнению с женщинами без рака (4,4:1) *.
Существует несколько форм добавок магния. Перекись магния при восстановлении образует не только магний, но и кислород, что выглядит весьма привлекательным. Однако сами по себе ионы магния плохо усваиваются в кишечнике. Лишь треть поглощённого через рот магния попадает в организм. Таурат магния, хлорид магния и лактат магния более биодоступны, чем оксид магния *. Глицинат магния (500 мг/сут) или треонат магния (2 г/сут) тоже хороший выбор магния, поскольку последний может легко проникать в головной мозг через барьер кровь:мозг.
Однако лучше всего покрывать потребность в магнии из пищевых источников, тем более, что это несложно сделать. Богатыми источниками магния в пище являются тёмно-зелёные листовые овощи, цельнозерновые продукты, кукуруза, орехи, семена, бобовые, морепродукты, минерализованая вода и какао *. Несложно сделать вывод, что овощная диета является лучшим диетическим выбором.
• Йод (I): до 3-5 мг, но ни в коем случае не более 15 мг/сут йода.
Йод является важным минералом для нормальной функции щитовидной железы и производства гормонов щитовидной железы
*.
Эти гормоны контролируют скорость поглощения углеводов из пищи в кишечнике, а также регулируют скорость преобразования глюкозы и жира в энергию. Помимо щитовидной железы, йод поглощается клетками во многих органах и тканях, включая грудь и простату, поддерживая их нормальную функцию и целостность
*
*.
Йод регулирует ряд генов, которые вовлечены в метаболизм эстрогенов, деление, пролиферацию и дифференцировку клеток * * *, он также способствует детоксикации тяжёлых металлов; усиливает иммунную функцию, предотвращает рецидивы заболевания. Кроме того, йод способствует апоптозу дефектных клеток, сдерживая злокачественные преобразования * * *. В одном из исследований, оценка йода в моче у пациентов с различными видами злокачественных новообразований показала тяжёлый дефицит (< 20 мкг/л) у 88 % из них, умеренный дефицит (20-49 мкг/л) у 7 %, и лёгкий дефицит (50-99 мкг/л) у 2 % *.
Йод является обязательным элементом для роста, развития и нормализации тканей женской груди; при его недостатке наблюдается атипия, дисплазия, а также доброкачественные и злокачественные опухоли молочной железы * *. Дефицит йода увеличивает чувствительность ткани груди к эстрогену *. Было также замечено, что в тканях раковой опухоли молочной железы концентрация йода в несколько раз меньше, чем в нормальных тканях или в тканях доброкачественных опухолей молочной железы *, и не удивительно, что атипия и злокачественные опухоли в молочной железе увеличивают местное поглощение йода *.
Нехватка йода в развитых странах за последние 40 лет усилилась более чем в 4 раза, и сегодня здесь 74 % населения получает недостаточное количество йода *. Причём у женщин США, по сравнению с мужчинами, средний уровень йода ниже, а его дефицит встречается вдвое чаще *. Хотя Институт медицины США (Institute of Medicine) установил допустимый верхний уровень потребления йода в 1'100 мкг/сут *, это значение, возможно, должно соответствовать норме, а не пределу.
Япония – одна из немногих стран мира, где пищевое поступление йода более, чем достаточно *. Потребление японцами сушёных водорослей, в основном, Порфира (Porphyra) и Ундария (Undaria) составляет ~ 5 г/сут, что способно обеспечить организм до 12,5 мг/сут йода, не считая его поступления из овощей, выросших на богатом йодом местном грунте.
По разным оценкам, среднесуточное потребление йода в Японии варьируется от 5,2 мг до 13,8 мг * *, в то время как в США оно составляет 216 мкг *. Тем не менее, потребление йода не равнозначно его усвоению; и похоже, связь между ними не линейна. Анализ уровня йода в моче японцев показывает, что его фактическое усвоение в среднем не превышает 3-5 мг/сут * *. Возможно, как и в случае с витамином C, усвоение йода падает при его достаточной концентрации в организме.
Для территории Украины, удалённой от мирового океана, дефицит йода является географически естественным. Недостаток йода в пище приводит к тому, что в некоторых биохимических процессах он замещается другими галогенами (хлор, бром и фтор), которые, однако не выполняют биохимических функций йода. Хлорирование питьевой воды лишь усугубляет этот дисбаланс, увеличивая относительный риск рака молочной железы на 18 % *.
Интенсивные физические нагрузки, высокое пото- и мочевыделение *, вегетарианская (а особенно веганская) диета * и некоторые другие факторы также могут способствовать снижению уровня йода. Так, одно из исследований обнаружило, что «палеолитическая» диета способна значительно снизить уровень поступления йода *. Высокое содержание жира в пище также ассоциируется с дефицитом йода *.
Недостаток йода в пище ухудшает работу некоторых органов; прежде всего – молочной и щитовидной железы, которые содержат основные запасы йода в организме *. Заболевания обоих этих органов часто идут синхронно, и весьма показательно, что рак одного из них ассоциируется с риском рака другого *, что может указывать на общие исходные причины, включая нехватку йода.
Дефицит йода вызывает увеличение уровня эстрогена в целом *, и низкое соотношение эстриола к эстрону и эстрадиолу *. Как известно, и первый, и второй фактор увеличивают риск рака молочной железы, матки и яичников. Кроме того, опыты на крысах демонстрируют, что дефицит йода повышает чувствительность к эстрадиолу и стимулирует деление клеток в молочной железе *. Такой эффект йододефицита способствует развитию атипичной гиперплазии *, и фиброзно-кистозных заболеваний молочной железы, которые затрагивают половину женщин детородного возраста * и до 89 % женщин преклонного возраста *.
В то же время, молекулярный йод (I2) in vitro действует антиоксидантно * и антипролиферативно *, непосредственно способствуя апоптозу различных типов раковых клеток молочной железы * * * и в целом сохраняя здоровье женской груди *. А в исследованиях на животных йод оказывает подавляющий эффект на развитие и размеры злокачественных опухолей * * *.
Приём гамма-линоленовой кислоты (1 г/сут из масла бурачника), йода (750 мкг/сут в форме йодида калия) и селена (70 мкг/сут в форме селената натрия), снижает болезненность и узловатость у женщин с фиброзно-кистозным заболеванием груди *.
Клинические исследования показывают, что более высокие дозировки йода могут быть более успешны. Фиброзно-кистозное заболевание молочной железы у женщин может быть обращено вспять * при долгосрочном ежедневном потреблении не менее 5 мг йода в течении года *, а при краткосрочном ежедневном потреблении 50 мг – в течении 3 месяцев *.
Опухоли, обработанные молекулярным йодом, обладают меньшим инвазивным потенциалом и значительным увеличением апоптоза, экспрессии рецептора эстрогена и инфильтрации иммунных клеток. Благодаря этому, безрецидивная выживаемость больных, принимающих добавки йода (5 мг/сут) за 7-35 дней до операции, и далее во всё время химиотерапии в течение 170 дней, увеличивается вдвое по сравнению с плацебо *.
Известными натуральными источниками йода являются фейхоа, морская капуста, китайский лимонник, калина, океаническая рыба. Сочетание в рационе морских водорослей с соей улучшает метаболизм эстрогена * и значительно снижает возможность сои увеличивать концентрацию IGF-1 в сыворотке *. Ламинария (Laminaria), она же Келп, имеет наибольшую концентрацию йода среди всех доступных морских водорослей.
Добавки в пищу морских водорослей (ламинария, порфира), равно как добавки молекулярного йода (0,08 мг/кг ≈ 5 мг/сут), в клинических исследованиях оказывают положительный эффект на доброкачественные опухоли *, и значительно (у 65 % пациентов) снижают распространённость кист молочной железы, фиброзных бляшек *, а также снимают боли в груди *. Пациентки с подозрением на гиперплазию молочной железы, принимавшие 10-20 мг/сут йодида калия в течение 6-36 месяцев, испытали значительное снижение болевых симптомов, отёка и узловатости в 72 % случаев *.
Уровень выведения йода хорошо коррелирует с уровнем его потребления. Ввиду того, что 90 % йода выводится из организма с мочой *, измерение концентрация йода в моче может быть надёжным методом оценки суточного потребления йода *. Согласно этому методу, дефицит йода определяется как уровень ниже 50 мкг/л *, а уровни 100-199 мкг/л указывают на его адекватное потребление *.
Однако, как видно из приведенного выше графика, при таких низких значениях не наблюдается выраженной связи между уровнем йода в организме и заболеваемостью. Похоже, что заметное снижение заболеваемости наступает при повышении потребления йода до 300 мкг/сут. На этом основании можно предположить, что рекомендуемая суточная доза йода (150 мкг) помогает предотвратить лишь явные последствия йододефицита, такие как зоб, однако для обеспечения здоровья женской груди её явно недостаточно.
Степень недостатка йода у населения Украины варьирует в зависимости от региона, но среднемедианное значение концентрации йода в моче в 2019 году составляло 47 мкг/л *, что соответствует лёгкому дефициту йода. Таким образом, для достижения безопасного уровня (300 мкг/сут) достаточно увеличить ежесуточное потребление морской капусты (ламинарии) – до 15 г сырого веса, или 2 г сухого веса. Поскольку допустимым верхним уровнем пищевого потребления йода в настоящее время считается 1,1 мг/сут *, на самом деле потребление ламинарии можно увеличить втрое.
Женщинам с фиброзно-кистозным заболеванием груди на время лечения может потребоваться до 15 мг/сут; такая дозировка близка к регулярной японской диете, и в течение короткого периода времени будет достаточно безопасной для большинства европейцев, пища которых бедна йодом *. Женщины с опухолями молочной железы могут, по-видимому, также ориентироваться на эту дозировку, которую можно достичь ежедневным приёмом 2 капель 5 %-ного раствора Люголя.
Более высокие дозы вряд ли принесут пользу, и вместо этого могут стимулировать активность рецептора ERα *, а также увеличивать риск рака щитовидной железы. Йодид калия в дозировке до 3,6 г/сут назначали пациентам с хроническим лёгочным заболеванием на протяжении нескольких лет *, что считалось допустимым. Однако у многих пациентов при такой дозировке развивались тяжёлые побочные эффекты.
Даже поступающий с пищей йод при его хроническом избытке (> 15 мг/сут), что наблюдается у некоторых жителей острова Хоккайдо *, может вызвать поражение щитовидной железы *. То, что население Японии может без негативных последствий потреблять большие количества йода, не означает, что такую же терпимость к резкому повышению потребления йода будет проявлять население других стран, выросшее в условиях его дефицита. Исходя из этого, безопаснее будет наращивать суточную дозу добавок йода постепенно, а по завершению курса лечения так же плавно её снизить, и далее не превышать максимальный порог.
В любом случае, при приёме добавок потребуется контроль уровня йода в организме, чтобы избежать как гипер-, так и гипотиреоза. Кроме того, людям с уже имеющимися заболеваниями щитовидной железы, прежде чем увеличивать потребление йода, следует проконсультироваться со своим эндокринологом, а во время его приёма более тщательно следить за состоянием щитовидки. Кроме того, для успешного вывода избытка йода из организма требуется адекватная работа почек.
Одни органы и ткани (такие, как грудь *, яичники и простата) предпочитают накапливать молекулярный йод (I2), а другие (такие, как щитовидная железа) – йодиды (I–) *. Раствор Люголя содержит обе эти формы: в 5 %-ном растворе находится 50 мг молекулярного йода и 100 мг йодида калия на 1 мл (на 20 капель). Поэтому он может быть полезен для здоровья многих органов, а не только молочной железы. Молекулярный йод в эквивалентных дозах может быть использован для оздоровления состояния молочной железы и без йодида калия *.
Для того, чтобы йод выполнял свою функцию, должны надлежащим образом работать некоторые ферменты (такие, как йодпероксидаза, преобразующая йод в активную форму), аминокислоты (такие как тирозин), и другие витамины (такие как B4, B6 и C), и минералы (такие, как марганец). Точно так же, как это происходит с калием, эффективных механизмов удержания йода в организме не существует, и поэтому йод легко теряется, выводясь вместе с мочой. Это обстоятельство требует постоянного притока новых порций йода с пищей.
Несмотря на всю важность йода, для определения точной нормы добавок следует определить его текущую концентрацию в организме, а также проверять её не менее 2 раз в год, поскольку избыток йода может быть не менее опасен, чем его недостаток *. Впрочем, такое опасение касается скорее аптечных препаратов, потому что получить избыток йода с пищей очень непросто. Единственный надёжный способ определить достаточность йода в организме – измерить его уровень в моче.
Составить самое грубое представление о достаточности йода в организме можно популярным примитивным тестом: при помощи ватной палочки нанести на чувствительную часть кожи полоску спиртового раствора йода. Если следы йода исчезают раньше, чем за 12 часов, это может быть первым признаком йодной недостаточности, требующим более точного подтверждения путём лабораторных анализов.
Хотя другие галогены, такие как фтор, в определённых количествах, тоже требуются организму, их избыток может снижать биологическую активность йода.
• Селен (Se): до 200-400 мкг/сут.
Все три формы селена полезны и необходимы, поскольку они задействованы в различных биологических механизмах
*.
Таким образом, уровень потребления селена может значительно влиять как на доступность йода, так и на гормональный профиль человека.
Селен активирует усвоение йода; в физиологии щитовидной железы оба эти элемента действуют совместно *, и поэтому принимать их рекомендуют одновременно. В противном случае при йодо- и селенодефиците добавки одного лишь йода могут вызвать необратимый фиброз щитовидной железы * *, в то время как добавки одного лишь селена вызывают усугубление йододефицита и гипотиреоза * *.
Селен снижает риск рака и подавляет канцерогенез у животных на ранних стадиях болезни *. Тяжёлые металлы, в частности, ртуть, снижают биодоступность селена, что может вызвать его недостаточность. С другой стороны, результаты некоторых исследований свидетельствуют о том, что селен может проявлять защитный эффект против ртути *.
Недостаток селена повышает риск рака. Более низкое содержание селена в крови и тканях ассоциируется с повышением в два-три раза общего риска развития рака в течение ближайших 5 лет * *. Концентрация селена в сыворотке женщин с раком груди значительно ниже, чем у здоровых женщин *, а соотношение медь:селен значительно выше *.
Более высокое потребление селена с пищей до постановки диагноза рака молочной железы улучшает выживаемость, а также снижает общую смертность у пациентов. Группа женщин с наибольшим потреблением селена по сравнению с группой женщин с наименьшим его потреблением, имели на 31 % ниже показатели смерти от рака молочной железы *. Однако этот результат, возможно, относится лишь к популяции с недостаточным общим пищевым потреблением селена, потому что другие исследования не подтвердили пользу добавок селена для профилактики рака *.
Селен участвует в производстве антиоксидантных ферментов, таких как супероксид-дисмутаза *. Это потенциально может повредить терапии, основанной на высоком окислительном стрессе, как например, лучевая терапия. Можно предположить, что во время такой терапии его добавки будут нежелательны.
Сообщалось о токсичности больших доз неорганического селена, однако это скорее касается приёма добавок селена. Поступление селена из пищи не способно создать его избытка, и не вызывает возражений. Из всех натуральных источников, плоды лимонника и бразильский орех являются рекордсменами по содержанию биологически доступного селена. Два бразильских ореха могут содержать до 200 мкг селена, обеспечивая дневную норму. Другие натуральные источники селена – чеснок, отруби, органические яйца, лук, брокколи *.
Эталонный уровень концентрации селена в сыворотке – 130-150 нг/мл; более высокие и более низкие показатели увеличивают риск развития рака *. Кроме того, чрезмерно высокие дозы селена способствуют развитию катаракты. Как правило, у пациентов с раком груди уровень селена в цельной крови и сыворотке крови значительно ниже нормы *, и восстановление нормального уровня селена, возможно, могло бы улучшить у них состояние здоровья. Однако в каждом случае для решения о необходимости приёма его добавок требуется предварительная оценка уровня селена в крови *.
Рекомендуется принимать не какую-то одну форму селена, а смесь различных форм (по 200 мкг каждой), потому что каждая из них оказывает отличное от других защитное действие против рака, окислительного стресса и повреждения ДНК
*.
Селен-метил-L-селеноцистеин, содержащийся в чесноке, луке и брокколи, запускает самоубийство раковых клеток с ослабленной экспрессией гена р53 (т.н. гена самоубийства)
*.
Селенит натрия усиливает действие врожденной иммунной системы против опухолевых клеток *. L-селенометионин и другие формы селена действуют как эффективные антиоксиданты, снижая мутагенные трансформации, приводящие к раку
*.
Допустимый верхний уровень приёма селена определён на уровне 400 мкг/сут; дозы выше 2 мг/сут являются потенциально токсичными.
• Сера (S) стимулирует работу печени и способствует детоксикации. Кроме того, сера входит в состав молекулы главного эндогенного антиоксиданта – глутатиона, и её недостаток может повлечь увеличение окислительного и воспалительного уровня. Удачными растительными источниками серы можно назвать чеснок и капусту, содержащие, соответственно, дисульфидные соединения и дииндолилметан. Высокое содержание серы имеют также грецкий орех, лук, бобовые, желток яйца.
• Цинк (Zn): до 25-50 мг/сут; более точная дозировка зависит от уровня меди, поскольку они являются антагонистами.
Эталонные диапазоны уровня цинка в крови составляют 70-120 мкг/дл, а значения ниже 70 мкг/дл определяются как дефицит цинка
*.
Цинк – второй по распространённости металл в организме после железа. Он имеет решающее значение для роста, развития и дифференцировки клеток *. Цинк регулирует около 300 различных ферментов и крайне важен для иммунной функции; однако раковые клетки также могут использовать цинк для усиления своей защиты *. Цинк и магний играют ключевую роль в эстрогенном балансе и детоксикации ксеноэстрогенов.
Запасы цинка в организме обычно истощаются при увеличении возраста, при многих заболеваниях, и при высоком уровне стресса. Например, дефицит цинка распространён у пожилых людей, что приводит у них к нарушению функции Т-лимфоцитов и увеличению заболеваемостью респираторными инфекциями *.
При раке молочной железы содержание цинка в сыворотке несколько падает *, хотя в опухолевой ткани молочной железы оно, похоже, поднимается *.
К сожалению, оценивать достаточность в организме цинка по его концентрации в крови будет некорректно. Низкий уровень цинка будет говорить о том, что запасы цинка в тканях настолько истощились, что уже не способны обеспечить его адекватный уровень в крови. Выведение цинка из организма осуществляется, в основном, с калом (90%) и мочой (10%). Поэтому косвенно оценить достаточность поступления цинка из пищи можно, измерив его концентрацию в моче.
Избыток меди способен привести к дефициту цинка, и наоборот. Средние уровни меди в сыворотке при раке груди выше, чем при доброкачественных заболеваниях груди (167,3 мкг/дл против 117,6 мкг/дл) и при отсутствии опухолей (167,3 мкг/дл против 98,8 мкг/дл). Причём, чем запущеннее заболевание, тем уровень меди выше. По сравнению со здоровыми женщинами, соотношение Cu:Zn было увеличено у пациентов с раком груди (1,91 против 0,86), но не у пациентов с доброкачественными опухолями груди * * * *.
В среднем, женщины среднего и пожилого возраста в странах Европы потребляют около 10 мг цинка в сутки. Это удовлетворяет современным нормам RDA, однако во время болезней, которые требуют напряжённой работы иммунных клеток, такого количества цинка будет явно недостаточно.
Пероральные добавки цинка при его общем дефиците улучшают иммунную функцию и эффективно подавляют хронические воспалительные реакции
*.
Добавка двухвалентного цинка может увеличить противо
Семена тыквы – самые богатые пищевые источники как цинка, так и магния. Другие продукты, богатые цинком – листовая зелень, грибы маслята, семена кунжута и конопли, морские водоросли, шпинат, бразильские орехи, арахис, кешью, миндаль, кедровые орешки, дикий рис, овёс, бобовые *. К сожалению, пищевые источники цинка содержат ещё бо́льшие запасы меди и/или железа. Поэтому для обеспечения баланса цинк:медь стоит рассмотреть вопрос нерегулярных добавок цинка, даже при его достатке в пище.
Поглощение цинка в кишечнике зависит от приёма других минералов, использующих тот же транспортёр, таких как кальций, магний и железо. Ежесуточный предел поглощения этого транспортёра составляет около 800 мг, и после его достижения усвоение цинка прекратится. Таким образом, следует ориентироваться на суммарное потребление этих минералов в дозировке до 800 мг/сут. Другими словами, суточное потребление цинка не должно превышать 50 мг, за исключением краткосрочных заболеваний, требующих увеличения его потребления (до 100 мг) для усиления иммунных функций.
Кроме того, усвоению цинка могут помешать фитаты, содержащиеся в некоторых растительных продуктах, а также железо, медь и марганец. Это заставляет пересмотреть свой рацион в сторону увеличения потребления цинкосодержащих продуктов.
Мы можем принимать добавки цинка в различных формах. Абсорбционная способность сульфата цинка и ацетата цинка сравнима, и достаточно благоприятна. Пиколинат цинка проявляет лучшую абсорбцию по сравнению с цитратом и глюконатом цинка * *. В то же время, оксид цинка и карбонат цинка плохорастворимы в водных растворах, что приводит к значительно худшему поглощению цинка в плазме при пероральном потреблении *. Существуют также множество других формы добавок, содержащие различные количества элементарного цинка *.
Заметим, что добавки цинка in vitro снижают восприимчивость клеток и тканей к вызванному токсинами или облучением апоптозу
*,
что заставляет с осторожностью отнестись к его добавкам во время интенсивной противо
• Хром (Cr): до 50 мкг/сут.
Трёхвалентный хром помогает инсулину справляться со скачками уровня глюкозы в крови, снижает уровень жиров в крови, а также затрудняет поступление глюкозы в раковые клетки. Кроме того, хром обеспечивает эффективную работу иммунной системы. Дефицит хрома трудно выявить из-за отсутствия точных тестов. Трёхвалентный хром, в отличие от шестивалентного, нетоксичен, и допустимый верхний уровень потребления для него не установлен. В то же время двухвалентный хром стимулирует пролиферацию клеток молочной железы через рецептор эстрогена ER-α
*.
Хорошим натуральным источником хрома являются пивные дрожжи и облепиха. Достаточно 1 ст.л. облепихи, чтобы обеспечить дневную норму хрома. Если стоит вопрос приёма добавок, то рекомендуют 400-1'000 мг/сут пиколината хрома.
• Молибден (Mo): до 50-100 мкг/сут хелатированого молибдена.
Молибден, как и цинк, является физиологическим антагонистом меди. Потребление молибдена с питьевой водой при концентрации 10 мг/л значительно подавляет у крыс образование и рост спровоцированной канцерогеном злокачественной опухоли молочной железы
*
*.
Истощение меди при помощи хелатора меди – тетратиомолибдата (100 мг/сут) приводит к снижению числа стволовых раковых клеток у пациентов с TNBC
*.
Фаза II клинического испытания показала, что тетратиомолибдат (100 мг/сут в течение 2 лет) способен предотвратить рецидивы у пациентов с высоким риском рецидивом рака молочной железы
*.
Сочетание тетратиомолибдата с доксорубицином значительно замедляет рост опухоли молочной железы воспалительного подтипа
*.
Растительные источники молибдена – плоды калины, бобовые, отруби зерновых, орехи. К сожалению, обеспечить баланс медь:молибден путём коррекции рациона не представляется возможным, поэтому добавки 50-100 мкг/сут тетратиомолибдата достойны рассмотрения. Допустимый верхний уровень потребления молибдена установлен на уровне 2 мг/сут.
• Бор (B). Суточная норма потребления бора не установлена, однако она не должна превышать 3 мг/сут.
Бор улучшает усвоение магния и кальция и снижает их потери, поддерживая костную ткань; повышает уровень антиоксидантных ферментов; ускоряет заживление ран; благотворно влияет на метаболизм эстрогена, тестостерона и витамина D; нормализует работу щитовидной железы; снижает уровни воспалительных биомаркёров; улучшает работу головного мозга; повышает устойчивость против рака груди и простаты и снижает побочные эффекты лучевой и химиотерапии
*.
Основным источником бора, как и большинства остальных элементов, рассмотренных здесь, является растительная пища. Наиболее богаты бором авокадо и сухофрукты (изюм, курага и чернослив).
• Германий (Ge): до 100 мг/сут полуторной окиси.
Германий способен увеличивать уровень интерферона, макрофагов, Т-супрессорных клеток, и усиливать активность клеток натуральных киллеров
*.
Примерами натуральных источников германия можно назвать чеснок, корни женьшеня и одуванчика.
• Цезий (Cs): до 2 мг/сут хлорида цезия.
Повышение насыщенности организма цезием сильно снижает риск рака молочной железы независимо от её подтипа
*.
Тем не менее, цезий в бо́льших дозах, видимо, способен снижать кислотность внутри раковых клеток, что может быть несовместимо с терапией, направленной на повышение внутриклеточной кислотности.
• Кремний (Si) способствует целостности соединительной ткани, что затрудняет инвазию и метастазирование рака.
• Литий (Li): до 300-1'000 мкг/сут оротата лития.
Долгожительство людей прямо ассоциировано с содержание ионов лития в питьевой воде
*
*.
Литий в доклинических исследованиях помогал сохранять более длинные теломеры ДНК, регулировал гены, связанные со здоровой ДНК и их структурой, а также защищал клетки от старения благодаря улучшению работы митохондрий. При болезни Альцгеймера добавки лития позволяли ослабить симптомы заболевания
*.
Риск рака, особенно рака груди, увеличивается у женщин с биполярным расстройством психики, и литий может представлять интерес в качестве защитной меры в обоих случаях
*.
Соли лития при определённых условиях проявляют также противо
Как и большинстве других подобных случаев, польза от приёма соединений лития, видимо, проявляется лишь при ликвидации дефицита лития, а не при его избытке. Однако адекватный уровень лития в организме не установлен.
• Азот (N) в виде оксида азота расслабляет и расширяет кровеносные сосуды, способствуя улучшению доставки кислорода. Однако не все пищевые источники азота равноценны. Нитраты (содержащиеся в рукколе, шпинате, красной свекле) способствуют снижению риска рака желудка, в то время как нитриты являтся канцерогенами и способствуют увеличению риска рака щитовидной железы и глиомы *.
В то же время, поступление некоторых других химических элементов способно сыграть, наоборот, в пользу опухоли.
• Железо (Fe) – важный элемент, который участвует в переносе кислорода и кислородонасыщении тканей, переносе электронов, энергетическом обмене и синтезе ДНК. Однако избыток свободного железа может катализировать химические реакции с образованием свободных радикалов, которые вызывают окислительный стресс и вызывают повреждение белковых структур.
C пищевой точки зрения, существует два типа железа – гемовое и негемовое. Гемовое железо присутствует исключительно в мясе, птице и рыбе, поскольку оно входит в состав гемоглобина и миоглобина. Молочные продукты и яйца не содержат гемового железа. Негемовое железо присутствует как в растительной, так и в животной пище; например, мясо содержит примерно поровну гемового и негемового железа (красное мясо имеет худшее соотношение, чем белое). Термообработка мяса лишь незначительно снижает уровень гемового железа относительно исходного уровня *.
Гемовое железо, даже при диетах с высоким содержанием мяса, составляет < 10-15 % потребляемого железа. Но по причине того, что гемовое железо усваивается лучше негемового, оно может составлять до 30 % всего железа, поступаемого с пищей. У людей не имеется эффективных механизмов регулирования уровня железа в организме. Поэтому высокое потребление мясных продуктов может привести к избытку железа в организме. Наиболее богатые гемовым железом пищевые источники: моллюски, устрицы, мидии и печень животных.
Негемовое железо составляет ~ 90 % железа в большинстве рационов. Богатые пищевые источники негемового железа – зелёные листовые овощи, сухофрукты, патока, орехи и семена, а также обогащённые злаки. Добавки, принимаемые при недостатке железа, представляют собой негемовую форму.
В Украине среднее потребление железа с пищей составляет около 15 мг/сут *, что отвечает физиологической потребности. Принятие ответственного выбора – ограничивать или увеличивать потребление железа, зависит от необходимости, выявленной в результате соответствующего исследования. Анализ уровня железа – один из важнейших регулярных тестов для пациентов, поскольку диапазон его безопасности очень узкий, а последствия выхода за этот диапазон очень драматичны.
С одной стороны, чрезмерный дефицит железа может привести к анемии и упадку иммунной системы, что наблюдается у четверти населения планеты *. С другой стороны, даже незначительный избыток железа способствует воспалению, а также делению клеток и, таким образом, усиливает рост опухоли * *. Повышение уровня ферритина (белка, который запасает и транспортирует железо) ассоциируется со значительным ростом риска фиброзно-кистозных состояний, с ростом рака молочной железы *, с риском смерти от всех причин *, а кроме того – с плохим прогнозом при метастатическом раке молочной железы *.
Активные формы кислорода, вырабатываемые в ходе нормального аэробного клеточного метаболизма, могут привести к высвобождению свободного железа из ферритина. В присутствии супероксидного радикала и перекиси водорода запасенное трехвалентное железо (Fe3+) восстанавливается до двухвалентного железа (Fe2+). Образующийся при этой реакции гидроксильный радикал ·ОН может способствовать перекисному окислению липидов, мутагенезу, разрывам цепей ДНК, активации онкогенов и ингибированию опухолевых супрессоров, увеличивая риск рака молочной железы*.
Концентрация ферритина в тканях злокачественных опухолей молочной железы в несколько раз выше, чем в тканях доброкачественных опухолей *. Если у здоровых женщин средний уровень ферритина в сыворотке составлял 45,5 нг/мл, то у женщин с доброкачественной опухолью – 48,4 нг/мл, а у женщин со злокачественной опухолью – 81 нг/мл *. Особенно значимое повышение уровня ферритина наблюдалось при PR-отрицательных подтипах опухолей. В связи с этим показатель уровня в крови ферритина должен быть в пределах 15-45 нг/мл * *.
При раке уровень железа в ткани молочной железы незначительно повышается * *, в то время как недостаток железа в других тканях представляет собой типичную картину. Высокие уровни потребления железа в наблюдательных исследованиях были связаны с увеличением роста опухолей * * – каждые дополнительные 1 мг/сут потребления железа увеличивают риск на 8 % *. И наоборот, диета с низким содержанием железа может снизить риск появления рака * и привести к замедлению роста уже имеющихся опухолей * *. Наконец, потребление добавок железа после диагностики рака ассоциируется с повышением риска смерти до 39% *.
Таким образом, перегрузка организма железом может способствовать развитию рака. По этой причине потребление красного мяса (более 9 г/сут), а тем более, потребление крови животных, можно определённо считать условно канцерогенным фактором * *, тем более, что ВОЗ классифицирует мясо как канцероген 1 группы *. Каждый 1 мг железа, получаемого из животной пищи, повышает риск сердечно-сосудистых заболеваний на 5 % *, то есть потребление одного лишь гамбургера в день увеличивает риск на 10 %.
Антиоксиданты могут несколько ослабить канцерогенное влияние потребляемого с пищей железа *, а липиды наоборот – усилить его *. Поэтому разумной выглядит рекомендация потреблять животный белок вместе с большим количеством зелени. Ограничивают поступление железа кальций, магний, чеснок, витамин Е, зелёный чай, сухое красное вино, лён, а также пищевая клетчатка, которая содержит фитиновую кислоту. К фитонутриентам, способным связывать и выводить из организма избыток свободного железа, относятся куркумин, EGCG, проантоцианидины, феруловая кислота, байкалин, кверцетин *.
Фитиновая кислота (IP6) также способна хелатировать железо, снижая вызванный железом окислительный стресс *. Поэтому IP6, как и другие хелаторы железа нежелательны при терапии артемизинином и другими терапиями, использующими окислительный стресс.
Организм неохотно расcтаётся с железом, поэтому его уровни могут постепенно нарастать, достигая нежелательных значений. Высокие уровни железа в организме наблюдаются у женщин в постменопаузе. Донорство крови способно снизить опасность железа, однако при условии, что после этой процедуры поступление железа снова не будет значительно превышать его потери.
• Медь (Cu) необходима для нормального функционирования организма. Она участвует в работе многих ферментов; требуется для развития и функционирования нервной и сердечно-сосудистой систем и фундаментально важна для гормональной, репродуктивной и иммунной систем. Однако при повышенной концентрации медь становится токсичной и, подобно железу, вызывает окислительный стресс.
Раковые ткани молочной железы, в сравнении со здоровой тканью, демонстрируют повышение концентрации меди в 1,5-2,5 раза * *. Соотношение Cu:Zn в сыворотке также растёт по мере развития злокачественной, но не доброкачественной опухоли *.
Высокие уровни меди в сыворотке (27 мкМ) против низких уровней (6 мкМ) ассоциируются с 50 %-ным увеличением относительного риска смертности от всех причин, 40 %-ным увеличением смертности от рака и 30 %-ным увеличение смертности от сердечно-сосудистых заболеваний *. Избыток меди стимулирует метастазирование и опухолевый ангиогенез * *, тогда как удаление меди при помощи хелатора может значительно подавлять in vivo ангиогенез (SUM149) *, а также и маркёры, типичные для ЕМТ (MCF-7) *.
Таким образом, неоправданное применение добавок меди может способствовать развитию опухоли. С учётом того, что с пищей обычно поступает более, чем достаточное количество меди, её добавки не могут быть рекомендованы. Исключением является случай, когда медь вводится преднамеренно для усиления окислительного стресса во время химиотерапии, и её избыток удаляется по окончании терапии.
Натуральные источники меди включают семена кунжута, бразильский орех, лесной орех, кешью, кедровые орешки, какао, бобовые
*.
Самые известные хелаторы меди – тетратиомолибдат, дисульфирам (антабус), куркумин, блеомицин, ионофоры.
• Тяжёлые и токсичные металлы демонстрируют патологическое накопление в ткани молочной железы, и подозреваются в прямой связи с процессом злокачественного роста * *. Ионы многих металлов могут создавать окислительный стресс, а также связываться с рецепторами эстрогена и проявлять таким образом эстрогенные эффекты *. Это, в частности, алюминий, сурьма, мышьяк, барий, хром, никель, кадмий, кобальт, медь, олово, свинец, ртуть и ванадий.
Мышьяк, например, классифицируется как канцероген * I класса, наряду с асбестом, сигаретным дымом, формальдегидом, плутонием и обработанным мясом. Свинец может заместить в молекулах железо или кальций, становясь на их место; но не может заменить железо или кальций в выполнении их функций. Например, замена железа свинцом в молекуле гемоглобина лишают её способности переносить кислород. Кадмий может замещать цинк, ухудшая тем самым иммунную функцию. А замена кальция свинцом в клетках мозга лишают их способности обрабатывать сообщения от нервных клеток.
Некоторые растительные и пищевые продукты обладают слабыми свойствами связывать и удалять из организма тяжёлые металлы. Это Чеснок (Allium sativum), луковица; Расторопша (Silybum marianum), семена; Кориандр (Coriandrum sativum), листья; Гинкго билоба (Ginkgo biloba), листья; Куркума (Curcuma longa), корень; Амла (Emblica officinalis), плоды; растворимая растительная клетчатка, такая как пектин; а также зелёные водоросли, такие как Хлорелла (Chlorellales) *. И хотя их эффективность значительно ниже, чем специализированных химических средств, длительное систематическое их потребление способно склонить баланс дебета и кредита токсичных металлов в благоприятную для нас сторону.
Даже небольшое изменение уровня микроэлементов в ткани вызывает нарушение её метаболизма. Как и в случае с витаминами, избыток многих химических элементов может быть не менее вреден, чем их недостаток *. То же самое можно сказать про их дисбаланс. Поэтому основанием для принятия решения о приёме добавок элементов, а также об их дозировке, могут быть только результаты регулярно проводимых биохимических анализов.
Другим важным фактором в пользу проведения коррекции уровня ионов того или иного элемента, может быть терапевтический статус больного. Высокие уровни железа и меди увеличивают концентрацию активных форм кислорода. Таким образом, в пост-терапийный период может быть полезным снижение уровня меди и железа, в то время как во время лучевой терапии и химиотерапии, использующей высокий окислительный стресс, наоборот, их добавки могут оказаться полезными. А с цинком ситуация, похоже, прямо противоположная.
Баланс элементов. Как и во многих других случаях, важную роль играет не только количественное содержание элементов, но и их баланс.
Так, оптимальное соотношение Ca:Mg в плазме должно быть 2:1, но не ниже 1,7:1 и не выше 2,8:1. Высокое соотношение Ca:Mg (> 2,59) в пище связано с более низкой смертностью от всех причин, особенно для женщин в постменопаузе *.
Оптимальное соотношение Cu:Zn в плазме должно быть в пределах 0,7:1-0,8:1 * *. Преобладание меди над цинком является очень неблагоприятным фактором развития рака *. Низкое соотношение цинка к меди увеличивает окислительный стресс *. С возрастом соотношение склоняется в пользу меди, и ухудшает прогноз смертности от всех причин *.
Соотношение меди к цинку в раковой ткани молочной железы увеличивается не только в сравнении с нормальной тканью, но даже в сравнении с тканью доброкачественной опухоли
*,
и растёт по мере развития болезни
*,
то есть связано с показателем злокачественности. Химиотерапия способна ещё больше увеличить преобладание меди за счёт снижения уровня цинка
*,
что предполагает пользу от приёма добавок цинка после противо
У раковых пациентов также наблюдается увеличение соотношения медь:селен в плазме (2,1:1) по сравнению со здоровыми женщинами (0,9:1)
*.
Низкое соотношение Ca:P в пище (~ 1:2), видимо, также может значительно усилить риск рака молочной железы
*.
Измерения параметров плазмы крови в различных исследованиях показывают, что у пациентов с раком груди уровни меди, марганца и молибдена значительно выше, чем у здоровых людей, а уровни селена наоборот, ниже
*
*.
Контроль уровня минералов. Для принятия решения о необходимости минеральной коррекции, требуется выяснить текущий уровень интересуемых элементов. Однако точное определение физиологического избытка или недостатка того или иного элемента представляет собой определённые трудности. Состав крови наиболее строго контролируется в организме; при дефиците того или иного компонента в крови он извлекается из тканей, а при избытке депонируется в ткани. По этой причине, анализы крови во многих случаях не скажут ничего определённого о системном дефиците важнейших химических элементов; для представления объективной картины потребуется химический анализ интересующих нас тканей.
Невозможно, например, ясно оценить дефицит кальция или фосфора без минерального анализа костной ткани. Тем не менее, анализ крови может достаточно определённо сообщить нам об уровне таких элементов, как цинк, медь, магний, селен, кадмий, свинец и ртуть
*.
Анализ мочи может рассказать нам об уровне таких элементов, как йод, бром, селен, мышьяк, кадмий и ртуть. Строго говоря, анализ мочи отображает то, что выделяется, а не то, что присутствует, тем не менее, во многих случаях она даёт представление об уровне этих элементов в теле.
Анализ волос также может дать некоторое представление о минеральном составе тела. Несмотря на то, что волосы и ногти могут быть значительно загрязнены внешним воздействием, при помощи их анализа можно предположить избыток токсичных металлов (таких, как свинец, ртуть, мышьяк и кадмий), а также определить примерные уровни в организме незаменимых минералов – кальция, магния и селена.
Академия питания и диетологии США (The Academy of Nutrition and Dietetics) придерживается позиции, что добавки с витаминами и микроэлементами оправданы в том случае, если адекватное их поступление с пищей не удовлетворяется. Особенно подвержены этому риску люди с хроническими заболеваниями, при приёме лекарств, при беременности и кормлении грудью, при быстром росте организма, а также в преклонном возрасте. В то же время, регулярное и неизбирательное использование добавок микроэлементов для предотвращения хронических заболеваний не рекомендуется ввиду отсутствие научных данных *.
Из всего изложенного выше можно сделать следующие выводы:
- основным источником витаминов и химических элементов должна быть пища;
- следование предложенным диетическим рекомендациям может избавить от необходимости приёма добавок;
- необходимость приёма тех или иных добавок должна быть обоснована их недостатком, который выявляется лабораторным путём;
- добавки должны восполнять дефицит, а не значительно превышать физиологическую норму;
- наиболее распространены в Украине дефициты витамина D, йода, селена, цинка, магния и кальция, и можно предположить, что периодический приём этих добавок в небольших дозах принесёт скорее пользу, чем вред.
Следует также помнить, что средние суточные потребности в витаминах и минералах, обсуждённые выше, отображают лишь нормы, которые удовлетворяют большинство населения, но не всё население. У каждого человека существуют индивидуальные особенности того, что следует считать «нормальным» потреблением. Но к сожалению, у нас пока нет возможности измерить или оценить эту «нормальность» иначе, кроме как полагаться на внутреннюю интуицию человека, выраженную в его пищевых желаниях.
Помимо витаминов, минералов и незаменимых аминокислот, имеются и другие незаменимые вещества, без которых обмен веществ человека не будет полноценным, что может негативно повлиять на общее состояние здоровья. Это, например, незаменимые углеводы, незаменимые аминокислоты и незаменимые жирные кислоты.
Незаменимые аминокислоты. К незаменимым аминокислотам для здорового взрослого человека относятся валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин. Кроме того, гистидин является незаменимой аминокислотой для детей. Сбалансированное питание способно полностью удовлетворить потребность в них. Возможный дисбаланс потребляемых незаменимых аминокислот легко устранить, пользуясь таблицами содержания незаменимых аминокислот в различных продуктах. Для обеспечения баланса руководствуются следующими пропорциями: триптофан – 1 часть, треонин – 2 части, фенилаланин – 2 части, метионин – 3 части, лизин – 3 части, валин – 3 части, изолейцин – 3 части, лейцин – 3,5 части.
Дополнительного приёма незаменимых аминокислот для здоровья молочной железы не требуется, скорее наоборот * *. Незаменимость аминокислот вовсе не означает, что их следует потреблять в высоких количествах. Известно, что кроме усиления гликолиза, раковые клетки отличаются от нормальных также поглощением и выработкой некоторых аминокислот *, обеспечивающих производство основной части углеродо- * и азотосодержащей * биомассы для быстропролиферирующих раковых клеток. Таким образом, щедрое их обеспечение аминокислотами из пищевого белка может способствовать развитию опухоли. И наоборот, ограничение сырьевой базы для построения новых клеток будет, скорее, способствовать торможению роста опухоли.
Кроме общего ограничения поступления аминокислот, возможно также целевое ограничение конкретно той или иной аминокислоты, поскольку к дефициту некоторых их них раковые клетки более чувствительны, чем нормальные клетки. Примером может служить метионин
*.
Помимо противо
Незаменимые жирные кислоты – группа полиненасыщенных жирных кислот, которые не способны вырабатываться в организме человека. Фактически, существуют лишь две незаменимые жирные кислоты (НЖК), из которых могут синтезироваться другие жиры. Это линолевая кислота (linoleic acid, LA) – предшественник жирных кислот серии ω-6, и альфа-линоленовая кислота (alpha-linolenic acid, ALA) – предшественник жирных кислот серии ω-3. Такие жирные кислоты ω-3, как эйкозапентаеновую (EPA) и докозагексаеновую (DHA) легко получить из рыбного жира.
Потребление женщинами полиненасыщенных жиров (PUFA) в количестве более 10 % от общего потребления энергии было связано со снижением риска рака молочной железы в 2,5 раза по сравнению с потреблением менее 10 % *. Каждые 100 мг/сут ω-3 в диете обеспечивают 5 % снижения риска рака молочной железы *. При этом, однако, стоит соблюдать меру, поскольку высокое потребление жиров, особенно насыщенных, увеличивает заболеваемость раком молочной железы *. Проспективные исследования также твёрдо установили защитную роль потребления жирных кислот ω-3 из рыбного жира * *.
Интересно, что для риска заболеваемости может иметь значение источник НЖК. Потребление ALA (ω-3) непосредственно из фруктов, овощей и растительных масел ассоциируется со снижением риска, тогда как её потребление из ореховых смесей и обработанных пищевых продуктов ассоциируется с увеличением риска *. Видимо, другие пищевые компоненты способны усиливать или ослаблять положительный эффект жирных кислот ω-3.
Кроме абсолютных значений, важное значение имеет соотношение потребляемых жирных кислот *. В опытах на крысах, высокое соотношение ω-3:ω-6 (1:1) обеспечивало более низкие показатели воспалительных маркёров и лучшее снижение ожирения, чем низкое соотношение (< 1:4) *.
В большинстве человеческих исследований женщины с высоким соотношением потребляемых жирных кислот ω-3:ω-6 демонстрируют более низкий риск развития рака молочной железы по сравнению с женщинами с низким соотношением * * * * * * *. В частности, низкое (< 0,2) соотношение ω-3:ω-6 ассоциируется с двукратным повышением риска рака молочной железы по сравнению с контрольной группой * *. Идеальным соотношением ω-3:ω-6, видимо, является 1:2-1:2,5 * *; во всяком случае, оно не должно выходить за пределы 1:5 * *. Жирные кислоты ω-6 потребляются в современном рационе более, чем достаточно, сдвигая баланс потребляемых жирных кислот в неблагоприятную сторону. В Украине, например, среднее соотношение ω-3:ω-6 превышает показатель 1:20.
Механизмы действия ω-3 включают снижение про-воспалительных производных липидов, ингибирование продукции цитокинов и снижение передачи сигналов рецептора фактора роста в результате изменений в липидном слое мембраны клетки. Добавки ALA (15 мл льняного масла, т.е. 1 ст.л. в день) в течение 3 месяцев значительно снижали у пациентов уровень С-реактивного белка (на 38 %), сывороточного амилоида А (на 23 %) и IL-6 (на 10 %) по сравнению с исходными значениями *.
Обычно рекомендуемое потребление смеси EPA и DHA составляет 250-500 мг/сут *, что соответствует примерно 1-1,5 г рыбного жира; допустимый верхний предел – 5 г/сут *.
Незаменимые углеводы (гликонутриенты) * являются недавно объявленным классом необходимых углеводных питательных веществ, наряду с незаменимыми аминокислотами и незаменимыми жирными кислотами. До этого углеводы рассматривались исключительно как источник энергии, однако теперь они рассматриваются также как участники передачи клеточных сигналов. Образуя гликопротеины, углеводы обеспечивают значительно большее число комбинаций структуры сигнальных молекул, чем это могут обеспечить одни лишь аминокислоты.
Некоторые простые углеводы необходимы для производства правильно структурированных и, следовательно, правильно функционирующих гликопротеинов, участвующих в общении клеток. Хотя эта идея убедительно не доказана, предполагается, что их дефицит ведёт к изменению структуры гликопротеинов, а значит – к нарушению клеточной коммуникации, что может способствовать ряду дегенеративных заболеваний, в том числе и раку.
В современной западной диете наблюдается чудовищный дисбаланс простых углеводов в пользу сахарозы (сахара), которая метаболируется до фруктозы и глюкозы. Галактоза тоже обычно потребляется в достаточной мере, чего нельзя сказать о других простых сахарах. Пища палеолитического человека была более разнообразной, в том числе, в отношении простых сахаров, а также слизей и камедей, например, смолы плодовых деревьев.
Выделено одиннадцать основных биологически активных простых сахаров – глюкоза, D-манноза, L-фукоза, D-ксилоза, D-галактоза, L-арабиноза, N-ацетилглюкозамин, N-ацетилгалактозамин, N-ацетил-нейраминовая кислота, идуроновая кислота и глюкуроновая кислота. Некоторые из них обычно не удаётся получать в достаточном объёме из принимаемой пищи. Коррекция рациона или, в крайнем случае, некоторые добавки могли бы исправить дисбаланс потребления простых сахаров. Это, например, такие добавки, как алоэ вера (манноза); семя пажитника (манноза, галактоза); ламинария, она же келп (фукоза, ксилоза, манноза, галактоза); лечебные грибы (фукоза); пивные дрожжи (фукоза); концентрат сывороточного протеина (N-ацетилнейраминовая кислота); хрящи животных (N-ацетилглюкозамин, N-ацетилгалактозамин); семя подорожника (ксилоза).
Некоторые пищевые добавки содержат готовые комплексы всех 11 биоактивных сахаров, сочетая такие натуральные источники, как гуаровая (E412), акациевая, аравийская, ксантановая или декстрановая камедь; камедь лиственницы (E409), вишни, сливы, рожкового дерева, карайи; неочищеный сахар; агар; альгин; астрагал; гумми-гатти; пектин; хитин; гемицеллюлоза; инулин и другие
*.
То есть, те пищевые продукты, которые не попадают в пищу из-за неполноценности и однообразия современной городской диеты. В одной из добавок предлагается следующий состав капсул формата #00: галактоза – 25 мг, фукоза – 50 мг, манноза – 110 мг, ксилоза – 38 мг, ацетилглюкозамин – 38 мг, ацетилнейраминовая кислота (сиаловая кислота) – 38 мг, ацетилгалактозамин – 50 мг. Приём в качестве добавки 2 таких капсул в день может оказать ощутимую противо
Незаменимые углеводы не накапливаются в организме, то есть, не создают своего запаса. В зависимости от своей химической структуры, они метаболируются в течение от нескольких минут до нескольких часов. Таким образом, для своей постоянной концентрации, они требуют регулярного приёма. В противоположность незаменимым углеводам, простые сахара (например, сиаловая кислота) могут способствовать производству гликопротеинов, укрывающих раковые клетки от иммунного надзора, и тем самым способствовать метастазированию *. При раке простаты высокие уровни в опухоли сиаловой кислоты ассоциируются с плохим прогнозом, тогда как высокие уровни фукозы ассоциируются с хорошим прогнозом *.
В Украине самым доступным источником незаменимых углеводов является смола абрикосового дерева. Она на две трети состоит их углеводов, и богата L-арабинозой, D-галактозой, ксилозой, маннозой и рамнозой, соответственно, 41 %, 24 %, 18 %, 14 % и 3 % всех моносахаридов (в молярных процентах) *. Её можно собирать в течение всего лета. Вишня, слива и другие косточковые менее плодовиты на смолу. Интересно, что в Иране смола абрикоса применяется в народной медицине при кашле, а также для улучшения цвета лица. Камедь косточковых деревьев можно также использовать в качестве натурального фармацевтического наполнителя, который увеличивает биодоступность нутрицевтиков, замедляет их усвоение (и, соответственно, метаболирование), а также улучшает их доставку внутри организма.
Антиоксиданты способны уменьшать окислительное повреждение клеточных структур, снижать воспаление, сдерживать пролиферацию и ангиогенез, а также усиливать апоптоз *. Кроме того, они способны смягчать токсичность стандартных процедур лечения рака благодаря защите нормальных клеток *.
Профилактические возможности антиоксидантов были изучены, как минимум, в двух широкомасштабных клинических исследованиях. Одно плацебо-контролируемое исследование было проведено в Китае, и продолжалось около 7 лет. Здесь пациентам в 4 различных группах давали добавки: ретинола (5'000 МЕ/сут) и цинка (22,5 мг/сут); рибофлавина (3,2 мг/сут) и ниацина (40 мг/сут); витамина C (120 мг/сут) и молибдена (30 мкг/сут); и бета-каротина (15 мг/сут), витамина Е (30 мг/сут) и селена (50 мкг/сут). Ежесуточные дозировки добавок были выше рекомендуемых в США в 1-2 раза.
Наиболее выразительное снижение заболеваемости (на 16 %) и смертности (на 10 %) от рака пищевода, наблюдалось у тех, кто получал добавки бета-каротина, витамина Е и селена *. Положительный эффект добавок мог быть результатом того, что исходный уровень микронутриентов в популяции был очень низким по диетическим причинам. Интересно, что снижение риска начинало проявляться лишь через 1-2 года после начала приёма добавок.
В другом аналогичном 7-летнем клиническом исследовании (SU.VI.MAX), проведенном во Франции, также была проверена эффективность антиоксидантных добавок в деле снижения заболеваемости раком. В общий список добавок были включены витамины С (120 мг/сут), Е (30 мг/сут) и бета-каротин (6 мг/сут), а также минеральные вещества – селен (100 мкг/сут) и цинк (20 мг/сут) *. Здесь 31 %-ное снижение общей заболеваемости раком и 37 %-ное снижение общей смертности наблюдалось у мужчин, но не у женщин, которые имели более высокий базовый уровень витаминов и минералов по сравнению с мужчинами *.
Исходя из этого, можно сделать вывод, что профилактическая эффективность антиоксидантов проявляется только тогда, когда компенсируется их нехватка, но не тогда, когда их в избытке.
После постановки диагноза приём антиоксидантных добавок тоже может быть полезен, поскольку обычно наблюдается их дефицит. Похоже, что снижение общего антиоксидантного уровня идёт параллельно с развитием опухолевого процесса.
Мета-анализы показывают, что потребление витамина C (100 мг/сут) после диагностирования рака на 22 % снижает смертность от рака молочной железы, и на 22 % – общую смертность по сравнению со средними показателями в популяции *. Женщины, принимавшие умеренные дозы добавок (витамины A, B, С, D, Е, поливитамины) в течение 6 месяцев после диагностики инвазивного рака молочной железы, имели на 18 % ниже риск смертности, и на 22 % – риск рецидивов *. Обратная связь наблюдалась также у женщин, перенесших операцию, независимо от того, принимались ли витамины одновременно с химиотерапией или нет, однако она была явно выражена только среди тех пациентов, которые не получали лучевую терапию.
Оценка использования добавок после лечения (витамины A, B, C, D, E и поливитамины), через 1-5 лет после постановки диагноза, показала, что поливитамины, витамины С или Е не были связаны с рецидивом, но были связаны со снижением риска смерти на 16 %. Кроме того, витамин D был связан со снижением риска рецидива среди ER-положительных, но не ER-отрицательных опухолей *.
Во время терапии антиоксиданты могут поддерживать не только здоровые, но и раковые клетки, и у нас нет надёжных способов обеспечить избирательную их доставку исключительно здоровым клеткам. Это вызывает естественные споры о целесообразности антиоксидантных добавок в этот период.
Преобладает мнение, что антиоксиданты могут мешать основному лечению, поскольку как лучевая терапия, так и многие препараты химиотерапии используют окислители для повреждения ДНК и клеточных органелл раковых клеток. Руководствуясь принципом «Не навреди», врачи не рекомендуют во время противо
Хотя принято считать, что клеточные повреждения, вызываемые некоторыми химиопрепаратами, происходят за счёт окисления, большинство из них убивает опухолевые клетки, нарушая метаболизм ДНК через неокислительные механизмы. Исходя из этого, можно предположить, что антиоксиданты могут предотвращать нежелательные повреждения тканей, не влияя на эффективность химиотерапии *. Более того, окислительный стресс, связанный с воспалением в опухолевой ткани, может затруднять уничтожение опухоли. Причина этого в том, что оксиданты могут препятствовать апоптозу, вызываемому химиотерапевтическими агентами (этопозид, доксорубицин, фторурацил), однако это можно преодолевать при помощи антиоксидантов * *.
Действительно, анализ 50 отчётов о клинических испытаниях с участием 8'521 пациентов показал, что безрецептурные антиоксиданты и некоторые другие добавки не снижают эффективность лучевой/химиотерапии рака. Наоборот, они увеличивают поражающее действие терапевтических средств, уменьшают их побочные эффекты, и защищают нормальную ткань. Здесь были рассмотрены бета-каротин; витамины А, С, Е, D3, К3; витамины группы В; селен; цистеин и глутатион. Пациенты, принимавшие антиоксиданты и другие питательные вещества, фактически имели повышенную выживаемость * *.
Ещё один обзор 19 клинических испытаний не обнаружил никаких доказательств значительного снижения эффективности от антиоксидантных добавок во время химиотерапии. Некоторые исследования не показали пользы от антиоксидантных добавок. Однако во многих других, антиоксидантные добавки приводили к увеличению времени выживаемости, усилению терапевтической реакции, а также к ослаблению токсичности химиотерапии по сравнению с контрольной группой *. Здесь список антиоксидантов включал глутатион, мелатонин, витамин А, витамин C, N-ацетилцистеин, витамин Е и эллаговую кислоту.
Наконец, в обзоре 2018 года были собраны результаты приёма тринадцати различных антиоксидантов и их аналогов в качестве монотерапии или в сочетании с химиотерапией. Сюда были включены 174 рецензируемых оригинальных статьи с 1967 по 2017 годы, включая 93 клинических испытания с общим числом 18'208 пациентов. Данные подтвердили, что антиоксиданты обладают огромным потенциалом снижения токсичности, вызванной химиотерапией. Кроме того, добавки антиоксидантов во время химиотерапии прогнозировали более высокую терапевтическую эффективность и увеличение продолжительности жизни пациентов *.
Ещё один мета-анализ 2021 года показал, что использование антиоксидантно-витаминных добавок после диагностики не ухудшает выживаемость при раке молочной железы, в то время как использование витамина С после постановки диагноза может заметно улучшить общую выживаемость *.
Кроме рассмотренных ранее витаминных антиоксидантов, могут быть использованы другие антиоксидантные вещества.
• Метоксантин, он же пирролохинолин хинон (pyrroloquinoline, PQQ), известный также как витамин В14 – сильный водорастворимый антиоксидант. Метоксантин – это кофермент, критически важный для клеточного энергетического гомеостаза и окислительно-восстановительного баланса *. Метоксантин защищает клетки во время митохондриального стресса и повышенной окислительной нагрузки * *.
Диета с добавлением метоксантина обеспечивает бо́льший расход энергии благодаря увеличению количества митохондрий в ткани печени, а также защищает сердце от недостатка кислорода
*,
что способно защищать сердечные клетки при сердечном ударе. Потребление 25 мг/сут метоксантина усиливает противо
• Кофермент Q10 (CoQ10) – жирорастворимый антиоксидант, стимулятор иммунной системы, усилитель митохондриального дыхания. CoQ10 управляет экспрессией нескольких сот генов, многие из которых вовлечены в передачу воспалительных сигналов, в частности, NF-κB *.
Как дополнение к основному лечению, и в сочетании с витаминами С, Е, бета-каротином, пироксидаль-фосфатом, селеном и жирными кислотами ω-3, CoQ10 способствует увеличению срока выживаемости пациентов с раком молочной железы и даже регрессии опухоли * *. Низкие уровни циркулирующего в крови CoQ10 ассоциировались с высоким риском рака молочной железы так же, как и чересчур высокие уровни; а при уровне циркулирующего CoQ10 в диапазоне 500-800 нг/мл наблюдался самый низкий риск развития рака молочной железы *. Дозировка: 100-400 мг/сут.
• Альфа-липоевая кислота (тиоктовая кислота). Витаминоподобное антиоксидантное вещество, основной антиоксидант в клеточных митохондриях. Усиливает действие других антиоксидантов и витаминов. Способствует снижению концентрации глюкозы в крови и общей детоксикации. Дозировка: 400-1'000 мг/сут.
• Мелатонин (melatonin) – ночной гормон, уровень которого падает по мере старения. Защищает клетки организма от окислительного разрушения в ночное время. Принимают от 3 мг перед сном.
• Эпигаллокатехин-галлат (EGCG). Сильный водорастворимый антиоксидант. Снижает активность фактора роста VEGF, активирует лимфоциты, подавляет ангиогенез и метастазирование на начальных стадиях болезни. Дозировка: 10 г/сут сухого экстракта зелёного чая без кофеина (600-1'000 мг/сут чистого EGCG). Принимать 3 месяца, затем перерыв не менее 3 месяцев.
Чистый EGCG может быть предпочтительным, поскольку зелёный чай, помимо своей пользы, способен увеличивать уровень дигидротестостерона.
Альтернативы: катехины зелёного чая в виде биодобавки «Тигрин» (Tegreen™), зелёный чай «матча».
Стоит, однако, признать, что не все исследования подтверждают пользу антиоксидантных добавок во время химиотерапии. Хотя и в меньшем количестве, но имеются и противоположные данные, и такая неопределённость требует особого рассмотрения.
Причины неоднозначности результатов различных исследований, среди прочего, могут объясняться различными условиями действия антиоксидантов.
Первый график показывает, что при невысокой насыщенности клеток и тканей свободными радикалами, последние не оказывают существенного негативного влияния. Однако по мере роста окислительного стресса, они начинают действовать пролиферативно, стимулируя рост клеток. Наконец, при очень высокой концентрации свободные радикалы разрушают белки и липиды как раковых, так и здоровых клеток, вызывая их гибель.
При различных начальных условиях приём дополнительных антиоксидантов может привести к прямо противоположным результатам. Рассмотрим на следующем графике отношения всех трёх факторов – антиоксидантных запасов в организме, концентрацию АФК и клеточную пролиферацию. Выделим отдельным цветом пациентов с исходными относительно низким, средним или высоким уровнем антиоксидантных резервов (соответственно оранжевый, зелёный и фиолетовый цвета).
Становится видно, что по мере роста концентрации свободных радикалов антиоксидантные резервы раковой клетки уменьшаются для всех трёх групп пациентов. Причём раковые клетки у пациентов с низкими антиоксидантными запасами более восприимчивы к окислительному стрессу, чем у пациентов с высокими резервами. Например, точка G, соответствующая прекращению пролиферации, скорее наступает для пациентов с низким запасом антиоксидантов (оранжевый цвет), чем для пациентов с высоким запасом (фиолетовый цвет).
А теперь попробуем оценить последствия приёма антиоксидантных добавок для различных конкретных ситуаций.
• Ситуация умеренного окислительного стресса при среднем запасе антиоксидантов в раковой клетке (точка D на зелёной линии).
Такой случай может быть у пациента, не подвергавшегося лучевой или химиотерапии, благодаря чему концентрация АФК не очень высока. Если при неизменном уровне АФК пациент принимает дозу антиоксидантов, достаточную для создания высоких резервов, то нам следует провести воображаемую вертикальную линию вверх от точки D к фиолетовой кривой (кривой пациента с высокими антиоксидантными резервами), где мы попадём к месту между точками С и D. Обращаясь теперь к предыдущему графику, мы видим, что движение от точки В к месту между точками С и D вызовет небольшое увеличение пролиферации.
• Ситуация умеренного окислительного стресса при низком запасе антиоксидантов (точка D на оранжевой линии).
Такой случай возможен у пациента, который не подвергался химиотерапии. Если пациент начнёт поднимать уровень антиоксидантных резервов до высокого уровня, то нам следует провести воображаемую линию от оранжевой точки D вверх до фиолетовой линии, где мы попадём между точками B и С. Обращаясь вновь к предыдущему графику, мы видим, что движение от точки D к месту между точками В и С вызывает заметное снижение пролиферации за счёт снижения окислительного стресса, т.е. за счёт снижения воспалительных сигналов.
Если же взять для рассмотрения точку Е вместо D, то увеличение уровня антиоксидантов произведёт движение от точки Е к месту между точками С и D, что практически не повлияет на пролиферацию.
• Ситуация умеренно-высокого окислительного стресса при низком запасе антиоксидантов (точка F на оранжевой линии).
У терминального пациента, который не прошёл химиотерапию, антиоксидантные резервы могут быть истощены, а окислительный стресс может быть хоть и высоким, но не настолько, каким он мог бы быть при химиотерапии. Пролиферация, судя по верхнему графику, сдерживается высоким окислительным уровнем. Увеличение антиоксидантного запаса приводит нас к месту между точками D и Е на фиолетовой кривой. Верхний график показывает, что движение от точки F к точкам D и Е может вызвать умеренное увеличение пролиферации.
• Ситуация высокого окислительного стресса при низком запасе антиоксидантов (точка Н на оранжевой линии).
Увеличение запасов антиоксидантов в данном случае приводит нас в точку F на фиолетовой кривой. Верхний график показывает, что положение для раковых клеток при этом принципиально меняется: из зоны смерти они перемещаются в зону умеренной пролиферации. Становится понятным, почему низкие (пероральные) дозы витамина C вместо уничтожения опухоли иногда могут вызвать значительное увеличение пролиферации.
Данный анализ различных ситуаций, изложенный Джоном Бойком (John Boik) *, объясняет, почему последствия увеличения концентрации антиоксидантов могут различаться в зависимости от начальных условий. Ни в одном из многочисленных клинических исследований не были измерены начальные антиоксидантные возможности клеток. Вызванный этим большой разброс полученных результатов не позволял объективно оценить противоопухолевую роль антиоксидантных добавок, но зато приводил к разноречивым выводам.
Из этих графиков проясняется сложная роль антиоксидантов. В не-терапийный период антиоксиданты ослабляют окислительный стресс, снижая тем самым уровень воспаления и пролиферацию клеток. В терапийный период антиоксиданты могут защищать раковые клетки. Однако в последнем случае они могут также и стимулировать пролиферацию, что вводит раковые клетки в цикл деления, тем самым подставляя их под смертельное воздействие химиотерапевтических цитотоксинов.
Учитывая неоднородность опухоли, добавки антиоксидантов могут по-разному влиять на различные её участки. В одних местах пролиферация будет снижена за счёт ослабления окислительного стресса; в других она не изменится; а в третьих она будет повышена, что может усилить терапевтический эффект стандартного протокола. С учётом защитной роли антиоксидантов для здоровых клеток становится понятным, почему они оказались полезными в большинстве рассмотренных выше исследований, хотя не во всех.
Антиоксиданты также могут оказывать биологическое воздействие на раковые клетки, не связанное с окислительным повреждением. Они усиливают дифференцировку, апоптоз и ингибирование роста раковых клеток, а также ингибируют или усиливают экспрессию генов и/или активность многих белков *. Антиоксиданты избирательно подавляют восстановление радиационных повреждений раковых клеток, но защищают нормальные клетки, и нет опубликованных исследований, показывающих, что антиоксиданты защищают раковые клетки от радиации * *.
Чтобы оценивать потенциальный эффект, стоит делать различия не только между дозами и начальными условиями, но также между классами антиоксидантов, и даже конкретно между каждым из них. Эндогенные антиоксиданты, такие как глутатион, могут повышать стойкость некоторых раковых клеток *; увеличивать метастатический потенциал раковых клеток *; а также стимулировать переход клеточного цикла в фазу репликация ДНК *. Экзогенные антиоксиданты, такие как витамины A, B, C, E, не были замечены в таких эффектах.
В попытке примирить две противоположные концепции относительно антиоксидантов, был предложен научно обоснованный комплекс микронутриентов, который можно использовать вместе с лучевой терапией * *. Он включает высокие (но не низкие) дозы пищевых антиоксидантов – буферированый витамин С, натуральный витамин Е, натуральный витамин А и натуральный витамин В *, а также некоторые другие биоактивные добавки, за исключением меди, железа и марганца. Полный состав патентованой * смеси «Optimal Health»:
- витамин A (ретинола пальмитат) – 5'000 МЕ/сут (2,75 мг/сут);
- бета-каротин из морских водорослей – 75 мг/сут;
- витамин E натуральный (α-токоферилсукцинат) – 900 МЕ/сут (800 мг/сут);
- витамин C буферированый (аскорбат кальция) – 9'000 мг/сут;
- витамин D3 (холекальциферол) – 400 МЕ/сут (10 мкг/сут);
- мононитрат тиамина – 4 мг/сут;
- рибофлавин – 5 мг/сут;
- аскорбат ниацинамида – 30 мг/сут;
- D-кальций пантотенат – 10 мг/сут;
- гидрохлорид пиридоксина – 5 мг/сут;
- цианокобаламин – 10 мкг/сут;
- фолиевая кислота – 800 мкг/сут;
- D-биотин – 200 мкг/сут;
- селен (L-селено-метионин) – 100 мкг/сут;
- пиколинат хрома – 50 мкг/сут;
- глицинат цинка – 15 мг/сут;
- цитрат кальция – 250 мг/сут;
- цитрат магния – 125 мг/сут.
Обширный список микронутриентов объясняется тем, что многие из них могут быть истощены во время лучевой терапии.
Было также предложено несколько других подобных формул.
Половину дозы принимают утром и половину – вечером, потому что период полувыведения большинства из этих микронутриентов составляет около 6-12 часов. Этот комплекс пищевых антиоксидантов предлагается принимать до и после облучения – в течение всего терапевтического периода и, как минумум, месяц после него.
В пилотном исследовании 2004 года (фаза I/II), такое дополнение к лучевой терапии значительно снижало у пациентов с раком молочной железы 0-III стадии относительный риск возвращения и метастазирования опухоли в течение последующих 22 месяцев наблюдения *. Из 25 человек в контрольной группе у 2 наблюдался рецидив, в то время как в опытной группе из 22 человек рецидивов не было. К сожалению, малая выборка не даёт достаточной убедительности результата, и его вправе поставить под сомнение; тем более, что с тех пор никто не доказал такой успех в более масштабных исследованиях.
Тем не менее, доклинические исследования дают оптимистичные результаты. Витамин C, α-токоферилсукцинат и натуральный β-каротин в высоких дозах заметно изменяют экспрессию генов, уровни белков и транслокацию определённых белков. Что, в свою очередь, вызывает дифференцировку, подавление роста и апоптоз раковых клеток, не оказывая аналогичного воздействия на большинство нормальных клеток * * *.
Смесь пищевых антиоксидантов – витамин C (100 мкг/мл), α-токоферол (10 мкг/мл) и β-каротин (10 мкг/мл) сама по себе незначительно усиливала апоптоз, однако сильно увеличивала апоптотический эффект паклитаксела и карбоплатина in vitro *. Наиболее выраженный эффект наблюдался, когда клетки обрабатывались смесью антиоксидантов непосредственно перед началом химиотерапии, после чего следовало воздействие паклитакселом в течение 24 часов, а затем – воздействие карбоплатином в течение 24 часов.
Подводя итог, можно сказать, что достаточный запас антиоксидантов очень важен для профилактики заболевания и поддержания здоровья, однако их избыток не даёт заметной пользы, а при многих условиях даже может быть вреден. Впрочем, то же самое можно сказать и про любые другие добавки. Превышение физиологической нормы эндогенных веществ, как и постоянный приём экзогенных веществ в объёмах, значительно превышающие объём, который мог бы поступать из пищевых источников, неоправдано.
В то же время, в период противораковой терапии сверхвысокие дозировки экзогенных антиоксидантов могут усиливать её эффективность. Однако и в первом, и во втором случае, результат будет зависеть от исходного уровня свободных радикалов в опухолевой ткани.
Пищеварительные ферменты оказывают многогранное действие на процессы, протекающие в организме.
Прежде всего, совместно с соляной кислотой кишечника, они участвуют в расщеплении потреблённых с пищей белков на аминокислоты. Аминокислоты – это базовый строительный материал для синтеза новых белков; в отличие от пищевых белков, они не вызывают иммунной реакции. Однако, если процесс разложения белков на составляющие оказывается незавершённым – то ли из-за обилия белковой пищи, то ли из-за недостаточности ферментов, то через тонкий кишечник в кровь поступают недорасщеплённые молекулы чужеродного белка, рассматриваемые иммунной системой как вторжение патогенов.
Иммунная реакция на них увеличивает воспалительный индекс и способствует развитию целого ряда заболеваний. Проблема усугубляется с возрастом, когда уровень выработки соляной кислоты желудком и протеолитических ферментов поджелудочной железой падает; а также при состоянии, популярно именуемом «синдром дырявого кишечника». Прием добавок соляной кислоты и пищеварительных ферментов может быть хорошей идеей для пожилых людей и для людей с недостаточной секрецией и того, и другого. Однако такое решение нужно согласовать со своим лечащим врачом.
Протеолитические ферменты – как вырабатываемые в организме, так и принятые внутрь, попадают в двенадцатиперстную кишку. Если это происходит во время приёма пищи, то они первым делом участвуют в переваривании пищевых белков. И только их избыток (если таковой появляется) всасывается в кровь, чтобы затем вновь попасть в поджелудочную железу, завершив свой кругооборот. Если же ферменты принимаются натощак, то они всасываются в кровь в значительном объёме, поскольку расходоваться им не на что.
После попадания в общий кровоток, активность протеолитических ферментов ограничивается особыми факторами в крови и в других жидкостях организма таким образом, чтобы они не повреждали белки самого организма. Однако они сохраняют способность растворять нефункциональные структуры. Циркулируя по всему телу, ферменты расщепляют защитный белковый слой мигрирующих опухолевых клеток, разоблачая их для распознания и атаки иммунными клетками. Благодаря этому, снижается угроза метастазирования – главной причины смерти при раке.
Растворяя тромбообразующий фибрин, протеолитические ферменты также улучшают текучесть крови. Они способны также снижать уровень воспалительных молекул, таких как фактор некроза опухоли (TNF), C-реактивный белок (CRP) и циркулирующий иммунный комплекс (CIC).
Активность протеолитических ферментов зависит от состояния раствора: в щелочной среде с высоким содержанием кислорода они действуют намного эффективнее. И если мы хотим с их помощью бороться против злокачественной опухоли, то комбинация ферментов с кислородонасыщением и защелачиванием опухоли будет более успешной, чем их использование в одиночку.
Наиболее сильными протеолитическими ферментами, оказывающими противо
• Комплекс сильных ферментов (КСФ) – комплекс, содержащий ферменты (панкреатин, бромелаин, папаин, трипсин, липазу, амилазу, протеазу, лактазу, мальтазу, сахаразу, пепсин, хемотрипсин) и ряд вспомогательных веществ, включая антиоксиданты, пробиотики и пребиотики. Дозировка: 1-2 капсулы дважды в день.
• Вобензим (Wobenzym N) – комплекс, содержащий ферменты панкреатин, бромелаин, папаин, трипсин, химотрипсин и рутин. Дозировка: 2-3 таблетки дважды в день. Аналоги: Megazime Forte (комбинация трипсина, химотрипсина, бромелаина и цинка), Wobe-Mugos (комбинация трипсина, химотрипсина и папаина), Swanson Ultra n-Zimes.
Бигуаниды снижают уровень глюкозы и инсулина в крови и повышают чувствительность клеток к инсулину, подавляют синтез белков в раковых клетках за счёт снижения аэробного производства энергии в митохондриях, снижают воспалительный потенциал и значительно улучшают микробный профиль кишечника.
• Метформин. Так же, как и аспирин, метформин имеет растительное происхождение. Метформин и другие бигуаниды избирательно подавляют стволовые раковые клетки, предотвращают трансформацию стволовых клеток в раковые
*,
снижают избыточную экспрессию онкопротеина HER2
*.
Бигуаниды значительно усиливают действие химиотерапевтических препаратов
*
(27,5 % против 6 % полной регрессии
*),
а также действие моноклональных антител против стволовых раковых клеток
*.
Длительный приём умеренных доз метформина, начиная со среднего возраста, повышает чувствительность клеток к инсулину, снижает уровни холестерина и в целом улучшает физическую работоспособность, снижает симптоматику старения и увеличивает продолжительность жизни у мышей
*.
В то время как приём тамоксифена у пациенток в менопаузе способен привести к 7-кратному снижению чувствительности к инсулину и повышению риска сахарного диабета II типа
*,
метформин помогает снизить у них риск метаболического синдрома.
Метформин подавляет пролиферацию злокачественных клеток в условиях гипоксии, характерной для опухолей, не оказывая при этом влияния на жизнеспособность незлокачественных клеток
*.
Метформин также сдерживает пролиферацию раковых клеток в присутствии глюкозы, но вызывает их гибель при удалении глюкозы
*.
Из последнего наблюдения можно сделать вывод, что метформин усиливает зависимость раковых клеток от глюкозы, и что одновременное применение метформина с ограничением поставок глюкозы может быть удачным вариантом лечения.
Дозировка при симптомах диабета составляет в среднем 1'000 мг/сут. Дозировка при лечении рака в послетерапийный период – 500 мг/сут, а в терапийный период – 1'500 мг/сут.
Бисфосфонаты применяются при разрушении костной ткани, в том числе из-за метастазирования и/или из-за приёма ингибиторов ароматазы.
При раке молочной железы кости поражаются метастазированием чаще всего (более 30 % случаев). Непродолжительный приём бисфосфонатов снижает риск переломов костей на 30–50 %. Бисфосфонаты не только сдерживают метастазирование в кость. Они могут также заметно снизить частоту рецидивов и улучшить общую выживаемость пациентов, особенно в постменопаузе. Поэтому бисфосфонаты могут быть использованы как вспомогательная часть клинической практики *.
Несколько исследований сообщили о снижении риска заболеваемости раком молочной железы на 15 %, а также снижении риска инвазивного рака на 30 % у пользователей бисфосфонатов *. Вместе с тем, бифосфонаты снижают уровень витамина D в крови, и для ослабления этого побочного эффекта рекомендуется комбинирование бисфосфонатов с витамином D * *.
• Золедроновая кислота (золедронат) – лучший на сегодня выбор из предлагаемых бисфосфонатов, однако требует инфузионного введения 4 мг каждые 6 месяцев, и к тому же имеет ряд негативных побочных эффектов.
• Ризедронат (35 мг один раз в неделю), принимаемый в течение года, успешно сдерживал потерю костной массы и плотность кости у женщин, получавших химиотерапию *.
Кроме бисфосфонатов, к защите костей от истощения эстрогена можно привлекать натуральные средства. Так, комбинация экстрактов граната и виноградных косточек вызывает экспрессию генов, связанных с уменьшением резорбции кости и противодействует разрушению кости, а комбинация экстрактов кверцетина и солодки вызывает экспрессию генов, которые уменьшают активность остеокластов и способствуют росту костей. Обе эти комбинации с небольшими перерывами можно чередовать, поскольку одновременное применение всех четырёх растительных компонентов нивелирует целевые эффекты *.
Гормоны.
• Мелатонин («гормон сна») имеет чрезвычайно важное значение для долголетия, иммунитета и профилактики рака, особенно гормонозависимого – груди и простаты. Мелатонин подавляет как иницирование, так и развитие и метастазирование рака, проявляя широчайший спектр противораковой деятельности. Принимаемый на постоянной основе, он уменьшает у пациентов заболеваемость и размеры первичных опухолей молочной железы *. Принимаемый во время химиотерапии, он снижает токсичность химиопрепаратов без уменьшения их терапевтического действия, а также ослабляет первичную и/или вторичную (выработанную) лекарственную устойчивость опухоли *.
Мелатонин – эндогенное вещество, поэтому он не вызывает привыкания, и не имеет токсичности и противопоказаний. Поскольку это светочувствительная молекула, уровень мелатонина снижается из-за продления светового периода суток благодаря искусственному освещению, что способствует росту раковых заболеваний *. И наоборот, сокращение светового периода играет против риска рака. Замечено, что рак груди встречается вдвое реже у женщин с полной потерей восприятия света, чем у женщин со слабым восприятием света *. Производство мелатонина, как и большинства других гормонов, падает с возрастом, что делает разумным приём экзогенного мелатонина в старшем возрасте независимо от всяких условий.
Дозировка: обычно 0,3-3 мг вечером строго перед сном. В любом случае, дозировка не должна превышать 20 мг/сут. Обычно начинают с самых малых доз, и плавно наращивают их до достижения требуемого эффекта. Рекомендуется рассасывать таблетку мелатонина под языком вместо проглатывания. Время приёма мелатонина должно совпадать со временем естественного подъёма его уровня в соответствии с суточным ритмом. Приём мелатонина утром вместо вечера может иметь обратный эффект, стимулируя рост опухоли *.
Помимо введения экзогенного мелатонина, следует принимать меры по предупреждению разрушения эндогенного мелатонина, вызываемого искусственным удлинением светового периода. Поскольку о световом периоде дня фоторецепторам сетчатки глаза сигнализирует синяя часть спектра *, то её можно различными способами удалять из искуственного освещения. Для этого в вечернее время можно использовать лампы тёплого свечения, янтарные цвета для оформления помещения, цветовую коррекцию визуальных экранов и, наконец, очки, фильтрующие синий цвет. Существуют даже приложения, убирающие синюю составляющую с экранов электронных устройств в вечернее время.
Сочетание этих приёмов может улучшить качество сна за счёт ослабления разрушения мелатонина *. И наоборот, голубой оттенок искусственного освещения можно активировать с утра. При этом спать нужно в полной темноте, без дежурного освещения и ночников, сколь слабыми бы они ни были. Даже слабый уличный свет, пробивающийся ночью в спальню, может увеличивать риск рака молочной железы за счёт снижения уровня мелатонина *. Антагонистом мелатонина является кортизол, поэтому перед отходом ко сну нужно постараться снизить его уровень.
Дополнительные добавки с S-ацетил-глутатионом, альфа-липоевой кислотой, расторопшей, селеном и N-ацетил-цистеином могут быть полезны для людей с мутациями BRCA или семейной историей рака.
Изложенный выше подробный обзор добавок может вызвать некоторую растерянность – какие из них, и в каком количестве следует всё-таки применять? Краткий ответ будет таким:
• Приём проверенных добавок, в которых организм ощущает недостаток, в отличие от приёма рецептурных лекарств, будет, скорее всего, безопасным. В то время, как приём прописанных лекарств является одной из ведущих причин смерти в мире *, сообщалось лишь о единичных случаях смерти вследствие неправильного приёма добавок.
• Никакие добавки не являются лекарством от рака. Они могут быть принципиально необходимым, но не могут быть достаточным условием нормализации здоровья. Как следует из их названия, добавки могут лишь дополнять основное лечение или профилактику.
• Мы едим, чтобы восполнить расход энергии, и пьём воду, когда её запасы в организме иссякают. Но мы не едим и не пьём многократно больше требуемого. Аналогично, необходимость приёма витаминов, микроэлементов и минералов, а также дозировка той или иной добавки может быть вызвана исключительно их недостаточным потреблением и/или низким уровнем в организме, что можно выяснить исключительно путём соответствующих лабораторных анализов. Если никаких дефицитов нет, никакие добавки не требуются.
• Приём добавок прекращается сразу же после нормализации показателей, вызвавших необходимость их приёма.
• Существует лишь несколько добавок, приём которых может быть оправдан независимо от текущего состояния здоровья. Они обусловлены либо нашим образом жизни, либо возрастом, либо генетическими аномалиями, и рассмотрены отдельно для каждой возрастной группы †.
• Все научно рекомендуемые дозировки добавок основаны на данных, средних по всей популяции, которые не учитывают индивидуальность каждого организма и исходного уровня того или иного витамина и/или элемента. Кроме того, они, вероятно, слишком занижены, и могут лишь предупреждать явные признаки дефицита, но не всегда обеспечивать действительную потребность в них.
• В любом случае, экзогенные добавки, за единичными исключениями, принимаются на протяжении до 3 месяцев (максимум до полугода), после чего следует сделать перерыв †. Более длительное потребление экзогенных веществ вызывает потерю их эффективности.
• Микрофлора кишечника синтезирует большое количество витаминов, что может значительно скорректировать дозировку витамина К и витаминов группы В (тиамин, рибофлавин, никотиновую кислоту, пантотеновую кислоту, пиридоксин, биотин, фолаты, кобаламин *).
• Одновременный приём нескольких добавок теоретически может в отдельных случаях вызвать непредсказуемые последствия, вызванные проблемой их сочетаемости. Кроме того, комбинация добавок, действующих в противоположных направлениях, безусловно, снизит их эффективность.