Стратегия здоровья.
Гормональный баланс имеет особое значение для женского здоровья, включая здоровье женской груди. Гормоны регулируют жизненно важные биологические функции организма, включая сердечно-сосудистую, дыхательную, пищеварительную, репродуктивную, церебральную и иммунную системы *.
Гормоны являются чрезвычайно сильными модуляторами биохимических процессов. Достаточно крайне низких концентраций того или иного гормона, чтобы он производил свой эффект. Однако они нужны лишь на какое-то определённое время. Действие одних гормонов в текущий момент может быть скомпенсировано действием других гормонов в будущем. Таким образом, уровень гормонов постоянно меняется, в зависимости от различных обстоятельств. Основное противостояние половых гормонов происходит между эстрогенами и андрогенами, в частности, между эстрадиолом и прогестероном.
Каждый гормон играет свою партию, подобно музыканту в оркестре, и в результате их общей слаженой работы мы получаем симфонию нормально функционирующего организма. Гормоны могут управлять многими физиологическими и даже психологическими явлениями. Однако существует много причин, по которым гармоничное звучание гормонов может быть нарушено, результатом чего могут быть самые разнообразные заболевания. Некоторые подтипы рака являются гормоночувствительными. Не доказано, что эстрогены являются причиной появления рака, однако они могут являться промотерами этого процесса, и действовать совместно как с причинами, так и с остальными промотерами.
Хотя повышенный уровень эстрогена связывают с повышением риска рака груди, задачей гормональной модуляции является не безусловное снижение уровня эстрогена, а приведение в равновесное состояние уровня антагонистических гормонов. Если хронический дисбаланс в пользу эстрогена не подтверждается соответствующими анализами, то необходимости в гормоальной модуляции нет. Но, к сожалению, это не всегда так.
Эстроген – общее название группы стероидных гормонов, которые у женщин производятся, в основном, в яичниках, вплоть до наступления менопаузы. Некоторая часть эстрогена вырабатывается надпочечниками, и ещё меньшая – в жировой ткани и печени *. Эстроген также может синтезироваться в самой ткани молочной железы из других стероидных гормонов *; этот путь становится всё более активным в постменопаузе. У женщин эстроген является ключевым фактором полового созревания, менструального цикла, и даже поведения.
Эстетрол (estetrol, E4) – самый слабый и, таким образом, наименее опасный эстроген. Его уровень становится заметно высоким только во время беременности, потому что он вырабатывается плодом. Считается, что беременность в краткосрочной перспективе повышает риск рака молочной железы у женщин. Тем не менее, этот риск может быть связан скорее с увеличение концентрации эстрадиола во время беременности, в то время как эстетрол может играть защитную роль, оттесняя от клеточных рецепторов более сильные эстрогены.
Эстриол (estriol, E3) составляет примерно 80-90 % общего количества женского эстрогена. Это биологически слабый эстроген. Дисбаланс эстрогенов, результатом которого становится снижение эстриола, приводит не только к ожирению *, но и к доминированию более сильных эстрогенов.
Эстрон (estrone, E1) составляет примерно 5-10 % общего количества эстрогена. Он проявляет более сильное связывание с рецептором эстрогена, чем эстриол, хотя и более слабое, чем эстрадиол.
Эстрадиол (estradiol, E2) также составляет примерно 5-10 % общего количества эстрогена. Это самый сильный и опасный эстроген, потому что он в 12 раз активнее, чем эстрон, и в 80 раз активнее, чем эстриол. Избыточная масса жира в теле, а также избыток жира в пище способствует увеличению уровней эстрона и эстрадиола в организме. Такое состояние чрезвычайно широко распространено у пременопаузных женщин в промышленно развитых странах, и значительно увеличивает риск заболеваемости раком молочной железы.
Поскольку большинство опухолей молочной железы являются гормоно-положительными, коррекция гормонального баланса может внести решающий вклад в снижение числа случаев болезни.
Уровень и продолжительность воздействия эстрогена являются ключевыми факторами, которые способствуют развитию рака, или предотвращают его. Давно замечена связь между повышенным воздействием эстрадиола у женщин в течение жизни (раннее менархе, отсроченная менопауза, количество доношенных беременностей) и повышенным риском развития рака молочной железы. Клетки молочной железы являются очень эстрогенными, а эстроген является условным гормоном роста в организме, поскольку он стимулирует деление эстроген-чувствительных клеток *.
Эстрогены и их хиноновые метаболиты вызывают рак молочной железы посредством двухуровневого механизма, в котором они: а) стимулируют рост и деление клеток * * и б) производят окислительный стресс и повреждение ДНК * *, увеличивая скорость генетических мутаций *. Длительное воздействие эстрогена, несбалансированного андрогеном, вызывает также трансформацию фенотипов и геномные изменения в эпителиальных клетках молочной железы, связанные с высокой пролиферативностью, инвазивностью и миграцией * *.
Эстрогены связываются с двумя основными рецепторами эстрогенов клеток молочной железы – ERα и ERβ. Связывание эстрогена с рецептором вызывает транскрипцию большого количества связанных с ним генов *. В ткани молочной железы экспрессируются оба подтипа рецептора эстрогена, но эстроген-зависимая клеточная пролиферация и карциногенез молочной железы связаны, в основном, с сигнализацией ERα, в то время как ERβ может подавлять ER-зависимую транскрипцию генов. Однако роль ERβ в раке молочной железы, по-видимому, зависит от присутствия или отсутствия ERα, поскольку было показано, что ERβ стимулирует пролиферацию клеток при ERα-негативном раке молочной железы клетки *.
Прогестерон – женский стероидный гормон, уравновешивающий пролиферативную деятельность эстрадиола. Их соотношение у женщины зрелого возраста не постоянно; оно колеблется в течение менструального цикла, склоняясь то в одну, то в другую сторону. Эстрадиол доминирует в первую (овуляторную) фазу цикла, стимулируя рост клеток, а прогестерон доминирует во вторую (лютеиновую) фазу цикла, стимулируя апоптоз и дифференцировку клеток.
Оба эти гормона необходимы для развития молочной железы, и активно способствуют делению клеток во время формирования молочной железы, а также во время беременности. Основным стимулирующим фактором роста клеток считается эстроген, однако на самом деле для пролиферации требуется комбинация обоих этих антагонистических гормонов *. В то время, как эстроген стимулирует рост обычных эстроген-чувствительных клеток молочной железы, прогестерон может стимулировать рост её стволовых клеток *.
Андроген – общее название группы стероидных гормонов, производимых у мужчин семенниками, а у женщин – яичниками, а также корой надпочечников.
Тестостерон – основной андроген у женщин. Это анаболический гормон, являющийся антагонистом эстрогена. Хотя широко бытует мнение, что эстроген – это женский гормон, а андроген – мужской, баланс между андрогенами и эстрогенами важен как для мужчин, так и для женщин. Нарушение гормонального баланса ассоциируется уже с начальными стадиями опухолевой болезни, что предполагает между ними причинно-следственную связь.
Гормональный дисбаланс наблюдается также и при доброкачественных опухолях. Анализ гормональных профилей пациентов с доброкачественными болезнями в пременопаузе и постменопаузе, обнаружило у них, в среднем, соответственно, увеличение: эстрадиола – на 22,4 % и 32,0 %; эстрона – на 26,2 % и 30,9 %; тестостерона – на 19,5 % и 16,5 % по сравнению с профилями здоровых женщин *. При этом скорость пролиферации прямо зависит от уровня этих гормонов в циркулирующей крови.
Концентрации эстрогена и андрогена сильно различаются в тканях доброкачественных и злокачественных опухолей и в циркулирующей крови. В постменопаузе (но не в пременопаузе) в ткани злокачественной опухоли молочной железы значительно выше уровни эстрадиола (на 56 %), андростендиона (на 33 %) и тестостерона (на 33 %). А уровни дегидроэпиандростерона и андростендиола выше в доброкачественных, чем в раковых тканях (соответственно, в 6 раз и в 2 раза). Причём концентрация андрогенов выше в плазме, чем в тканях, что предполагает их активную трансформацию в эстрогены жировой тканью молочной железы *. Частично, благодаря этому концентрация эстрадиола в опухоли молочной железы у женщин в постменопаузе может быть в 10-20 раз больше, чем в плазме * *.
У женщин в пременопаузе проспективные исследования показывают прямую связь уровня циркулирующих эстрогенов с риском развития рака молочной железы * *. Причём, с этим риском достоверно связана высокая концентрация эстрадиола в фолликулярную, но не лютеиновую фазу менструального цикла *.
У женщин в постменопаузе риск выше * в группах с более высокими концентрациями общего эстрадиола, свободного эстрадиола, эстрона, и их предшественников – андростендиона, дегидроэпиандростерона и тестостерона * *. В то же время более высокие уровни глобулина, связывающего половые гормоны (SHBG), ассоциируются с более низким риском. Любое действие, которое приводит к снижению уровней циркуляции эстрогенов, особенно эстрадиола, потенциально снижает риск развития рака груди *.
Снижение эстрогенной нагрузки может достигаться такими путями:
1) удаление разрушителей гормональной системы;
2) улучшение процесса вывода метаболитов эстрогена из организма;
3) улучшение соотношения здоровых эстрогенных метаболитов к канцерогенным метаболитам;
4) снижение производства эстрадиола;
5) повышение уровня прогестерона;
6) «заглушение» рецептора эстрогена;
7) управление рецепторами щитовидной железы и рецепторами других половых гормонов.
Пункты 1, 2 и 3 являются профилактическими; однако их значение не уменьшается и во время гормонотерапии. Пункты 4 и 5 могут быть полезны при высоком уровне эстрадиола, однако их применение должно строго контролироваться. Остальные пункты являются чисто терапевтическими, и являются крайними мерами, которые не должны применяться пациентами самостоятельно.
Устранение внешних гормональных возмущений является первым шагом гормональной нормализации *. Канцерогенное действие могут оказывать: натуральные или биоидентичные эстрогены, главным образом, эстрадиол (в то время как эстриол может оказывать защитный эффект); метаболиты эстрогена, такие как 4-OH-E2, 16α-OH-E2 и другие; эстрогеноподобные препараты, такие как пероральные контрацептивы и гормональные препараты; ксеноэстрогены (гербициды, пестициды, фунгициды, некоторые пластмассы, в том числе используемые как упаковка); многие химические продукты (хладагенты, промышленные растворители, побочные продукты отбеливателей, полициклические ароматические углеводороды, и т.п.), токсичные металлы (медь, кобальт, никель, ртуть, свинец, олово и хром *); гормоны, используемые для откорма животных и стимулирования производства молока, попадающие в готовый продукт питания. Одни только пероральные контрацептивы или заместительная гормонотерапия могут до 25 % увеличивать риск рака молочной железы *.
В 1996 году Европейская комиссия включила ксеноэстрогены в список приоритетных факторов риска. Загрязнение воздуха, воды и пищевых продуктов может происходить по причине широкого использования ксеноэстрогенов в сельском хозяйстве и производстве пищевых продуктов *, а также за счёт миграции фталатов в пищу из пластиковой упаковки. Загрязнение кожи фталатами происходит при использовании дезодорантов, а также косметических кремов, которые содержат фталаты и парабены. Можно самостоятельно оценить используемые дома средства по уходу за кожей и средствами бытовой химии на их ксеноэстрогенную опасность при помощи независимого интернет-ресурса EWG *.
Помимо максимально возможного удаления всех вышеперечисленных веществ из своей жизни, можно дополнительно использовать детоксикаторы для их удаления из организма. Многие разрушители гормональной системы жирорастворимы, и способны накапливаться в жировых отложениях, а молочная железа в значительной степени состоит из жира. Например, концентрация бисфенола-А в тканях у больных раком значительно выше, чем у пациентов без рака (4,2 против 1,8 нг/г ткани) *. Аналогично, в тканях груди накапливаются парабены *, и того же самого можно ожидать от прочих жирорастворимых веществ.
Значительный вклад в риск развития рака молочной железы, благодаря большому количеству содержащихся в них гормонов роста, вносят молоко животных и производимые из него продукты, включая сыры и даже йогурты *. Причём тепловая и любая другая обработка молока не приводит к разрушению инсулиноподобного фактора роста *. К сожалению, вред молока для здоровья взрослого человека до сих пор недооценён в массовом сознании.
Потребление акоголя даже в малых дозах отрицательно влияют на здоровье молочной железы. Например, всего 15 г/сут чистого спирта (бокал вина) увеличивает концентрацию сульфата эстрона в сыворотке на 7,5 % *, ухудшая тем самым соотношение эстроген:андроген. Следует также полностью исключить потребление сахара и сладких продуктов и напитков.
Регуляторы уровня инсулина. Хотя существуют медикаментозные методы снижения инсулина, самый естественный метод держать инсулин на невысоком уровне – это снижение общего объёма пищи и потребление пищевых продуктов с низкой гликемической нагрузкой вместо продуктов с высокой гликемической нагрузкой. В качестве дополнения, при необходимости, может применяться метформин.
Регуляторы уровня эстрогена. Снижение общего уровня эстрогенов, особенно эстрадиола, может уменьшить риск рака в эстроген-чувствительных тканях.
Ввиду того, что эстрогены играют защитную роль для нейротрансмиттеров, высказываются обоснованные опасения, что обеднение организма эстрогенами может негативно повлиять на познавательные функции человека; однако это предположение всё ещё является дискуссионным *.
Избыток эстрогена связывается (глюкоронидируется) печенью и передаётся через жёлчный проток в кишечник для дальнейшего удаления. В кишечнике этот ставший неактивным эстроген может быть снова освобождён и возвращён в кровь, повышая риск рака. Этот процесс сильно зависит от состава пищевой массы и, соответственно, от состава кишечных бактерий. Клетчатка и кишечные бактерии, питающиеся нею, замедляют и затрудняют всасывание эстрогена обратно в кровоток. Благодаря ним избыточный эстроген выводится из организма. В противоположность этому, мясо и бактерии, питающиеся ним, могут способствовать процессу высвобождения и активация эстрогена.
Помимо увеличения риска рака, высокий уровень эстрогена может вызывать умеренную или сильную боль во время месячных. Эстроген стимулирует рост гормоночувствительных клеток матки, чтобы подготовить её к приёму яйцеклетки. Чем больше эстрогена в фолликулярную фазу, тем больше утолщается слизистая оболочка матки. Соответственно, тем больше этой клеточной массы распадается в конце цикла, в лютеиновую фазу, и тем больше выделяется провоспалительных простагладинов, которые вызывают спазмы и боль.
Некоторые немедикаментозные средства могут способствовать снижению общего уровня эстрогена.
• Лигнаны (из льняного семени) и клетчатка (из отрубей зерновых культур – пшеницы, ржи, ячменя, овса) – это пребиотики, которые создают благоприятные условия для процветания таких кишечных бактерий, как Lactobacillus acidophilus. Этот вид бактерий обеспечивает низкую активность β-глюкуронидазы и β-глюкозидазы. Снижение активности обоих этих ферментов способствует улучшению процесса вывода эстрогенов через кишечник; повышению концентрации глобулинов, связывающих половые гормоны (ГСПГ, SHBG); снижению активности ароматазы и избыточной экспрессии онкогена HER2; и в целом способствует повышению срока выживаемости пациентов *.
Женщины с высоким потреблением лигнанов, по сравнению с женщинами с низким их потреблением, показывают на 44 % ниже риск развития рака молочной железы
*
*
*.
Постменопаузные женщины с раком молочной железы с наивысшим потреблением лигнанов против женщин с наинизшим их потреблением показывают снижение риска смертности от всех причин на 51 %, и снижение смертности от рака молочной железы на 71 %
*.
Дозировка: 25-30 г/сут
*
мелкосмолотого льняного семени.
• Льняное масло содержит в связанном виде жирные кислоты ω-3, которые снижают чрезмерные уровни холестерина и эстрогена в крови, особенно эстрадиола (Е2) и эстрона (Е1), смещая баланс эстрогенов в пользу более слабого эстрогена – эстриола (Е3). Льняное масло способствует выведению из организма более твёрдых жиров и диоксина.
Каждые дополнительно принимаемые 0,1 г/сут ω-3 снижают риск развития рака молочной железы на 5 %
*.
Пациенты с метастазирующим раком молочной железы во время химиотерапии на основе антрациклинов, могут более чем вдвое увеличить срок выживаемости за счёт потребления 1,8 г/сут докозагексаеновой кислоты (DHA)
*.
Кроме того, жирные кислоты ω-3 (4 г/сут в течение 3 месяцев) могут в пост-менопаузе компенсировать негативные эффекты ингибиторов ароматазы в отношении костной ткани
*.
Дозировка: 0,5-1 ст.л./сут.
Другие растительные источники, чуть менее богатые жирными кислотами ω-3 – это масло семян Рыжея (Camelina sativa) и Чиа (Salvia hispanica). У всех этих растений соотношение ω-3:ω-6 в масле составляет больше единицы, в отличие от остальных растительных масел.
В присутствии кислорода, особенно на свету, жирные кислоты ω-3 быстро окисляются, образуя канцерогенные соединения. Поэтому растительные масла нужно брать свежие из холодильника продавца и хранить в домашнем холодильнике на протяжении не более месяца.
• Рыбный жир – альтернативный источник жирных кислот ω-3. В отличие от рыбьего жира, добываемого из печени трески, рыбный жир содержится в тканях рыб.
Если из льняного масла EPA и DHA получаются в результате метаболирования альфа-линоленовой кислоты (ALA), то рыбном жире они содержатся в уже готовом виде. Это особенно важно для людей, чьи генетические особенности не позволяют эффективно синтезировать эти жирные кислоты из растительного сырья. А таковых среди европейского населения достаточно много.
Кроме того, эффективность метаболизма растительных ω-3 очень низкая. Преобразование ALA в EPA и EPA в DHA оценивается в диапазоне от 5-10 %, и 2-5 % соответственно *. Таким образом, рыбные ω-3 обладают большей эффективностью по сравнению с растительными ω-3 *. Однако, для длительного хранения рыбный жир рекомендуется приобретать в герметичных желатиновых капсулах из-за его высокой окисляемости. Дозировка: до 1 мл/сут *.
• D-глюкарат содержится в грейпфруте, яблоках, апельсинах, брокколи и брюссельской капусте. Он подавляет активность β-глюкуронидазы; способствует безопасному метаболированию, связыванию и удалению эстрогенов из крови и превращению их в менее токсичную форму *. D-глюкарат снижает системное воспаление и значительно тормозит у животных рост привитой опухоли молочной железы * *. Сочетание глюкарата с низкими дозами ретиноидов в опытах на животных действует синергично *. Дозировка D-глюкарат кальция: 1'200-3'000 мг/сут *.
• Соевое молоко (400 мл/сут, ~ 109 мг/сут изофлавонов) в течение 3 месяцев снижало у японских женщин уровни эстрона и эстрадиола на 23 % и 27 % соответственно *. Аналогичное снижение уровня эстрогена было отмечено у мужчин, при этом влияния на андрогены не наблюдалось *.
У американских пременопаузных женщин суточное потребление 1 литра соевого молока (~ 200 мг изофлавонов) в течение месяца снижает уровень эстрадиола в фолликулярной фазе на 31 %, а в лютеиновой фазе – на 49 %. При этом уровень прогестерона в лютеиновой фазе снижался лишь на 35 % *. Интересно, что даже после прекращения приёма соевого молока уровень эстрогена оставался низким в течение 2-3 месячных циклов.
Потребление сои и связанных с нею соевых изофлавонов может благоприятно влиять на менструальный цикл у молодых женщин (20-30 лет). В одном из исследований потребление 60 г/сут соевого белка (45 мг/сут изофлавонов) значительно расширяло менструальный цикл за счёт удлинения фолликулярной фазы *. Наивысший уровень роста эпителиальных клеток молочной железы происходит во время лютеиновой фазы, поэтому продление фолликулярной фазы цикла сокращает продолжительность лютеиновой, и тем самым может снизить риск гормоно-чувствительных типов рака. Тем не менее, не все исследования демонстрировали такие высокие успехи.
• Йод, похоже, может снижать чувствительность клеток молочной железы к эстрадиолу *.
Изменение образа жизни может оказать более сильное влияние на снижение уровня эстрогена, чем потребление различных добавок, не оказывая при этом никаких негативных последствий. Причём это касается женщин любого возраста и любого статуса менопаузы.
Умеренное снижение потребления жира в период полового созревания связано с положительными изменениями концентраций и соотношений половых гормонов; например, уровень эстрогенов может быть снижен на 30 % *. Диета с очень низким содержанием жиров (10-12 % общей калорийности пищи) и высоким содержанием клетчатки (25 г/сут) уже в течение 2 месяцев значительно снижает у здоровых женщин уровень эстрадиола и эстрона, никак не влияя на овуляцию * * *. Однако при увеличении содержания жиров в пище выше 20 % от общей калорийности этот эффект ослабляется *.
Снижение вклада жира в калорийность питания с 40 % до 20 % также значительно снижает концентрацию гормонов в плазме здоровых женщин в постменопаузе *. Уже за 14 недель после сокращения потребления жира с 68,5 г/сут до 29,5 г/сут, уровень эстрадиола в плазме падает на 17 % *.
В одном из манипулятивных исследований, женщины в постменопаузе, как под гормонозаместительной терапией, так и без неё, были переведены на 3-недельную диету с низким содержанием жиров (10 % общих калорий) и высоким содержанием клетчатки (65-70 г/сут) в сочетании с физическими упражнениями. В результате уровни SHBG (глобулина, связывающего половые гормоны) повысились на четверть, уровни инсулина снизились на треть, также значительно снизились индекс массы тела и общий холестерин *. Подобный режим значительно снижает уровень фактора роста IGF-1, и увеличивает уровень белка, связывающего IGF-1. Кровь, отобранная у женщин после 2 недель эксперимента, in vitro на 7-18 % снижала рост и на 20-30 % увеличивала апоптоз клеток различных линий рака молочной железы *.
Вегетарианцы, по сравнению со всеядными, показывают значительно более низкое содержание в плазме эстрадиола, свободного эстрадиола, свободного тестостерона, и значительно более высокое содержание SHBG *. Удаление из своего рациона любых видов алкоголя снижает уровень циркулирующих стероидных гормонов, особенно эстрогенов *. Снижение жировой массы тела тоже будет играть в сторону снижения эстрогена, потому что жировая ткань является фабрикой эстрогена.
Снижение активности эстрогена может произойти несколькими путями. Например, трансформацией более активного эстрогена (эстрадиола) в менее активный (эстрон). Этого можно добиться, с одной стороны, подавлением дегидрогеназы HSD17β1 специфическими ингибиторами *, и с другой стороны – активации дегидрогеназы HSD17β2, например, при помощи ретиноевой кислоты *.
Некоторые флавоноиды оказывают in vitro ингибирующее действие на активность 17HSDβ1 – генистеин из сои, лигнаны из льна *, госсипол из хлопкового масла *, генкванин из семян ольхи, диосметин из вики кавказской, скутеларин из корня шлемника, физетин *, хризин, кемпферол *. Сдвиг соотношения между Е1, Е2 и Е3 в пользу Е1, а особенно в пользу Е2, называемый «дисбаланс эстрогенов», очень распространён во всём мире. И любые манипуляции, направленные на его исправление, могли бы снизить эстрогенную нагрузку.
Ещё более снижает активность эстрогена перевод его в неактивное состояние путём химических реакций глюкоронидации и сульфатации, а также связывание его со специальными глобулинами, которые так и называются – глобулины, связывающие половые гормоны (SHBG). Удвоение концентрации в сыворотке этих глобулинов ассоциируются с 22 %-ным снижением риска рака *.
Ингибиторы стероидсульфатазы блокируют восстановление связанного эстрогена в его активную форму. В настоящее время разработано несколько специфических необратимых ингибиторов стероидсульфатазы.
Диета без ограничений в калорийности, но с низким содержанием животных жиров и рафинированных углеводов, богатая продуктами с низким гликемическим индексом, мононенасыщенными и ω-3 полиненасыщенными жирными кислотами и фитоэстрогенами, может благоприятно изменить гормональный профиль женщин в постменопаузе *. В группе вмешательства, по сравнению с контрольной группой, уровень глобулина, связывающего половые гормоны, значительно увеличивался, а уровень тестостерона в сыворотке снижался.
Переход на традиционную «средиземноморскую» диету (от преобладающего потребления животных жиров и белков к преобладающему потреблению растительных жиров и белков) в течение 6 месяцев значительно (более 40 %) снижает уровень эстрогена *. Бо́льшая часть этого эффекта была основана на заметном снижении количества конкретных метаболитов эстрогенов, включая гидрокси- и кето-производные эстрадиола или эстрона.
Ингибиторы активности ароматазы. Концентрацию эстрогена можно снизить, подавляя его синтез. Ароматаза – фермент, который участвует в преобразовании андрогенов в эстрогены. Усиление активности ароматазы вносит значительный вклад в увеличение количества эстрогенов и увеличивает дисбаланс между андрогеном и эстрогеном, тем самым стимулируя рост опухоли.
К известным факторам, повышающим активность ароматазы, относятся возраст, воспаление, ожирение, алкоголь, инсулин и гонадотропины. Исследованиями установлено также наличие связки ожирение-воспаление, которая стимулирует активность ароматазы * в ткани молочной железы, и которая, вероятно, связана с повышенным риском гормоночувствительных подтипов рака молочной железы.
Подавление периферийной и внутритканевой активности * эстрогена при помощи ингибиторов ароматазы способствует снижению риска рака и его рецидива *. По терапевтическому эффекту сдерживания роста опухоли, ингибиторы ароматазы сопоставимы с удалением яичников, вырабатывающих половые гормоны *.
В настоящее время в клиническом применении находятся два основных класса ингибиторов ароматазы. Стероидные препараты I типа включают форместан и экземестан; они являются аналогом андрогенного субстрата, который связывается с ферментом конкурентно, но необратимо. Нестероидные ингибиторы II типа, такие как анастрозол и летрозол, связываются с ферментом обратимо и обеспечивают исключительную эффективность и специфичность против ароматазы.
Анастрозол * и экземестан * более, чем вдвое снижают заболеваемость ER+ раком молочной железы. Относительно экземестана не сообщалось о побочных эффектах, таких, как снижение познавательных функций, которые обычно связаны с лечением тамоксифеном. Разрабатываются другие ингибиторы ароматазы нового поколения с более слабыми негативными побочными эффектами. Норендоксифен, метаболит тамоксифена, действует как сильный конкурентный ингибитор ароматазы (IC50 = 90 нМ), и также может быть участником его антиэстрогенной деятельности *.
Некоторые нерецептурные ингибиторы ароматазы используются в бодибилдинге.
ATD (androstatrienedione) очень популярен из-за дешевизны и эффективности, однако он может снизить либидо. Метилированный ATD более предпочтителен, поскольку он не токсичен для печени. Дозировка: до 75 мг/сут.
3-OHAT так же эффективен, как ATD, и работает быстрее него.
Форместан (formestane), он же 4-OHAD, может быть использован трансдермально, что потребует не только меньшей дозы, но и менее частого дозирования.
6-OXO, необратимый ингибитор, также популярен. Потребление 300 мг/сут 6-OXO в течение 8 недель способно увеличить, по сравнению с исходным уровнем, концентрацию свободного тестостерона на 90 %, DHT на 192 %, эстрона на 22 %, и соотношения тестостерона к эстрогену на 53 % *.
К недостаткам синтетических ингибиторов ароматазы, помимо их побочных эффектов, можно отнести способность клеток быстро вырабатывать к ним лекарственную устойчивость *, что вызывает рецидивы заболевания * и повторный рост опухоли после 12-18 месяцев лечения. Для преодоления лекарственной резистентности в качестве возможных кандидатов рассматриваются ингибиторы MEK, Raf, PI3K, mTOR и Akt *. К сожалению, опухоли способны усиливать нетрадиционные пути преобразования половых гормонов, обходя ингибированные традиционные пути *.
Не стоит забывать и о взаимном действии различных рецепторов и гормонов. Блокировка пути преобразования андростендиона в эстрон может способствовать увеличению его преобразования в тестостерон. Поэтому ингибирование ароматазы без одновременного ингибирования альдо-кеторедуктазы способно создавать условия для увеличения нагрузки на андрогенный рецептор. Что при тройном негативном раке молочной железы окажется, скорее всего, контрпродуктивным.
Натуральные ингибиторы ароматазы не могут соперничать в эффективности с синтетическими, однако они не имеют таких сильных побочных эффектов. Тем не менее, как по отдельности, так и в составе комплексов, они могут усиливать действие назначенных врачом ингибиторов ароматазы и, благодаря этому, снижать их дозировку и побочные эффекты. Многие натуральные ингибиторы ароматазы входят в состав пищевых продуктов, что даёт нам определённую возможность влиять на активность ароматазы путём коррекции диеты.
На данный момент по своей способности ингибировать ароматазу было оценено около 300 натуральных продуктов, большинство из которых являются т.н. фитоэстрогенами; однако опубликовано было лишь несколько положительных результатов исследований *.
• Полифенолы.
Флавоноиды, показавшие in vitro наиболее выраженый антиароматазный эффект
*:
хризин (chrisin), содержащийся в листьях Пассифлоры (Passiflora), 500 мг/сут; апигенин (apigenin), содержащийся в корне Шалфея (Salvia officinalis); пренилнарингенин (8-prenylnaringenin), содержащийся в шишках Хмеля (Humulus lupulus); кверцетин (quercetin) из листьев Гинко билоба (Ginkgo biloba);
биоханин (biochanin A) из листьев Клевера красного (Trifolium pratense).
Биоханин проявляет двойное действие: он ингибирует активность ароматазы при низких концентрациях, но проявляет эстрогенность при высоких концентрациях
*.
Биоханин эффективен для уменьшения роста эстрогензависимых опухолей MCF-7 при экв. дозе 1 мг/кг в день
*.
Кемпферол (kaempferol), содержащийся в листьях Гинко билоба (Ginkgo biloba), также известен как ингибитор ароматазы, усиливающий действие тамоксифена
*.
Экстракт растения (500 мг/кг) сильно подавляет активность ароматазы и снижает in vitro и in vivo содержание эстрадиола в раковых клетках ER+-опухолей молочной железы с избыточной экспрессией ароматазы (AROM MCF-7)
*.
Один из аптечных вариантов гинкго – Танакан™ (экстракт листьев). Дозировка: по 40 мг сухого экстракта
*,
или по 1 мл 10 %-ного спиртового экстракта листьев растения трижды в сутки.
В исследовании in vitro на клетках ER+ рака молочной железы (MCF-7) флавоноиды подавляли активность ферментов ароматазы в следующем порядке уменьшения своего эффекта: хризин → нарингенин → генистеин → апигенин → биоханин → кверцетин. Тем не менее, было отмечено, что что эстрогенность этих фитовеществ была более выражена, чем ингибирование ними ароматазы *. Кроме того, общим недостатком флавоноидов является их плохая биодоступность, что выразительно снижает их эффект in vivo.
Халконы. Изоликвиритигенин (8-isoliquiritigenin), содержащийся в корне Cолодки голой (Glycyrrhiza glabra) при концентрации 36 мкМ снижает in vitro экспрессию генов, связанных с ароматазой, подавляя производство эстрогена *. В отличие от многих других ингибиторов ароматазы, которые, в зависимости от концентрации, проявляют двойственный эффект, изоликвиритигенин in vivo не проявляет эстрогенности, и не влияет на вес матки у подопытных мышей *. Дозировка: экв. 800 мг/день *.
Лигнаны, такие как энтеродиол и энтеролактон из семян льна и стильбены, как ресвератрол из виноградной кожуры * также являются натуральными ингибиторами ароматазы.
• Смола мирра (Commiphora myrrha) проявляет in vitro сильный антиароматазный эффект за счёт содержащихся в ней тритерпенов *.
• Грибы – Вёшенка (Pleurotus), Шампиньон (Agaricus bisporus), и некоторые другие, подавляют ароматазную активность * и способны снизить заболеваемость раком молочной железы на 50 %, а в комбинации с зелёным чаем – на 90 % *. Этилацетатный экстракт грибов содержит сопряжённую линолевую кислоту, которая способна блокировать активность ароматазы. Дозировка: 100 г смолотых на блендере и отвареных грибов *.
• Фреш-соки (в порядке снижения антиароматазной эффективности: гранатовый, красный виноградный, клубничный, яблочный, сливовый, грейпфрутовый, персиковый, апельсиновый). Дозировка: 250 мл/сут.
Виноград (Vitis) – экстракт красного вина или виноградных косточек богаты процианидинами и флаваноидами, оказывающими антиароматазный эффект. Красное вино увеличивает уровень свободного тестостерона и снижает уровень SHBG при весьма незначительном снижении уровня эстрадиола
*.
Наиболее полезны вина сортов Мерло
*
*,
Пино Нуар, Каберне, Шардоне
*.
Для снижения отрицательной роли алкоголя, перед употреблением его можно частично выпарить путём непродолжительного нагрева. Дозировка: 100 мг экстракта или 125 мл красного сухого вина в сутки
*.
Гранат (Punica granatum) – ферментированный сок (вино), масло семян и этаноловый экстракт околоплодника. Содержащаяся в гранате эллаговая кислота, эллаготаннины, метаболирующие в эллаговую кислоту, а особенно уролитин (urolithin B), подавляют in vitro рост раковых клеток молочной железы
*,
особенно эстроген-зависимых
*,
и ингибируют ароматазу
*
*.
Красное вино из граната содержит в 3 раза больше антиоксидантов, чем красное вино
*.
• Другие наиболее часто упоминающиеся натуральные ингибиторы ароматазы – бутират натрия, селен, цинк, магний, витамин D
*.
Мелатонин
*
*
также может действовать как ингибитор ароматазы в ER+ клетках (T47D), проявляя активность, сравнимую с летрозолом, но не проявляя побочных эффектов последнего. Дозировка: 20-40 мг/сут
*
*.
Метформин, видимо, тоже может проявлять некоторый антиароматазный эффект, поскольку он активирует AMPK – фермент, ответственный за биосинтез эстрогенов в жировых клетках молочной железы человека
*
*.
Силденафил (Viagra™), тадалафил и варденафил, используемые для лечении эректильной дисфункции, способны достаточно эффективно (до 35 %) подавлять биосинтез эстрогенов
*.
К сожалению, ингибиторы ароматазы, принимаемые внутрь, могут быть эффективны лишь для постменопаузных женщин или для женщин с удалёнными яичниками. Причина в том, что у пременопаузных женщин ингибиторы ароматазы, снижая уровень эстрадиола, стимулируют выделение из гипоталамуса гонадотропинов, а гонадотропины сигнализируют яичникам необходимость производить эстрогены, чтобы восстановить их естественный уровень *. В результате этого, прямой эффект ингибиторов ароматазы будет подавляться, а побочные эффекты, в том числе ослабление кости и риск кисты яичников, будут проявляться *. Местное применение ингибиторов ароматазы будет иметь, видимо, бо́льший эффект, чем их системное применение.
Есть и другая проблема использования ингибиторов ароматазы. Недавно были выявлены производимые другими ферментами такие андрогенные метаболиты, как 5α-андростан-3β, 17β-диол (3β-диол), андрост-5-ен-3β и 17β-диол (A-диол), которые тоже активируют рецептор эстрогена (ERα) *. Используя эти метаболические пути как альтернативные ароматазе, клетки способны вырабатывать устойчивость к ингибиторам ароматазы. Вероятно, есть ещё какие-то другие, пока неизвестные обходные пути преобразования андрогенов в эстрогены.
Регуляторы метаболизма эстрогена. Эстрогенные гормоны выводятся из организма с мочой и фекалиями после их метаболического превращения в менее биоактивные и более водорастворимые соединения.
Основными метаболитами эстрадиола и эстрона являются их гидроксилированные формы – 2-ОН и 16α-ОН, остальные метаболиты присутствуют в относительно меньших количествах. Из них 16α-ОН оказывает наиболее выраженную эстрогенную активность, которая может превосходить активность самих гормонов * *. Образование 16α-ОН-E1 повышается у женщины с раком молочной железы или с высоким риском развития рака молочной железы.
Метаболиты 2-ОН напротив, оказывают некоторый антиэстрогенный эффект. Низкие уровни 2-гидроксиэстрона были связаны с более высоким риском развития рака молочной железы у женщин в пременопаузе
*.
По причине того, что 2-OH-E2 метилируется быстрее, чем 4-OH-E2, последний накапливается в груди в большей степени, чем 2-OH-E2
*.
Метаболиты 4-OH повреждают белковые структуры, в том числе ДНК, способствуя как появлению рака, так и его устойчивости.
Независимо от абсолютного уровня эстрогенов, важно уменьшать соотношение между более сильными и более слабыми эстрогенами (и их метаболитами). Т.е. уменьшать соотношение эстрадиола к эстрону и эстриолу; 2-ОН-эстрона к 4-ОН-эстрону и 16α-ОН-эстрону; 2-ОН-эстриола к 4-ОН-эстриолу и 16α-ОН-эстриолу.
Изменение рациона питания и добавки могут значительно изменить баланс между «плохими» и «хорошими» метаболитами эстрогена в пользу последних.
• Диета. Снижение потребления мяса и увеличение потребления клетчатки снижает в кишечнике концентрацию конъюгированных стероидных гормонов; увеличивает в крови уровень глобулина, связывающего половые гормоны, ограничивая биодоступность эстрогенов; и выводит их из организма жёлчные токсины.
• Льняное семя, потребляемое в пищу в свежемолотом виде, увеличивает соотношение 2-ОН-Е1:16α-ОН-Е1 за счёт оздоровления кишечной микрофлоры.
Перевод мышей на рацион с 10 % льняного семени от общего объёма пищи, тормозит скорость роста привитой ER–-опухоли молочной железы (MDA-MB-435) на 45 %, и снижает показатели её метастазирования в 2,5 раза
*.
У мышей с привитой ER+-опухолью (MCF-7) потребление льняного семени также задерживало её рост и выразительно усиливало антипролиферативное действие тамоксифена
*
*.
Регулярное потребление молотого льняного семени значительно повышает уровень 2-OH-E1 в сыворотке и соотношение 2-ОН-Е1:16α-ОН-Е1 у женщин постменопаузе
*
*
*,
снижая риск развития рака молочной железы в пременопаузе
* .
Дозировка: 15 г/сут
*.
• Индол-3-карбинол (I3C, И3К) увеличивает 2-гидроксилирование эстрогена * * и показывает статистически значимую регрессию рака матки в течение 12 недель приёма *. Дозировка: 400 мг *.
• Дииндолилметан (DIM), димер индол-3-карбинола, также увеличивает соотношение 2-ОН-Е:16-OH-E1 *, однако снижает уровень метаболитов тамоксифена в плазме *. Дозировка: 2×150 мг BioResponse DIM® *.
• Жирные кислоты ω-3, пищевые волокна, циметидин, прогестерон – также улучшают соотношение 2-OH:16α-OH.
• Ресвератрол (resveratrol) в дозировке 1'000 мг/сут в среднем на 73 % повышает содержание в моче в 2-гидроксиэстрона (2-OH-E1) у женщин в постменопаузе, что приводит к благоприятному изменению соотношения 2-OH:16α-OH-E1 *.
• Генистеин (genistein) из сои гидроксилирует эстрогены в менее мутагенные и канцерогенные метаболиты – 4-OH-E2 и 4-MeO-E1 *. Генистеин также повышает концентрацию в крови глобулинов, связывающих половые гормоны (ГСПГ), чем снижает уровень свободных активных эстрогенов и андрогенов. Дозировка генистеина: 150 мг/сут во время лечения и 40 мг/сут в профилактическом режиме. Между тем, потребление цельной сои даст, вероятно, бо́льший положительный эффект, чем потребление одного из её компонентов.
• Биоактивные вещества, выделенные из Цимицифуги (Actaea racemosa) и Клевера красного (Trifolium pratense), усиливают активность и экспрессию мРНК фермента CYP1A1, который отвечает за преобразование эстрогенов в неканцерогенные метаболиты 2-OH-E1 и 2-OH-E2 * *. Вопреки опасениям, результаты многих исследований показывают, что цимицифуга не способствует росту клеток рака молочной железы, как in vitro, так и in vivo.
• Солодка (Glycyrrhiza sp.), водный настой корня. В эпителиальных клетках молочной железы различные виды солодки, Glycyrrhiza glabra (GG) и Glycyrrhiza inflata (GI) и содержащиеся в них соединения по-разному модулируют экспрессию гена CYP1A1, отвечающего за детоксикацию эстрогена и гена CYP1B1, отвечающего за генотоксичность. GG и содержащиеся в GG глицирретиновая кислота (glycyrrhetinic acid) * и изоликвиритигенин увеличивали экспрессию CYP1A1, тогда как GI и ликохалкон A, снижали экспрессию CYP1A1 и CYP1B1 *.
• 6-пренилнарнигенин из экстракта хмеля ослабляет экспрессию CYP1B1, вызванную эстрогеном *, тем самым усиливая нетоксическое 2-гидроксилирование эстрогена. Дозировка этанолового экстракта хмеля: 300 мг/сут.
• Гранат. Полифенолы граната при концентрациях 100-1'000 мкг/мл in vitro ингибируют эстрогенный фермент 17-бета-гидроксистероид дегидрогеназа 1 (HSD17B1) от 34 % до 79 % в следующем порядке убывания эффективности: масло семян → полифенолы ферментированного сока → полифенолы околоплодника *. Совместное применение эллаговой кислоты с фосфатидилхолином в соотношении 1:4 может увеличить её биодоступность в два раза *.
• Ретиноевая кислота (витамин А) in vitro через активность рецепторов ретиноевой кислоты индуцирует экспрессию антиэстрогенного фермента 17-бета-гидроксистероид дегидрогеназа 2 (HSD17B2), трансформирующей высокоактивный эстроген (эстрадиол) в слабоактивный (эстрон) *, чем может снизить риск рака матки и яичников.
• N-ацетил-цистеин и ресвератрол in vitro предотвращают окисление эстрогена в метаболиты, вызывающие рак молочной железы * * *.
• Витамин B6 in vitro детоксифицирует избыточный эстроген путём метилирования, уменьшая риск развития эстроген-зависимого рака *. Повышение уровня внутриклеточного B6 приводит к ослаблению транскрипционной реакции на глюкокортикоиды, прогестерон, андроген или эстрогены. И наоборот, клетки с дефицитом витамина B6 проявляют повышенную чувствительность к стероидным гормонам * *.
• Витамин C играет важную роль в синтезе гормонов *. Приём внутрь 1 г/сут витамина C повышает уровень эстрадиола, в зависимости от начального уровня витамина в организме, на 20-50 % *. Но в то же самое время он снижает производство ароматазы в яичниках *.
• Витамин D3 увеличивает in vitro синтез прогестерона, эстрадиола и эстрона *, и при этом он снижает экспрессию ароматазы и воспалительных цитокинов в макрофагах *, а также усиливает защиту костей при сниженном уровне эстрогена *.
• Витамин Е способствует детоксикации эстрогена. Некоторые (но не все) формы витамина Е подавляют действие эстрогена, особенно в ткани молочной железы. Действие γ-токотриенола в ER+ клетках рака молочной железы MCF-7 усиливается при его комбинации с EGCG и ресвератролом *. Пролиферация клеток в присутствии EGCG (50 мкМ), ресвератрола (25 мкМ) и γ-токотриенола (10 мкМ) составляла соответственно около 33 %, 50 % и 58 % против контроля. Кормление крыс в течение 9 недель смешанными γ- и δ-токоферолами в количестве 0,1 %, 0,3 % или 0,5 % от общего объёма пищи подавляло у них рост опухоли молочной железы соответственно на 38 %, 50 % или 80 % *.
• Витамин K2 in vitro помогает снизить соотношение эстрадиол:эстрон путём связывания эстрогенного фермента 17-бета-гидроксистероид дегидрогеназа 4 (HSD17B4), превращающего эстрон в эстрадиол *, и ингибировать активность эстрогена путём связывания с его рецептором *. К сожалению, высокие дозы витамина K могут способствовать тромбообразованию.
• Йод в виде йодинов способен менять экспрессию не менее 43 различных генов, участвующих в метаболизме гормонов, а также участвующих в регулировании клеточного цикла, роста и дифференцировки клеток молочной железы *.
• Физическая нагрузка и рацион с высоким содержанием белка также может способствовать снижению соотношения 2-OH:16α-OH.
Другим решением безопасного метаболирования эстрогенов является их глюкуронидация и сульфатирование, в результате чего они теряют свою биологическую активность. Известные на сегодня средства, способствующие сульфатированию эстрогена, это целекоксиб, ресвератрол, кверцетин, глюкокортикоиды.
Целевые показатели, к которым нужно стремиться путём регуляции метаболизма эстрогена:
- уровень 16α-гидроксиэстрона у здоровых женщин – 10-15 нг/мл в пременопаузе, и 4 нг/мл в постменопаузе;
- уровень 2-гидроксиэстрона у здоровых женщин – 13-23 нг/мл в пременопаузе, и 6 нг/мл в постменопаузе;
- соотношение метаболитов эстрогена 2-ОН-Е1 к 2-OMe-E1 – 0,6-6 (у здоровых женщин в пре- и постменопаузе);
- соотношение метаболитов эстрогена 2-OH-E1 к 16α-OH-E1 – от 1,6 в пременопаузе до 1,5 в постменопаузе;
- соотношение метаболитов эстрогена 4-OH-E1 к 4-OMe-E1 – от 0,4 в пременопаузе до 0,3 в постменопаузе.
Модуляторы рецепторов эстрогена. Эстрогены способствуют росту рака молочной железы через сигнализацию рецептора эстрогена альфа (ERα), который экспрессируется примерно в 70 % случаев рака молочной железы *. Поэтому другой стратегией антиэстрогенной борьбы, помимо снижения уровня эстрогена является снижение активности рецептора эстрогена (ER) в эстроген-чувствительных клетках. Тем не менее, сообщалось, что такая терапия может быть менее эффективной по сравнению с ингибиторами ароматазы *.
Селективные модуляторы рецептора эстрогена (Selective Estrogen Receptor Modulator, SERM), такие как тамоксифен (tamoxifen) или ралоксифен (raloxifen) эффективно действуют против рецидива ER+-опухолей молочной железы *. Тамоксифен метаболизируется в печени при помощи ферментов CYP2D6 и CYP3A4. Образующиеся метаболиты действуют как антагонист ER, конкурируя с эстрогенами за эстрогенные рецепторы в клетках ткани груди, и подавляя транскрипцию генов, чувствительных к эстрогенам *. Метаболиты тамоксифена проявляют большее сродство к ERα и ERβ, чем эстрадиол: в 1,8 и 3,4 раза соответственно *. Поскольку рецепторы ERα и ERβ с различной степенью экпрессируются в различных тканях, то тамоксифен действует как антагонист ERα в молочной железе, и как агонист ERβ в матке и яичниках *, увеличивая риск рака в этих органах.
Нерецептурные модуляторы рецептора эстрогена менее эффективны, однако они более безопасны и могут усиливать действие SERM, назначенных врачом, позволяя тем самым снизить дозировку последних. Они также могут применяться вместо рецептурных SERM после прекращения их приёма.
• Чеснок (Allium sativum), особенно обогащённый селеном *, подавляет in vitro активность рецептора эстрогена ERα в раковых клетках молочной железы. Входящий в состав чесночного масла диаллил трисульфид (DATS) при концентрации 20 мкМ примерно на четверть снижает жизненную стойкость ER+ (MCF-7 и T47D) раковых клеток *. В отличие от некоторых других терапевтических средств, торможение роста клеток, вызванное DATS, не отменялось избыточной экспрессией эстрадиола или ERα. Приём чеснока позволяет заметно снизить развитие уже диагностированного рака молочной железы II и III стадии *. Внутрибрюшинные инъекции мышам трёхсернистого диаллила, содержащегося в чесночном масле, втрое снижали темпы развития рака *. Дозировка: 200 мг DATS в комбинации с 100 мкг селена *.
Альтернативные источники DATS – состаренный чеснок (выдержанный 10 месяцев после его размалывания и смешивания с равным количеством водно-спиртового раствора *); чёрный чеснок (чеснок, ферментированный в течение 2-4 недель при температуре 60-90 °C и влажности 80-90 %); сухой порошок чеснока. Содержание DATS в чесноке – около 1-3 %, поэтому его концентрации, необходимые для подавления экспрессии и функции ER, могут быть достигнуты путём потребления 10-15 г/сут сырого чеснока *. Фитонциды сырого чеснока вряд ли сделают такое высокое потребление чеснока возможным. Они оказывают обжигающее действие на слизистую поверхность ЖКТ, уничтожают кишечную флору и вызывают неприятный запах изо рта. В то же время чесночный продукт, принимаемый в кишечнорастворимых капсулах, свободен от этих недостатков. Дозировка: 10 г/сут сырого чеснока *, или 500 мг сухого экстракта состаренного чеснока *.
• Селен in vitro уменьшает уровни экспрессии белка ERα и уменьшает связывание эстрадиола с рецептором эстрогена в ER+ раковых клетках молочной железы (MCF-7), и при этом увеличивает экспрессию белка ERβ в ER–клетках рака молочной железы (MDA-MB-231)
*.
У мышей с привитой ER+ опухолью молочной железы (MCF-7) метилселеноцистеин синергично повышает противо
• Хмель (Humulus lupulus) содержит 8-пренилнарингенин, который проявляет связывание с ERα *, причём во много раз более сильное, чем любой другой фитоэстроген *. Конкурируя с эстрогеном за ER, он может снижать эстрогенное действие последнего *. Таким образом, экстракт хмеля и 8-пренилнарингенин препятствуют злокачественному перерождению молочной железы *. Низкие дозы экстракта хмеля не оказывают эстрогенного воздействия на матку *. Дозировка: трижды в день 500 мг таблетированного хмеля, содержащего 0,1 мг 8-пренилнарингенина *.
• Индол-3-карбинол (I3C), содержащийся в крестоцветных, in vitro при низкой концентрации оказывает пролиферативное действие в ER+ раковых клетках молочной железы (MCF-7) * * *. А при высокой концентрации (100 мкМ) – антипролиферативное действие *, главным образом, за счёт снижения экспрессии мРНК ERα *. В отличие от тамоксифена, I3C не является конкурентом эстрогена за связывание с рецептором, а использует иные механизмы (связывание лигандов с AHR), и благодаря этому он может усиливать in vitro антипролиферативный эффект тамоксифена *. Сочетание I3C и генистеина синергично усиливает экспрессию GADD (белка-индикатора повреждения ДНК), тем самым увеличивая апоптоз, и позволяет снизить эффективную дозу каждого из этих фитовеществ *. Дозировка: 400 мг/сут *.
• Эллаговая кислота * *, и изомеры линолевой кислоты * *, содержащиеся в плодах Граната (Punica granatum), in vitro ухудшают связывание эстрадиола (Е2) с ERα и ERβ клеточными рецепторами, подавляя рост и пролиферацию ER+ клеток рака молочной железы. Кроме того, эмульсия из смеси ферментированного сока и масла семян граната * снижает значение соотношения экспрессии ERα:ERβ, что было обнаружено в опытах на крысах при дозировке 5 мг/кг *. Несмотря на то, что экстракт граната действует подобно тамоксифену и другим SERM, он, видимо, не увеличивает пролиферацию клеток и массу матки у мышей с удалённым яичником *.
Экстракт плодов граната (300 мкг/мл) in vitro усиливает вызванное тамоксифеном ингибирование эстрогена, задержку клеточного цикла и апоптоз в клетках рака молочной железы *. Кроме того, он восстанавливает чувствительность к тамоксифену опухолевых клеток, устойчивых к тамоксифену. Полифенолы ферментированного сока (вина) демонстрируют примерно в двое бо́льший антипролиферативный эффект по сравнению с полифенолами свежего гранатового сока. Масло семян граната (100 мкг/мл) in vitro приводило к 75-90 %-ному подавлению пролиферации в ER+ клеток молочной железы (MCF-7), а в 54 % ER– клеток (MDA-MB-435) вызывало апоптоз *.
Помимо влияния на эстроген, один стакан гранатового сока в день способен за 2 недели увеличить уровень тестостерона в сыворотке в среднем на 24 % как у мужчин, так и у женщин *. Однако в постменопаузе ежедневный приём 250 г сока вызывает у женщин значительное снижение уровня эстрона и тестостерона *. Дозировка: экв. 500 мг/сут метанолового экстракта граната *.
• Эпигаллокатехин-галлат (EGCG) и другие полифенолы зелёного чая повышают in vitro эффективность применения тамоксифена при ER– раке молочной железы, не изменяя экспрессию ER-белка *. Обработка EGCG ингибировала у мышей инвазивный ERα+-фенотип опухолевых клеток молочной железы *. У мышей с имплатированным тройным негативным раком молочной железы сочетание EGCG (25 мг/кг) с тамоксифеном (75 мкг/кг) на 71 % уменьшает рост объёма опухоли по сравнению с необработанной контрольной группой *. Тем не менее, шестимесячные исследования женщин с ER– раком молочной железы I или II стадии, принимавших 400-600 мг/сут EGCG, показали у них весьма незначительное снижение экспрессии ERα *. Дозировка EGCG: до 1'200 мг/сут * *, что эквивалентно 12-18 чашкам зелёного чая в день.
• Байкалеин (baicalein), флавоноид из корня Шлемника байкальского (Scutellaria baicalensis), может связывать рецепторы эстрогенового рецептора α (ERα) и связанные с G-протеином рецепторы эстрогена (GPER), которые являются двумя критическими путями, связанными с эстрадиолом *. Это выгодно отличает его от тамоксифена, который является антагонистом для ER, но агонистом для GPER, что повышает риск рака матки и яичников у женщин, принимающих тамоксифен. Дозировка байкалеина, эквивалентная исследованным на животных *: до 125 мг/сут, такое его количество содержится примерно в 20 г сухого корня.
• Ресвератрол, кверцетин и катехин, полифенолы винограда, содержащиеся в его кожуре, также действуют как селективные модуляторы рецепторов эстрогенов *. Полифенолы, однако, показывают на порядки меньшую активность по сравнению с натуральными гормонами. Ресвератрол, например, связывает ERα и ERβ в 7'000 раз слабее, чем эстрадиол (E2) *. Кормление мышей смесью равных частей ревератрола, кверцетина и катехина в общей дозировке по 5 мг/кг трижды в день снижало у них за 77 дней опыта размеры привитой TNBC-опухолей (MDA-MB-231 и MDA-MB-435) на треть в сравнении с контролем *, причём наиболее весомый вклад вносили в ресвератрол и кверцетин. По причине негативного влияния алкоголя на здоровье молочной железы, его следует удалить из красного вина перед употреблением; в домашних условиях это можно сделать путём выпаривания.
• Бета-ситостерин – агонист рецептора эстрогена, который предпочтительно связывается с ERβ *. Небольшие добавки бета-ситостерина в рацион мышей (1 % от веса пищи), на треть снижают у них уровень эстрадиола в сыворотке, однако его избыточное потребление с пищей или добавками может оказывать эстрогенный и пролиферативный эффект на ER+ раковые клетки молочной железы. Помимо регулирования гормонов, бета-ситостерин снижает уровень холестерина (ЛПНП), сахара и эстрогена в крови, подавляет воспаление и усиливает иммунитет *. Дозировка: 330-1'200 мг/сут.
• Гинкгетин (ginkgetin) – бифлавоноид из листьев Гинкго билоба (Ginkgo biloba) in vitro вызывает гибель ER-позитивных раковых клеток молочной железы посредством ингибирования экспрессии рецептора эстрогена *.
• Руписяо (Ru-Pi-Xiao) – традиционный китайский сбор (6 г/сут) применяемый при гиперплазии молочной железы. Он помогает повысить уровень прогестерона естественным путём, без экзогенных добавок и тем самым усилить эффективность тамоксифена (20 мг/сут) *. Длительность приёма – не менее 3 месяцев.
• Мелатонин (melatonin) in vitro уменьшает размер и количество маммосфер раковых клеток молочной железы, блокируя связывание эстрогена с рецептором в ER+ раковых клетках *, в том числе стволовых раковых клеток * *. Мелатонин проявляет двойной антиэстрогенный эффект: он не только блокирует метаболизм эстрогена в более активные формы и поддерживает циркулирующий эстроген в неактивном состоянии * *, но также снижает чувствительность рецепторов эстрогена, ослабляя стимуляцию роста клеток * *.
Сочетание мелатонина с тамоксифеном в 100 раз усиливает in vitro подавление тамоксифеном роста раковых клеток молочной железы *. Приём 20 мг мелатонина на ночь и 20 мг тамоксифена в полдень в течение 8 месяцев вызвал частичный ответ у 28,5 % пациентов с метастазировавшим раком молочной железы, которые не ответили на предварительное лечение тамоксифеном *. В другом исследовании, из группы в 25 безнадёжных раковых больных, не ответивших на все предыдущие методы лечения, та же схема лечения вызвала частичный ответ у 3, и стабилизировала состояние ещё у 13 человек *.
Сообщалось, что некоторые вещества натурального происхождения, включая морин, силибин, эпигаллокатехин галлат (EGCG), мирицетин, байкалеин, куркумин, кемпферол или кверцетин, повышают биодоступность тамоксифена и его метаболитов *.
В отличие от ингибиторов ароматазы, подавление рецептора эстрогена эффективно для женщин как в пременопаузе, так и в постменопаузе, однако следует учитывать ряд негативных побочных эффектов вследствие приёма ингибиторов ER:
• У 16 % женщин, принимающих тамоксифен, в матке и яичниках наблюдается атипичная гиперплазия *, склонная к неоплазии *. Основным средством, препятствующим этому, остаётся прогестерон, а альтернативными – генистеин (50 мг/сут, не менее полугода) и метформин (850 мг/сут) * *.
• У женщин, принимающих тамоксифен, по сравнению с женщинами, не получающими лечения, до 5 раз чаще развиваются ER–-опухоли в противоположной молочной железе *, которые более агрессивны, чем ER+-опухоли. Этому эффекту можно успешно противопоставить сочетание высокой физической активности и таких эпигенетических средств, как экстракт зелёного чая и экстракт брокколи, а также других крестоцветных овощей, таких как кольраби, брюссельская капуста, цветная капуста, листовая горчица, брюква, редька, васаби/хрен *.
• Снижение уровня эстрогена способно приводить к ослаблению костной массы, что может в некоторой мере компенсироваться приёмом жирных кислот ω-3, витамина D, кордицепса (5-20 мл/сут), мелатонина (3-20 мг/сут) *, а также комплекса кальция, магния и фосфора *.
• Ещё одним негативным эффектом тамоксифена и ралоксифена является т.н. «загущение» крови и усиление тромбообразования *. Для компенсации этих явлений может быть показан приём таких препаратов, как бромелаин, аспирин, а также ограничение поступление витамина К.
• Тамоксифен значительно снижает чувствительность клеток к инсулину, предрасполагая к диабету II типа. Этот эффект можно в определённой мере компенсировать, принимая метформин (500 мг/сут).
• Потеря эстрогена влечёт за собой снижение содержания в плазме меди, хрома, цинка и магния *. Таким образом, у женщин в постменопаузе, после операции удаления яичников, или принимающим ингибиторы эстрогена, при недостаточном потреблении овощной и цельнозерновой пищи, может возникнуть необходимость приёма этих элементов в виде добавок.
Пациенты, которым назначен тамоксифен, могут обсудить с лечащим врачом возможность его замены на ралоксифен *, а ещё лучше – на торемифен или лазофоксифен, которые проявляют значительно меньший канцерогенный эффект в отношении матки и яичников, а также значительно меньший риск инсульта, катаракты и тромбоза/тромбоэмболии *. С другой стороны, тамоксифен более эффективен *, и сохраняет свой эффект в течение 5 лет после прекращения его приёма. В то время как эффект других SERM может снижаться с течением времени их приёма *.
Альтернативой пероральному тамоксифену является патентованый гель BHR-700 (Besins Healthcare), который в качестве активного ингредиента содержит 4-гидрокситамоксифен (4-OHT). В отличие от таблеточной формы, гелевый тамоксифен может легко всасываться через кожу груди и попадать непосредственно в молочную железу, что позволяет снизить его дозировку и побочные последствия; в том числе в отношении матки. Однако он пока не прошел клинические испытания и не получил разрешение FDA.
Другой альтернативой могло бы быть использование вместо тамоксифена натурального гормона – эстриола. Эстриол проявляет в 10 раз более слабый эстрогенный эффект, чем эстрадиол. Таким образом, конкурируя с эстрадиолом за один и тот же рецептор, эстриол мог бы снижать пролиферативную активность эстрадиола. Но такая терапия пока находится на стадии смелого предложения.
Другим, более доступным и провереным улучшением гормональной терапии является добавка к тамоксифену натурального андрогена – прогестерона. У пациентов с запущенным раком молочной железы в постменопаузе чередование каждую неделю приёма тамоксифена (20 мг/сут) с приёмом комбинации тамоксифен+прогестерон (500 мг/сут прогестерона орально) вдвое увеличивало эффективность тамоксифена по таким показателям, как уменьшение опухоли, стабилизация заболевания и время до его прогрессирования *.
В связи с повышением риска рака детородных органов, который, как правило, диагностируется на поздних стадиях, женщинам, принимающим SERM, рекомендуется регулярная диагностика.
Модуляторы рецептора GPER (G protein-coupled estrogen receptor 1). Это третий, не так давно обнаруженный рецептор эстрогена, который наряду с ERα и ERβ считается важным модулятором развития опухоли *. В отличие от ERα и ERβ, которые действуют через управление экспрессией генов, GPER действует более быстро, не геномным путём – через активацию сигнальных путей, участвующих в выживании, пролиферации и инвазии раковых клеток. GPER-1 широко экспрессируется в клеточных линиях рака молочной железы и первичных опухолях молочной железы * *.
Вопрос о том, следует ли активировать, или подавлять этот рецептор, остаётся предметом острых споров ввиду противоречивых результатов исследований. В разных тканях и при различающихся между собой условиях (в частности, наличия или отсутствия его лиганда), модуляторы GPER могут действовать противоположно.
При раке молочной железы наблюдается повышенная экспрессия GPER-1, которая является маркёром заболевания и сильным предсказателем неблагоприятного прогноза *. И наоборот, отсутствие экспрессии GPER связано с отличным долгосрочным прогнозом ER+- и PgR+-первичного рака молочной железы при лечении тамоксифеном *. Несмотря на это, обработка клеток агонистами GPER приводит in vitro к подавлению опухоли.
Особое значение GPER-1 имеет при тройном негативном раке молочной железы. Активация GPER его агонистом (G-1) ингибировала in vitro рост клеток TNBC рака молочной железы *.
Идентификация модуляторов GPER является сложной задачей, потому что биологический эффект молекул, нацеленных на GPER, может быть специфичным для различных клеток и тканей. В результате скрининга было выявлено несколько эффективных химических молекул, способных in vitro селективно ингибировать GPER *, однако все они пока недоступны. А натуральных модуляторов GPER-1 известны единицы.
• Байкалеин, флавоноид из корня Шлемника байкальского (Scutellaria baicalensis), видимо, наиболее эффективный из известных модуляторов GPER. Он может связывать рецепторы как ER, так и GPER *, тогда как тамоксифен блокирует ER, но стимулирует GPER. Человеческая дозировка байкалеина, эквивалентная исследованиям на мышах *, составляет 125 мг/сут.
Лабораторные и проспективные исследования указывают на ведущую роль гормонов в появлении и развитии большинства случаев гормоно-зависимого рака молочной железы. Да и в целом, трудно сохранять молодость и витальность, если не поддерживать адекватный уровень гормонов в течение всей жизни. Опубликовано большое количество международных исследований о пользе добавок натуральных гормонов в случае их недостатка. Однако в медицинской практике основной акцент сделан, в основном, на эстрогены. Это касается не только официальной медицины, но и множества клиник альтернативной или комплементарной медицины.
Добавки основных гормонов представляется самой простой, прямой и хорошо контролируемой манипуляцией при гормональной дерегуляции. В то время как избыток эстрогена вынуждает применять различные сложные стратегии, направленные на его сокращение, дефицит любых других гормонов легко компенсируется путём использования их натуральных добавок. Однако такой подход требует контроля со стороны квалифицированного специалиста.
Существует несколько правил гормональной коррекции.
1. Приём экзогенных гормонов возможен исключительно после подтвержденного анализом их дефицита. Как ни удивительно, этому правилу не всегда следуют даже медицинские работники.
К сожалению, гормональный анализ половых гормонов в ткани представляет собой определённые сложности.
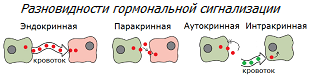
Во-первых, легче всего выяснить уровень гормонов, циркулирующих в крови, т.е. участвующих в эндокринной сигнализации. Намного труднее выяснить уровень гормонов, участвующих в паракринной и аутокринной сигнализации. А тем более – в интракринной, где синтез активных гормонов из их предшественников происходит внутри тех же клеток, на которые они оказывают свое действие; поэтому значительной их утечки в кровеносные сосуды не происходит *. Это значит, что уровни внутриклеточной концентрации половых стероидов не могут быть адекватно оценены путём измерения их уровня в крови.
Между тем, интракринное образование эстрогенов в периферических тканях у женщин составляет примерно 75 % до менопаузы и почти 100 % после менопаузы *. Поэтому ориентация на сывороточные уровни при гормональной коррекции не адекватно отражает уровень гормонов в ткани, и может привести к многократному завышению дозировки принимаемых добавок.
Во-вторых, для определения биологической активности того или иного стероидного гормона следует выяснить его уровень в свободном (не связанном со специфическими глобулинами или альбумином) состоянии. Потому что биологическую активность проявляют лишь гормоны, находящиеся в свободном состоянии. К сожалению, исследования сыворотки, выполняемые большинством лабораторий, обычно показывают общие уровни гормонов, находящихся в крови, т.е. связанных, и несвязанных (свободных) фракций вместе. Считается, что соотношение связанных и свободных гормонов находится в пределах 20:1-100:1, однако актуальное его значение точно не известно.
Уровень стероидных гормонов, измеренный в слюне, видимо, будет более адекватно отражать их уровень в ткани молочной железы, чем уровень, измеренный в крови * *. Но, к сожалению, исследования слюны в клиниках очень дорогие, а сервис онлайн-лабораторий * * * в Украине пока недоступен.
В третьих, уровень эстрогена и прогестерона у репродуктивных женщин колеблется в зависимости от дня цикла овуляции *. Поэтому для адекватной оценки состояния придётся сделать, как минимум, два забора материала – на 11 и на 20 день 28-дневного менструального цикла, когда, соответственно, наблюдаются пики концентрации эстрадиола и прогестерона *.
Гормональный анализ проводится каждые 3 месяца, после чего специалист принимает решение о необходимости дальнейшей терапии.
2. Принимают биоидентичные, а не синтетические гормоны. Молекулы натуральных или биоидентичных гормонов имеют молекулярную структуру, идеально совпадающую со структурой своего рецептора. Молекулы синтетических гормонов имеют молекулярную структуру, отличную от той, которую ожидает от них рецептор. По этой причине они не могут связываться с соответствующими рецепторами надлежащим образом, и не способны обеспечивать такую же физиологическую активность, как и натуральные гормоны. Что ещё хуже, многие из них вызывают канцерогенные побочные эффекты * * .
Множество исследований показывают, что прогестины (синтетические аналоги прогестерона) значительно увеличивают маммографическую плотность груди * и пролиферацию клеток молочной железы. Главным образом, это происходит путём стимуляции рецептора эстрогена * * и значительному увеличению количества экспрессируемых генов по сравнению с натуральным гормоном (2'500 против 600) *. В то же время, и натуральный прогестерон, и низкодозовый натуральный эстрадиол, вводимый трансдермально, не вызывают этого негативного эффекта * * *.
Женщины, принимающие в качестве заместительной гормонотерапии (ЗГТ) прогестин в сочетании с эстрогеном, повышают риск рака молочной железы вдвое по сравнению с женщинами, вообще не использующими ЗГТ. А женщины, принимающие в сочетании с эстрогеном вместо прогестина натуральный прогестерон, наоборот, снижают этот риск *. Пероральные противозачаточные средства, которые содержат синтетические формы прогестерона, также увеличивают риск рака * *.
Единственное разумное объяснение того, почему до сих пор рекламируют и продвигают синтетические гормоны вместо натуральных – это возможность патентовать их формулу, и благодаря этому получать дополнительную прибыль. К сожалению, за счёт здоровья женщин.
3. Дозировка экзогенных гормонов должна быть адекватной. Дозировка в значительной мере зависит от индивидуального случая, и определяется специалистом на основании нескольких показателей. Добавки гормонов, используемых не в качестве лечения, а в качестве компенсации их недостатка, не должны создавать концентрацию в ткани выше, чем физиологическая. Уровни стероидных гормонов не должны превышать показатель, который наблюдается в молодые годы. Их соотношение также должно соответствовать соотношению, наблюдаемому в молодые годы.
4. Добавки определённого гормона должны корректировать его соотношение с антагонистом, а не вызывать дисбаланс. Для соблюдения этого правила следует проверить уровень всех других основных гормонов, а не только интересуемого. То есть, должны быть проверены не только эстрадиол, прогестерон, DHEA и тестостерон, но также кортизол и гормоны щитовидной железы (ТТГ, Т3, Т4). Результаты анализа могут показать необходимость коррекции и других гормонов.
5. Способ введения гормонов должен быть эффективным. При введении через рот стероидные гормоны имеют плохую биодоступность, а после поступлении в кровь из кишечника они проходят метаболические преобразования в печени, и 90 % из них связывается с белками. В таком виде они становятся водорастворимыми, легко распространяются в сыворотке крови по всему телу, однако теряют при этом свою биологическую активность.
При введении через кожу стероидные гормоны попадают в кровоток без предварительного прохождения через печень и, распространяясь по лимфатической системе, остаются в свободном, биоактивном состоянии. Таким образом, местное применение стероидных гормонов в составе мази будет более целевым, экономным, и позволит лучше контролировать величину поступившего в организм экзогенного гормона.
Наконец, коррекция уровня и соотношения гормонов должны производится в соответствующее время. Так, у женщин в пременопаузе концентрация эстрадиола достигает максимума в лютеальную фазу месячного цикла, и с его избытком особенно важно бороться именно в это время. А мелатонин требуется организму только ночью, и его следует принимать лишь перед сном.
В приведенной здесь таблице указаны средние значения концентрации некоторых гормонов в сыворотке, наблюдаемые у женщин в различные периоды жизни и цикла овуляции.
Уровень и соотношение гормонов сильно зависят от возраста, беременности, фазы цикла овуляции, состава пищи и других обстоятельств.
Глядя на приведенный ниже график изменения у женщин средних уровней половых гормонов с возрастом, можно заметить, что производство DHEA начинает расти с 6-7 лет, и по мере роста его концентрации, из него начинают синтезироваться тестостерон, эстрон и эстрадиол. Сначала рост эстрогенов обгоняет рост андрогенов, способствуя росту и созреванию детородных органов и молочной железы. Когда формирование специфики женского организма закончено, увеличивается концентрация андрогенов, которые тормозят и уравновешивают пролиферативное действие эстрогенов.
Падение производства DHEA, которое начинается после 30 лет *, приводит к плавному снижению производства из него не только эстрогенов, но и тестостерона. Параллельно с этим, за несколько лет до менопаузы начинается постепенное снижение производства прогестерона и тестостерона. Уровень предшественников эстрогена в сыворотке критически снижается, вследствие чего происходит сначала сокращение, а затем и прекращение производства эстрадиола яичниками. При этом всё большее количество эстрогена синтезируется из DHEA непосредственно в ткани, чувствительной к эстрогену.
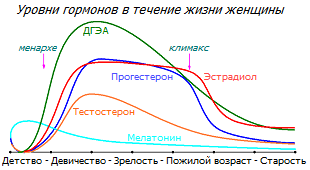
То есть, падение уровня эстрадиола, наблюдаемое в менопаузе – лишь завершающий штрих предыдущих функциональных изменений, а не центр проблемы.
Более того, если предположить, что снижение эстрадиола – это защитная реакция на дисбаланс эстроген:андроген, то попытка экзогенными добавками восстановить его уровень без одновременного восстановления соотношения эстроген:андроген выглядит неразумным.
У женщин с недавно диагностированным раком груди был отмечен специфический гормональный профиль, особенностью которого является повышенный уровень в слюне эстрадиола (на 17,2 %) и эстрона (на 24,5 %), и пониженный уровень эстриола (на 23 %), тестостерона (на 15,5 %) и сульфатированного дегидроэпиандростерона (DHEA-S) (на 17,5 %) по сравнению с контролем *.
В других отчётах также сообщалось о значительно более высоком уровне общего * или свободного * * эстрадиола в группе женщин с недавно диагностированным раком по сравнению с контрольной группой.
Таким образом, баланс между эстрогеном и андрогеном у них существенно смещён в сторону гормонов, которые способствуют пролиферации и увеличивают риск рака груди. Таким образом, коррекция гормонального профиля за счет приема соответствующих гормонов выглядит разумным решением.
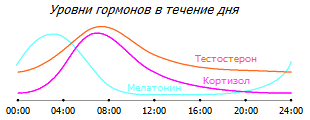
Уровень кортизола нормально подвержен циклическим суточным колебаниям, увеличиваясь до максимума ранним утром, и падая до минимума поздним вечером. У раковых больных наблюдается как увеличение среднесуточного уровня кортизола в слюне, так и сглаживание его суточного ритма. Но чем более выражено такое отклонение, тем более низкое количество клеток натуральных киллеров, тем более подавлено их состояние, тем выраженнее утомляемость пациентов и тем хуже прогноз для больных с метастатическим раком молочной железы * * *. Подобные аномальные циркадные паттерны являются скорее причиной болезни, чем её следствием, и могут служить также для оценки риска рака молочной железы у женщин с невыявленной опухолью *.
Уровень тестостерона тоже наиболее высок в первую половину дня, и неудивительно, что утро – это время наиболее эффективной работы. В то же время, уровень мелатонина наиболее высок в глубокую ночь, но по мере роста уровня кортизола он начинает падать.
Прогестерон (Pg) – антагонист эстрадиола (Е2) и эстрона (Е1) *. Прогестерон блокирует рецепторы эстрогена, что приводит к снижению чувствительности ткани к эстрогену * *. В то время как эстрадиол способствует экспрессии антиапоптотических белков (Bcl-2, сурвивин) и пролиферации клеток, прогестерон способствует экспрессии апоптотических белков (p53) и противодействует пролиферации *. Баланс между этими двумя гормонами определяет судьбу клеток молочной железы: смерть или бессмертие. Увеличение концентрации эстрадиола увеличивает число делящихся клеток, а увеличение концентрации прогестерона – уменьшает *.
Хотя эстрадиол способствует, а прогестерон противодействует развитию рака, нельзя считать эстрадиол бедствием, а прогестерон спасением. Эстрадиол – гормон женственности и молодости, он проявляет выраженный анаболический эффект *, и возрастное падение его уровня связано с началом угасания женского здоровья и развитием возрастных заболеваний *. На самом деле, проблемой является не столько сам уровень эстрадиола, сколько нарушением баланса между эстрадиолом и сдерживающим его андрогенами, в том числе прогестероном. Это значит, что эстрадиол при повышенной его концентрации следует не только подавлять, но и компенсировать соответствующей концентрацией его естественного антагониста – прогестерона.
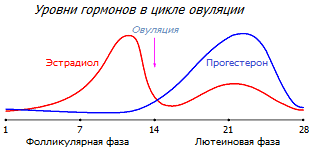
Зрелая женщина испытывает ежемесячные циклические изменения баланса эстрогена и прогестерона, которые генетически перестраивают поведение гормоночувствительных клеток в соответствии с требованиями цикла овуляции. В зависимости от периода цикла, увеличивается то концентрация эстрадиола, усиливающего пролиферацию, то концентрация прогестерона, работающего в противоположную сторону. Пока средняя концентрация обоих гормонов в норме, эти месячные качели удерживают в гормоночувствительных тканях здоровое динамическое равновесие.
Яичники репродуктивных женщин вырабатывают до 30 мг/сут прогестерона во время пика лютеиновой фазы, наступающей примерно на 19-22 день 28-дневного менструального цикла. Пролиферативная фаза цикла овуляции (развитие фолликулов яичника) к этому времени закончена, и увеличение производства прогестерона требуется для того, чтобы эстрадиол не стимулировал избыточного роста ткани. Иначе в длительной перспективе (несколько месячных циклов подряд) избыточная пролиферация грозит неуправляемой гиперплазией с дальнейшим развитием рака матки. На пике лютеиновой фазы уровень прогестерона в сыворотке крови здоровой женщины возрастает в среднем до 18 нг/мл, т.е. более, чем в 30 раз по сравнению с фолликулярной фазой цикла (0,5 нг/мл) *, и в 10 раз меньше, чем во время беременности (170 нг/мл) *. А в слюне уровень свободного прогестерона на пике лютеиновой фазы повышается до 75-270 пг/мл (1 % от его уровня в сыворотке) против 10-25 пг/мл в фолликулярной фазе, и против 12-50 пг/мл у постменопаузных женщин *.
Отсюда следует, что для сдерживания вызываемой эстрогеном пролиферации тканей требуется приблизительно 18 нг/мл прогестерона в сыворотке; при условии, что уровень эстрадиола в сыворотке пределах нормы (160 пг/мл) *. Несложно подсчитать, что сывороточное соотношение прогестерон:эстрадиол (Pg:E2) должно составлять примерно 100:1.
В период менопаузы и постменопаузы, вместе со снижением активности надпочечников, падает уровень не только эстрогена, но и андрогена. Причём концентрация прогестерона в ткани падает даже раньше и значительнее, чем концентрация эстрадиола. Нарастает хронический гормональный дисбаланс, который называют «доминирование эстрогена». Поскольку сдерживание эстрогена ослабляется, его пролиферативный эффект усиливается, увеличивая риск доброкачественных * и злокачественных * опухолей молочной железы.
Добавки прогестерона в этом случае помогают не только снизить риск опухолей, но и смягчить такие симптомы преобладания эстрогена над андрогеном, как снижение полового влечения и интереса к жизни, повышение уровня сахара в крови, усталость, циклическая мигрень, нечёткое мышление, раздражительность, задержка воды, потеря костной массы, ожирение, нарушение функции щитовидной железы *. Причём приём физиологических уровней натурального прогестерона, видимо, вполне безопасен. Несколько широкомасштабных исследований не обнаружили связи более высоких уровней прогестерона в сыворотке с риском рака молочной железы как в пременопаузе * *, так и постменопаузе *.
В противоположность прогестерону, эстрадиол как в постменопаузе, так и в пременопаузе ассоциируется с повышением риска ER+/PR+-рака в 1,9-2,6 раза; эстрон – в 1,8-2 раза; тестостерон – в 1,4-2 раза; андростендион – в 1,5-1,7 раза; DHEA – в 1,1-2 раза при сравнении групп с наибольшим и наименьшим уровнем каждого гормона * * * *. Последние три гормона являются предшественниками эстрогена, и при бурной активности ароматазы их высокая концентрация предполагает высокую концентрацию эстрадиола и эстрона, увеличивающих риск рака. Однако сами по себе андрогены могут наоборот, снижать этот риск *. Обобщив эти факты, мы всё равно возвращаемся к основополагающей причине риска гормоночувствительного рака – доминированию эстрадиола над другими гормонами.
Адекватный уровень прогестерона важен не только в постменопаузе. В пременопаузе высокие показатели эндогенного прогестерона, а с ним и более высокое соотношение прогестерон:эстрадиол в сыворотке ассоциируется с более низким риском инвазивного рака молочной железы *. Если у здоровых пременопаузных женщин средний уровень прогестерона в сыворотке утром на 21 день цикла составляет 17,6 нг/мл, то у женщин с гиперплазией – 13,9 нг/мл, а у женщин с раком – 11,4 нг/мл *. У пременопаузных женщин с регулярным менструальным циклом, имеющих в сыворотке самый высокий уровень прогестерона (> 13,5 нг/мл), против женщин с самым низким его уровнем (< 9 нг/мл), риск развития рака молочной железы был ниже в 8 раз *. И, наоборот, у женщин с дефицитом прогестерона, по сравнению с женщинами с нормальным уровнем прогестерона, риск рака молочной железы был выше в 5,4 раза, а вероятность смерти от рака – в 10 раз выше *.
У женщин с самым высоким уровнем прогестерона в крови во время беременности, против женщин с самым низким его уровнем, наблюдалась сильная тенденция к снижению риска рака молочной железы в будущем *. Например, для женщин в возрасте до 51 года разница риска рака груди между этими двумя группами достигала 70 %. Приведенные данные грешат неполнотой, но они дают целевой показатель, к которому нам следует стремиться – около 18 нг/мл прогестерона в сыворотке во время пика лютеиновой фазы при соответствующей ему концентрации эстрадиола.
В опытах in vitro прогестерон в концентрации, близкой к концентрации в третьем триместре беременности, проявлял сильный антипролиферативный эффект в клетках ER+/PR+-опухолей *. В отличие от препаратов химиотерапии, действующих на все клетки с одинаковой силой, прогестерон стимулирует смерть только тех клеток, в которых нарушена нормальная регуляция программы самоубийства (т.е. раковых клеток). А в опытах на животных прогестерон усиливал антипролиферативное действие тамоксифена *. Таким образом, добавки прогестерона могли бы быть полезными для женщин с прогестероновым дефицитом. И действительно, прогестерон, наносимый в виде геля на грудь, подавляет пролиферацию клеток, вызванную действием эстрогена *, и способен вдвое снизить риск рака молочной железы у пременопаузных женщин с доброкачественными опухолями *.
Концентрация прогестерона в слюне здоровых пременопаузных женщин во время лютеиновой фазы обычно находится в диапазоне 0,3-0,5 нг/мл. Физиологическая дозировка трансдермальных добавок прогестерона, позволяющая достичь в слюне среднего уровня 0,5 нг/мл, составляет 12-15 мг/сут *. Для этого можно применять как рецептурный, так и самодельный крем, который готовится путём смешивания 900-1'000 мг натурального прогестерона с 60-граммами нейтрального крема. Крем наносится непосредственно на грудь (1 г/сут, т.е. примерно четверть чайной ложки). Наращивание дозировки до этой нормы должно проходить плавно, в течение 2 недель или больше.
Прогестерон (15 мг) быстро всасывается после нанесения на кожу, и через 2-3 ч его пиковые уровни в слюне достигают 12 нг/мл. Через 8 ч его уровень падает на 80 % – до 1,5-3 нг/мл, а через 24 ч – до 0,3 нг/мл *. Если стоит задача избежать резких гормональных скачков, то процедуру можно разбить на 2-3 приёма, беря соответственно меньшую порцию крема.
Трансдермальная форма доставки стероидных гормонов является предпочтительной при лечении женской груди. Исследования в области местной доставки половых гормонов в различные среды организма дают основания полагать, что в этом случае они будут доставляться к тканям преимущественно не через кровеносную систему, а скорее всего, через лимфатическую. Отсюда следует, что местная гормональная терапия будет более полезной для тканей с развитой лимфатической сетью, таких как молочная железа, матка, мозг и иммунная система. В то время как ткани с менее развитой лимфатической сетью (кости и скелетные мышцы) будут меньше затронуты гормональной терапией. С другой стороны, половые гормоны (такие как E2 и Pg), доставляемые местно, будут менее эффективны в стимуляции роста костей при остеопорозе в менопаузе, а тестостерон будет менее эффективен в увеличении мышечной массы при саркопении, вызванной дефицитом андрогенов*.
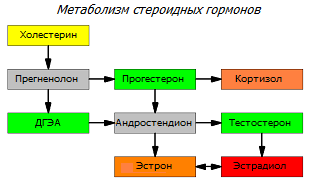
Прогестерон – это гормон-предшественник эстрогена. Из него сначала синтезируются андростендион и тестостерон, а уже их них при помощи фермента ароматаза – эстрон и эстрадиол. Это значит, что при высокой активности ароматазы (что и происходит с возрастом) добавки прогестерона могут вызвать дисбаланс прогестерон:эстрадиол. Отсюда следует вывод, что для успешной гормональной коррекции стоит применять хотя бы слабые (натуральные) ингибиторы ароматазы, такие как гранатовый сок, солодка, гинкго билоба, мелатонин, грибной порошок.
Опять же подчеркнём, что важен не только уровень гормона сам по себе, но и его соотношение с уровнями других гормонов, а также цикличность изменения этих уровней. Пременопаузным женщинам с дефицитом эстрогена прогестерон не назначают. Пременопаузные женщины с избытком эстрогена начинают приём прогестерона на 12 день цикла, и заканчивают приём за 2 дня до планируемого окончания цикла, либо до внезапного его окончания. А постменопаузные женщины принимают его 3 недели в месяц непрерывно, а затем – неделя перерыва *. Если гормональный дисбаланс прогестерон:эстрадиол в пользу эстрадиола незначительный, дозировка крема должна меньше, чем 1 г/сут. А если крем применяется в качестве 2-недельной предоперационной подготовки, дозировка может быть удвоена; и будет лучше, если это придётся на лютеиновую фазу цикла. В любом случае, требуется регулярный контроль уровня обоих гормонов.
Однако чрезвычайно высокий уровень прогестерона (около 186 нг/мл в лютеиновую фазу) так же связан с повышенным риском рака молочной железы, и так же опасен, как и его недостаток *. Прогестерон усиливает экспрессию иммуномодулирующего белка, известного как фактор блокировки, индуцированный прогестероном (PIBF) *. Этот белок в избытке вырабатывается во время беременности, не позволяя иммунным клеткам-убийцам уничтожить плод. Таким образом, чрезмерное количество прогестерона будет подавлять активность иммунных NK-клеток, способствуя росту опухоли. Это ещё раз подчёркивает необходимость постоянного лабораторного контроля за адекватным уровнем и балансом основных половых гормонов.
Известно небольшое количество растений с прогестогенной активностью, которая, правда, невысока и очень слабо изучена *.
• Красный клевер (Trifolium pratense) и его этаноловый экстракт, как сообщалось, проявляет слабый прогестагенный эффект *. Видимо, это связано с тем, что присутствующий в нём кемпферол является частичным агонистом PR.
• Витекс (Vitex agnus-castus) содержит в небольших количествах апигенин, который, похоже, имеет прогестагенный эффект *, подтверждённый в опытах на обезьянах * *.
Специальные исследования показывают, что натуральный прогестерон, в противоположность его синтетическим формам (прогестины), не способствует раку молочной железы, а наоборот, защищает от него *. Причём, похоже, он подавляет инвазию и миграцию раковых клеток молочной железы независимо от их статуса рецептора прогестерона *. Кроме того, прогестерон также может быть полезен в профилактике сердечно-сосудистых заболеваний и нейродегенеративных состояний, таких как инсульт.
Сочетание в ГЗТ эстрогена с прогестероном несёт меньший риск рака груди, чем эстроген сам по себе; однако, в любом случае длительная ГЗТ (более шести лет) может нести этот риск *.
Прежде, чем приступать к компенсации дефицита прогестерона путём применения добавок, разумным будет попытаться нормализовать гормональный баланс естественными средствами, такими как снижение воздействия токсинов и стресса; умеренные физические нагрузки; качественный сон; здоровое питание (высокое потребление углеводов и клетчатки, низкое потребление жиров и животных белков). Важное значение имеет эмоциональное состояние. С усилением стресса растёт уровень кортизола, а поскольку кортизол синтезируется из прогестерона, хронический стресс истощает прогестерон *. Для снижения негатива хронического стресса рекомендуется релаксация.
Тестостерон (Т) – основной андроген не только у мужчин, но и у женщин, хотя у женщин уровень тестостерона значительно ниже. Так же, как эстрадиол и прогестерон, тестостерон у женщин вырабатывается в яичнике, и обеспечивает баланс между эстрогеном и андрогеном *. Добавление тестостерона к эстрогену заметно снижает соотношение ERα:ERβ; * а поскольку ERα активирует ряд генов, связанных с пролиферацией эпителия молочной железы, это уменьшает риск рака молочной железы *.
Высокий уровень андрогена у здоровых женщин настолько сильно подавляет пролиферацию молочной железы, что может вызывать её атрофию, которая наблюдается у спортсменок * и транссексуалов *, принимающих высокие дозы добавок андрогенов. Избыток андрогена также вызывает синдром поликистозных яичников, хотя относительный риск рака молочной железы может при этом снижаться вдвое * *. И наоборот, подавление андрогенов у мужчин ассоциируется с гинекомастией *, а мутации в андрогеновом рецепторе вызывают у них рак молочной железы *. Установлено также, что сочетание антиэстрогена (тамоксифен) с андрогеном (флюоксиместерон) повышает эффективность антиэстрогена и тормозит развитие заболевания по сравнению с одним лишь антиэстрогеном * *. Такие наблюдения дают основания предположить защитную роль биодоступных андрогенов в противодействии пролиферативному воздействию эстрогенов на ткани молочной железы * *.
Серьёзное падение уровня тестостерона начинает проявляться у женщин уже в 30-летнем возрасте * и усиливается к менопаузе, что ассоциируется с возрастным повышением риска рака молочной железы. На 30-летний возраст приходится рост заболеваемости гормоночувствительным раком молочной железы, в то время как рост заболеваемости другими видами рака приходится, в основном, на 50-летний возраст.
В постменопаузе в слюне женщин с раком молочной железы, по сравнению со здоровыми женщинами того же возраста, значительно ниже как уровень DHEA-S, так и уровень свободного тестостерона (соответственно, на 17,2 % и 15,5 %) *. Таким образом, баланс эстроген:андроген у них смещён в пользу эстрогена. При современном лечении симптомы менопаузы и недостаточности яичников обычно корректируются добавками только эстрадиола и прогестерона, без учёта тестостерона, что, возможно, не обеспечивает адекватный баланс эстрогена и андрогена.
Дефицит тестостерона является проблемой, по большей части, постменопаузных женщин. Однако и некоторые другие женщины могут испытывать повышенную потребность в экзогенном тестостероне. Например, принимающие высокую дозу метформина (1'500 мг/сут) *. Метформин снижает уровень эстрадиола, однако делает это, в основном, за счёт снижения уровня его предшественника – тестостерона *.
Существует естественное опасение, что при раке груди тестостерон может действовать контрпродуктивно, поскольку при помощи ароматазы он будет превращаться в эстрадиол. Но, похоже, этот риск зависит от статуса менопаузы. У женщин в пременопаузе повышенный уровень тестостерона не связан с повышенным риском развития рака молочной железы. Но у женщин в постменопаузе, которые страдают от истощения эстрогена и имеют повышенную активность жировой ароматазы, более высокий уровень тестостерона связан с более высоким риском рака молочной железы *.
Действительно, опрос постменопаузных женщин обнаружил 248 %-ное увеличение заболеваемости у использовавших комбинацию эстрадиола с тестостероном, и 15 %-ное увеличение заболеваемости у использовавших один только эстрадиол, по сравнению с теми, кто вообще не использовал заместительную гормонотерапию *.
В противоположность этому наблюдению, манипулятивное исследование на пременопаузных приматах показало, что тестостерон на 40 % уменьшал пролиферацию, вызванную эстрадиолом, в то время как прогестерону это не удавалось *. И наоборот, блокада рецепторов андрогена у нормальных самок приматов приводила к увеличению пролиферации эпителия молочной железы более, чем в 2 раза. При этом добавки небольших физиологических доз тестостерона к стандартной эстрогенной терапии почти полностью ослабляли вызванную эстрогенами пролиферацию *. Исследователи обратили внимание на то, что для успеха гормонозаместительной терапии следует одновременно использовать все три эти гормона, но не один или два из них.
Манипуляционное исследование с участием постменопаузных женщин показало аналогичные результаты. В то время, как гормонозаместительная терапия эстроген/прогестин значительно увеличивала пролиферацию эпителия молочной железы, добавки тестостерона отменяли этот эффект *.
Для выяснения влияния концентрации в сыворотке различных половых гормонов на риск рака молочной железы было проведено несколько широкомасштабных исследований. В сравнении пяти групп постменопаузных женщин с различными концентрациями гормонов в сыворотке, между группами с наибольшей и наименьшей концентрацией наблюдалось значительное увеличение риска рака молочной железы при более высоких абсолютных значениях андрогенов (DHEA-S, андростендион, тестостерон) и эстрогенов (эстрон, эстрадиол); а особенно свободного эстрадиола (в 2,3 раза) и свободного тестостерона (в 2,5 раза) * * * *. Исследователи согласились с тем, что на уровне ткани развитие опухоли молочной железы может быть обусловлено в бо́льшей степени избытком эстрогена, чем андрогена. Но в противоположность этому согласию, их заключение категорично гласило, что "наши данные дают убедительные показания против использования андрогенов в постменопаузальной гормональной терапии".
Между тем, ткань молочной железы обладает ароматазной активностью *, на месте превращая тестостерон в эстрадиол. Поэтому отмеченная в упомянутых выше исследованиях ассоциация между высокими уровнями тестостерона и риском рака может скорее отражать увеличение уровня эстрогена при увеличении уровня андрогена, т.е. отражать активность ароматазы. Там же, где учитывались эстрогены, связи между тестостероном и раком груди не было обнаружено *.
К сожалению, вся эта огромная работа была сфокусирована на сравнении абсолютных значений гормонов в сыворотке, игнорируя сравнение соотношения их значений в том месте, которое нас интересует – в ткани. Тем не менее, даже сывороточные показатели могут многое сказать о риске заболеваемости в постменопаузе. В исследованиях, где данные были открытыми, и позволяли сравнивать абсолютные значения, в группах «случай» по сравнению с группами «контроль» наблюдалось увеличенное в среднем на 7 % соотношение эстрадиол:тестостерон в сыворотке * * * * *.
Аналогичная обширная работа была проведена относительно женщин в пременопаузе. Здесь прогестерон и тестостерон, в отличие от других гормонов, практически не оказывали влияния на заболеваемость *. Однако соотношения гормонов здесь также не были рассмотрены. Но изучение открытых данных работ по этой теме также дают в среднем 7 %-ный перевес соотношения эстрадиол:тестостерон в сыворотке в группе «случай» против группы «контроль» * * * *.
Многонациональное исследование также показало, что кроме DHEA-S и тестостерона, остальные половые гормоны проявляют у постменопаузальных женщин значительную линейную ассоциацию с раком молочной железы. Здесь женщины, у которых в среднем через 3 года был диагностирован рак груди, имели соотношение эстрадиол:тестостерон на 17 % выше, чем здоровые женщины контрольной группы *. Разница соотношений в ткани, таким образом, должна быть ещё выше * *.
В других клинических исследованиях также не было обнаружено негативной связи физиологических доз тестостерона (до 300 мкг/сут) с риском рака у постменопаузных женщин * *. В 6-месячном клиническом исследовании, в группе постменопаузных женщин, применявших трансдермальный тестостерон (300 мкг/сут) дополнительно к комбинации эстрадиола (2 мг/сут) и синтетического прогестерона (1 мг/сут), почти полностью останавливалась пролиферация клеток молочной железы, в то время как в группе без дополнения тестостероном рост клеток увеличивался в 5 раз от исходного уровня *. Постменопаузные женщины, принимающие добавку тестостерона (300 мкг/сут трансдермально), получают также значительное улучшение качества жизни по таким показателям, как психологическое самочувствие и сексуальная жизнь *.
Систематический обзор публикаций показал, что использование трансдермального тестостерона у женщин в постменопаузе не увеличивает заболеваемость раком молочной железы *. Для окончательного развеяния опасений, можно сочетать тестостерон с ингибиторами ароматазы. Наилучшим способом доставки будет, видимо, имплантирование капсул с тестостероном. Это позволит избежать его попадания в другие части тела через общий кровоток с вызовом нежелательных побочных эффектов, а также позволит избежать связывания свободного тестостерона печенью.
Выполняемое каждые 3 месяца подкожное имплантирование в грудь 2 капсул с комбинацией тестостерона (120 мг) и ингибитора ароматазы (анастразол, 4-8 мг) значительно снижает и даже реверсирует рост ER+/PR+/AR+-опухолей молочной железы *. Три имплантанта (по 60 мг тестостерона и 4 мг анастразола) за 46 дней терапии уменьшили у пациентки объём AR+/ER+/HER2–-опухоли в 7 раз, а за 13 недель – в 12 раз *. Аналогичный регресс опухоли в течение 4 месяцев наблюдался у пациентки вследствие имплантирования тестостерона с анастразолом – другим ингибитором ароматазы *. У пожилых женщин, которые придерживались данной терапии в качестве профилактики, заболеваемость была более, чем в 3,5 раза ниже ожидаемого уровня *. Расчётная дозировка тестостерона, выпускаемая капсулой в течение 100 дней, составляла здесь примерно 20 мкг/кг, или 1'500 мкг/сут. Из-за этого уровень тестостерона в сыворотке у пациенток был в несколько раз выше физиологического уровня, и тем более выше начального уровня *.
Сообщалось также об успехах в лечении одним лишь тестостероном прогрессирующего метастатического рака молочной железы, который приобрёл устойчивость к гормонотерапии. Здесь дозировка была значительно ниже: пациенты получали внутримышечно пропионата тестостерона (250 мг два раза в четыре недели, а затем регулярно один раз в четыре недели). У 41,5 % пациентов заболевание продолжало развиваться, у 41,5 % оно стабилизировалось, у 15 % был отмечен частичный регресс, и у 2 % – полный регресс *. Выживаемость пациентов в среднем была увеличена на 1 год. Тем не менее, с тестостероном существует та же проблема, что и с другими гормонами – клетки способны вырабатывать нечувствительность к нему, тем самым снижая со временем эффективность гормонотерапии.
Как и в случае с другими половыми гормонами, для выяснения необходимости добавок тестостерона и для определения их дозировки, необходимо знать его текущий уровень в крови. Женщинам репродуктивного возраста, не испытывающим дефицита тестостерона, или женщинам, имеющим противопоказания, его добавки не рекомендуются *. Кроме того, следует знать профиль гормональных рецепторов опухоли, потому что многие виды рака молочной железы экспрессируют рецептор андрогена *, в том числе такие, которые не имеют рецепторов эстрогена или прогестерона (TNBC-опухоли) * *. Для пациентов с такими опухолями может быть рассмотрено лечение ингибиторами андрогенного рецептора, а не лечение тестостероном.
Производство тестостерона у репродуктивной женщины составляет 300 мкг/сут; т.о. при подтверждённом умеренном дефиците тестостерона у постменопаузных женщин, дозировки в 150 мкг/сут может быть достаточно для его ликвидации. При этом было бы полезным сочетать приём тестостерона с натуральными ингибиторами ароматазы, присутствующими в пищевых продуктах. Для женщин с избыточным весом в постменопаузе одним из таких ингибиторов может быть метформин (500 мг/сут).
Тестостерон, точно так же, как и эстрадиол, эстрон и прогестерон, обычно используется местно, но не внутрь *. Трансдермальная доставка обеспечивает высокую биодоступность свободного тестостерона. Сублигвально тестостерон всасывается примерно на 99 % – так же, как и местно применяемый тестостерон в растворе диметилсульфоксида; в то время как из трансдермального крема тестостерон всасывается лишь на 20 % – так же, как и тестостерон, принимаемый внутрь.
Для приготовления тестостероновой мази смешивается 10 мг инъекционного энантата тестостерона (75 % фактического тестостерона) с 30 г касторового масла и 25 мл 99 %-ного диметилсульфоксида *. Наносится 1 г утром 5 дней в неделю – на грудь при проблемах с молочной железой, или на вагину для предупреждения атрофии влагалища. Но конечно, перед тем, как начать использовать тестостерон, точно также, как и любой другой половой гормон, следует убедиться в дефиците свободного тестостерона, а затем сделать поправку дозировки на его текущий уровень и на массу тела.
Дегидроэпиандростерон (DHEA) – т.н. «гормон долголетия», вырабатывающийся в надпочечниках. Это гормон-предшественник эстрогена и андрогена; и примерно половина всего андрогена производится у женщин именно из этого гормона *. DHEA проявляет противоопухолевый эффект * *, в частности, подавляя пролиферацию и миграцию клеток *, включая клетки молочной железы * * *, о чём свидетельствуют многочисленные доклинические и наблюдательные исследования *. И наоборот, более низкие уровни DHEA ассоциируются с некоторыми видами рака, в том числе с раком молочной железы *.
Преимущество DHEA перед другими андрогенами заключается в том, что в физиологических дозах он превращается в андрогены и/или эстрогены только в опредёленных интракринных тканях-мишенях, обладающих соответствующим физиологическим ферментативным механизмом. Благодаря этому, действие DHEA ограничивается только этими тканями, оставляя другие ткани без изменений. И, таким образом, сводя к минимуму потенциальные побочные эффекты, наблюдаемые у женщин в пременопаузе при системном введении андрогенов или эстрогенов *.
По мере старения организма, производство эстрогена и андрогена в периферических клетках-мишенях падает по причине снижения синтеза надпочечниками DHEA и DHEA-сульфата (DHEA-S). Во время менопаузы это снижение достигает в среднем 70 % *, и продолжается дальше вплоть до 95 %, хотя с большим разбросом показателей у различных женщин *. Если в репродуктивном возрасте в организме женщины производится 8-16 мг/сут DHEA, в пременопаузе – 6-8 мг/сут, а в постменопаузе – уже 2-5 мг/сут и даже ниже *. Причины этого пока неизвестны. Для восполнения недостатка эстрогена ткани усиливают местную экспрессию ароматазы, что позволяет им синтезировать недостающий эстроген из андрогена *.
Проблема с DHEA в том, что, в отличие от других гормонов, не существует внутренней обратной связи, регулирующей его уровень. По крайней мере, не известен внутренний механизм, который бы стимулировал увеличение выработки DHEA, когда его уровень падает *. Это значит, что при дефиците DHEA лишь экзогенные добавки могут вывести его уровень до требуемого значения.
Многие основные симптомы менопаузы могут быть быстро ослаблены местным применением DHEA без риска, связанного с воздействием эстрогенов *. Преимущество DHEA перед другими андрогенными гормонами в том, что он превращается в другие гормоны только в тканях, обладающим соответствующим ферментативным механизмом, не оказывая негативных побочных эффектов на другие ткани. То есть, добавки DHEA могут быть более безопасны, чем добавки прогестерона, и тем более тестостерона, которые проявляют эффект во всех тканях, имеющих рецептор андрогена. Например, пероральный приём 50 мг/сут DHEA в течение 6 месяцев не произвёл у женщин в постменопаузе никаких негативных изменений в толщине эндометрия * из-за отсутствия там ароматазы, превращающей DHEA в эстрогены * *. Местное применение 6,5 мг/сут DHEA не смогло остановить атрофию эндометрия у постменопаузных женщин *, однако облегчало другие менопаузальные симптомы *.
В нескольких экспериментальных исследованиях было обнаружено, что повышенный уровень эндогенного DHEA-S не увеличивает риск рака груди, в отличие от остальных половых гормонов. Некоторые из них даже показали, что в пременопаузе уровни DHEA или его сульфата обратно пропорционально связаны с риском развития рака молочной железы * *. С другой стороны, сообщалось, что когда производство DHEA в разных частях тела чрезвычайно низкое, это может указывать на наличие злокачественной опухоли где-то в организме *.
Иногда DHEA рекомендуется людям после 60 лет в качестве противо
С годами синтез половых гормонов у человека перемещается из эндокринных желёз в периферийные ткани *. А после менопаузы, когда производство эстрадиола в яичниках прекращается, эстрогены почти полностью вырабатываются локально из DHEA и DHEA-S, получаемых из надпочечников *. Введение 4×400 мг DHEA перорально в течение месяца показало повышение уровня как эстрогена, так и андрогена в сыворотке у постменопаузных женщин *.
DHEA можно вводить 1 раз в сутки *. Добавки DHEA также значительно снижают уровни про-воспалительных молекул (TNF-α и IL-6) у пожилых людей *, уровень холестерина в сыворотке у постменопаузных женщин *, уменьшают массу брюшного жира и улучшают толерантность к инсулину *. При пероральном применении у женщин увеличивается концентрация тестостерона, эстрона и эстрадиола, а при трансдермальном – в основном, эстрона и эстрадиола *.
Интересно, что из всех других половых гормонов, DHEA-S в наименьшей степени увеличивал риск рака молочной железы в постменопаузе при удвоении его концентрации в крови *. Это делает DHEA перспективным кандидатом для гормональной коррекции постменопаузных женщин вместо комбинации экзогенных эстрадиола и тестостерона. Хотя, возможно, его применение потребует также низкодозовой комбинации с ингибиторами ароматазы.
Гормоны щитовидной железы. Более высокие концентрации общего Т4 в сыворотке ассоциируются с раком груди как в пременопаузе, так и в постменопаузе, однако у женщин в пременопаузе эта связь проявляется вдвое сильнее. При этом у женщин в пременопаузе пагубный эффект T4 снижается по мере роста индекса массы тела, тогда как у женщин в постменопаузе наблюдается обратная картина.
Более низкие концентрации Т3 также ассоциируются с раком груди, однако защитная роль Т3 более выражена в пременопаузе, чем в постменопаузе. Значимых ассоциаций с какими-либо другими параметрами функции щитовидной железы (TSH, Tg, Tg Ab или TPO Ab) обнаружено не было *.
Для поддержки здоровья щитовидной железы во многих случаях могут быть полезны следующие добавки.
• Йод (5 мг/сут). Дефицит йода, который наблюдается практически во всех странах Европы *, ведёт к дисфункции щитовидной железы. Йод является основным элементом щитовидной железы; он необходим для синтеза гормонов щитовидной железы, а также помогает регулировать уровень гормона стресса кортизола * и способствует нормальной иммунной функции лейкоцитов и фагоцитов *. Органическим йодом богаты морепродукты, особенно морские водоросли. Из растительных продуктов рекордсменом по содержанию йода являются плоды Фейхоа (Feijoa sellowiana).
• Селен (600 мкг/сут). Компонент фермента, трансформирующего Т4 в Т3. Воспаление, как и высокий уровень оксидантов снижает содержание селена в щитовидной железе. Самый богатый источник органического селена – бразильский орех; за ним идут морепродукты.
• Цинк (25 мг/сут) * *, медь и железо *. Дефицит и/или дисбаланс этих металлов может вызвать неэффективную регуляцию гормонов щитовидной железы. Адекватное потребление овощей способно в значительной мере ликвидировать их дефицит, а пищевое разнообразие – их несбалансированность.
• Витамин D3 (2'000-4'000 МЕ/сут). Широко распространённый дефицит витамина D увеличивает риск аутоиммунных заболеваний щитовидной железы *.
• Витамин Е (15 мг/сут). Может помочь уменьшить окислительный стресс, связанный с недостаточностью щитовидной железы *.
• Витамин А (25'000 МЕ). Дефицит ретиноевых кислот вызывает дисфункцию щитовидной железы *.
• Витамин В12 (3 мкг/сут). Дефицит витамина В12 сопровождается заболеваниями щитовидной железы *.
• Дегидроэпиандростерон (DHEA) и прегненолон. Обычно оба эти гормона дефицитны у пациентов с недостаточностью щитовидной железы *.
• Натуральные источники, улучшающие функцию щитовидной железы и уровень гормонов, связанных с щитовидной железой: куркума (1 г/кг пищи) и другие антиоксиданты *; смола мирра (экв. 1'250 мг/сут) *;родиола *; женьшень (500 мг/сут экстракта) * * и ашвагандха (500 мг/сут экстракта) *. У пациентов с субклиническим гипотиреозом экстракт корня ашвагандхи (600 мг/сут) за 8 недель приёма значительно улучшал уровни сывороточного ТТГ, Т3 и Т4 по сравнению с контролем *.
Регуляторы серотонина. Серотонин (5-НТ) регулирует эпителиальный гомеостаз в молочной железе через ряд рецепторов. Нарушение регуляции передачи сигналов серотонина негативно влияет на опухоль молочной железы, усиливая пролиферацию клеток и повышая устойчивость к апоптозу *.
• Цимицифуга (Actaea racemosa, Cimicifugae racemosae) в низких и средних дозах не проявляет ни конкурентного связывания с рецепторами эстрогена, ни регуляции эстроген-индуцируемых генов *. Подавляющее число клинических исследований сообщает об отсутствии изменений или о незначительном снижении уровня эстрадиола в сыворотке в связи с приёмом цимицифуги *.
Тем не менее, приём эстракта корневища цимицифуги может заметно смягчить у значительного числа женщин психо-вегетативные симптомы менопаузы, такие как приливы * *, и снизить риск рецидива у пациентов, принимающих тамоксифен *. Некоторые исследования обнаружили также благоприятное воздействие цимицифуги на костную ткань * *. Изопропаноловый экстракт цимицифуги in vitro подавляет пролиферацию, а не стимулирует её *, а этаноловый экстракт подавляет активность ароматазы в раковых клетках молочной железы (MCF-7) *. Цимицифуга имеет сильный профилактический эффект у женщин в отношении рака молочной железы *, а после антираковой терапии втрое увеличивает длительность периода без болезни до рецидива *.
В отличие от тамоксифена, цимицифуга не оказывает негативных эстрогенных эффектов ни в матке, ни в молочной железе * * *, и не оказывает неблагоприятного влияния на печень *. Сумма накопленных данных свидетельствует, что действие цимицифуги происходит за счёт гормональной регуляции через головной мозг; в частности путём управления серотонином *, а также дофамином, норадреналином и гамма-аминомасляной кислотой *. Эффект действия начинает проявляться не сразу, а через несколько недель приёма. Дозировка: 40 мг/сут сухого растительного сырья, что эквивалентно 4-8 мг сухого экстракта *, но не более.
Несмотря на это, цимицифуга остаётся одним из самых спорных средств, применяемых при раке груди, и до сих пор окончательно не ясна безопасность его использования.
• Валериана (Valeriana officinalis) широко используется для облегчения засыпания и улучшения качества сна. Хотя действующие вещества валерианы не были определены, сообщалось, что экстракт корня валерианы влияет на дофаминовый * и серотониновый механизмы *, и может быть эффективным для смягчения симптомов менопаузы у женщин, особенно снижения частоты приливов и ночной потливости *. Дозировка сухого корня валерианы в клинических исследованиях составляла 765 мг/сут *, и не показывала никаких негативных побочных эффектов.
Регуляторы гормонов стресса. Организм реагирует на стресс моментальным выбросом адреналина и норадреналина, что увеличивает частоту сердечных сокращений, кровяное давление и обостряет внимание, позволяя лучше отреагировать на угрозу жизни. Однако хронический стресс удерживает аномально высокий уровень этих гормонов даже в отсутствие опасности. Активация гормонами соответствующих клеточных рецепторов приводит к тому, что клетки теряют способность сдерживать деление, и таким образом увеличивает риск рака *.
Стресс стимулирует надпочечники выделять большое количество кортизола. Кортизол способен влиять на производство других гормонов, например, пролактина и эстрогена. Пролактин может вызывать болезненные ощущения в молочных железах, а о вреде избытка эстрогена уже было сказано достаточно.
Бета-адреноблокаторы – класс препаратов, ослабляющих воздействие адреналина и норадреналина за счёт блокирования рецепторов надпочечников. Диабетики, принимающие бета-адреноблокаторы, имеют риск развития рака на 67 % ниже, чем диабетики, не принимающие их. Причём каждый месяц приёма бета-блокаторов снижает этот показатель на 13 % *. Пациенты, принимающие бета-адреноблокаторы, могут снизить риск смерти от рака молочной железы на 50 % по сравнению с пациентами, не принимающими их *. Кроме того, у женщин, уже использовавших бета-блокаторы на момент постановки диагноза рака молочной железы, общий шанс на выживание был выше на 56 % *.
Пациенты с HER2–-раком молочной железы, принимавшие бета-блокаторы, значительно увеличивали выживаемость без прогрессирования болезни *. Однако, дозировки, использовавшиеся в рассмотренных исследованиях, варьировали в широком диапазоне, что не даёт возможности точно определить рекомендуемую дозу. Поэтому можно отталкиваться от величин, рекомендуемых при других заболеваниях. Для пропранолола это может составлять 80-160 мг/сут, а для карведилола – 12,5-25 мг/сут.
К сожалению, бета-блокаторы способны снижать артериальное давление, а также имеют ряд других побочных эффектов, в том числе они подозреваются в увеличении частоты случаев инфаркта миокарда и инсульта *. Сообщалось также о снижении показателей выживаемости у пациентов, принимавших бета-блокаторы *. Таким образом, необходимость применения и дозировка бета-блокаторов обязательно должны определяться исключительно лечащим врачом.
Самый известный гормон стресса – кортизол. Благодаря кортизолу силы и средства организма бросаются на решение критически возникшей ситуации «бей или беги». Повышается артериальное давление, уровень глюкозы в крови, способность крови к тромбообразованию, увеличивается концентрация липидов в крови. При этом улучшение кровоснабжения мышц и головного мозга происходит за счёт ухудшения кровоснабжения других органов. Кроме того, он ослабляет иммунную защиту. Таким образом, хронически высокий уровень кортизола, как и других гормонов стресса, вреден. К счастью, по мере разрешения критической ситуации уровень кортизола обычно возвращается к исходному.
В нормальных условиях уровень кортизола подвержен суточным колебаниям (подъём в первой половине дня и спад во второй), однако существуют различные нарушения этого цикла. В частности, из-за хронического стресса концентрация кортизола в крови может оставаться на высоком уровне на протяжении чересчур длительного времени. Эффективных натуральных средств, способных регулировать уровень кортизола, пока не известно. Однако для этой цели можно использовать следующие меры:
- избегание, по возможности, источников стресса (токсичные люди, негативная информация и т.п.);
- умеренная, но не сильная физическая нагрузка в первой половине дня (см. раздел «Здоровая нагрузка †»);
- улучшение качества сна (см. раздел «Здоровый сон †»);
- приятная атмосфера – работа в удовольствие, хобби, общение в хорошей компании, приятная музыка, танцы, развлечения, домашний питомец и т.п.);
- создание психологически здоровых отношений с окружающими (семьей, коллегами, приятелями);
- прогулки на природе, просмотр комедий, молитва или медитация.
Другие гормональные регуляторы.
• Кордицепс – мягкая многопрофильная натуральная гормональная поддержка. В частности, помогает стабилизировать уровень кортизола и других гормонов стресса. Увеличивает уровень внутриклеточных антиоксидантных ферментов. Дозировка: 5-20 мл/сут.
• Мелатонин – мощный антиоксидантный и нейрозащитный гормон, который обеспечивает глубокий и качественный сон. Он также регулирует баланс эстрогенов и инсулиноподобного фактора роста IGF-1, подавляет активность ароматазы, противодействует активности эстрадиола. Мелатонин является безрецептурным средством. Дозировка: 3-20 мг перед сном подъязычно. Не рекомендуется длительное применение более 9 мг/сут без предписаний врача.
• Тимохинон - основной компонент семян Нигеллы посевной (Nigella sativa), не влияет на производство гормонов, однако позволяет удерживать тестостерон в свободной форме в сыворотке. Масло семян первого холодного отжима, богатое тимохиноном, очевидно, благодаря его антиоксидантным свойствам, способствует также снижению систолического и диастолического артериального давления, а также снижению уровня сахара в крови натощак, триглицеридов и ЛПВП-холестерина, мочевой кислоты и C-реактивного белка *. Дозировка: 1-3 г/сут масла или 3-5 г семян нигеллы *.
• Бета-ситостерин (beta-sitosterol) – фитостерол, который препятствует превращению тестостерона в дигидротестостерон, блокируя соответствующий фермент (5α-редуктаза). Мужчинам он может быть более полезен, однако и у женщин он позволяет удерживать тестостерон от метаболирования в другие гормоны. Современная диета обеспечивает примерно 80 мг/сут фитостеринов, в то время как японская или вегетарианская диеты – более 340 мг/сут *. Богатыми растительными источниками бета-ситостерина и других фитостеролов являются зародыши зерновых, кунжут, фисташки, миндаль, макадами, семена подсолнечника *.
• Пион (Paeonia lactiflora). Корень растения позволяет снизить уровень ещё одного потенциально канцерогенного гормона – пролактина *. Дозировка: 15 мл (1 ст л) этилового экстракта корня в сутки *.
• Тиоридазин (thioridazine) – антипсихотический нейролептик, избирательно нацеливается на клетки новообразований, и противодействует рецепторам дофамина (DR), которые экспрессируются как в обычных раковых клетках молочной железы, так и в стволовых раковых клетках *. У пациентов с шизофренией, принимавших антагонисты DR, наблюдалось снижение заболеваемости раком прямой кишки, толстой кишки и предстательной железы *. Дозировка: 4×25 мг.
• 8-пренилнарингенин (компонент хмеля) снижает уровень фолликулостимулирующего и лютеонизирующего гормонов *.
Гормональное влияние на женское здоровье остаётся одним из самых мощных, но в то же время самым тонким инструментом, и требует ответственного и профессионального подхода.