Стратегия здоровья.
Организм человека существует не сам по себе, а в гомеостатическом симбиозе с находящимися в нём микроорганизмами, число которых значительно превосходит число всех клеток самого тела, а вес которых составляет около 3 % веса тела. Действительно, нас колонизует огромное количество микроорганизмов, метаболизм которых взаимно связан с нашим. Таким образом, наше здоровье сильно зависит от взаимных отношений клеток хозяина (самого организма) и гостей (чужеродных клеток, естественно присутствующих в нём). Экосистема микроорганизмов, состоящая из бактерий, вирусов, грибов и простейших, обитающих в различных участках тела, называется микрофлора (микробиота).
Гармоничное сожительство хозяина и гостей взаимовыгодно обоим сторонам сделки. Организм обеспечивает микрофлору питательными веществами и благоприятной окружающей средой. В ответ микрофлора помогает формировать защитную слизистую поверхность кишечника и вносит существенный вклад в здоровье человека.
Микрофлора не просто сосуществовала с человеком на протяжении всей его истории. Она также эволюционировала вместе ним. В результате, получили распространение такие штаммы бактерий, которые лучше других заинтересованы в здоровье хозяина, поскольку от этого зависит их выживание. Например, основная масса т.н. «полезных» бактерий вырабатывает короткоцепочечные жирные кислоты, которые кормят клетки кишечника, и обладают противо
Подавляющая масса микроорганизмов-гостей сосредоточена в толстой кишке. Однако состояние её микрофлоры оказывает сильное влияние не только на функции кишечника и иммунной системы, но также и на многие другие отдалённые ткани и органы.
В кишечнике происходит значительная часть деятельности иммунной системы, и именно здесь присутствует более двух третей всех иммунологически активных клеток организма. Связанные с кишечником лимфатические узлы вносят существенный вклад в отражение вторжения патогенов. Кроме них, в иммунной защите принимают значительное участие чужеродные клетки, выстилающие кишечник. Они производят ряд молекул, которые могут нейтрализовать патогенные микроорганизмы *. Микрофлора ЖКТ является основным регулятором работы иммунной системы не только в кишечнике, но также и в других органах *.
Бактерии толстого кишечника ферментируют неперевариваемые углеводы, вырабатывая короткоцепочечные жирные кислоты (SCFA), такие как ацетат, пропионат, бутират * *. А SCFA через свои клеточные рецепторы способны подавлять многочисленные признаки рака, такие как апоптоз, пролиферация, инвазия клеток и экспрессия онкогенов.
Кроме того, кишечные бактерии производят так называемые постбиотики – витамины, органические кислоты, липиды, а также комплексы протеинов и аминокислот. Благодаря этому организм может получать значительную часть микронутриентов, недополученных из пищи. Другие метаболиты (постбиотики) кишечных бактерий могут действовать как эндотоксины или канцерогены и, разносясь по всему телу, глубоко вмешиваться в разнообразные метаболические и сигнальные процессы *.
Полезная часть бактерий кишечника * связывает жёлчные кислоты *, вырабатывает незаменимые аминокислоты *, витамины группы B (B2, B7, B9, B12) и K *, способствует усвоению минералов *, дезактивации токсинов * и канцерогенов *. Вредная часть способна восстанавливать конъюгированные и приготовленные к удалению эстрогены, позволяя им снова попадать в кровь и увеличивать риск гормоно-чувствительных подтипов рака *.
Поддержание разнообразной и процветающей популяции полезных кишечных бактерий помогает сдерживать рост вредных бактерий за счёт их конкуренции за питательные вещества и места колонизации. Установлено несколько убедительных ассоциаций между общими хроническими расстройствами и нарушением бактериального состава и функции кишечника *.
Появляется всё больше уверенности, что кишечные симбионты играют важную, если не решающую, роль в физиологии человека и в развитии самых распространённых хронических заболеваний, включая сердечно-сосудистые, ожирение, хронические инфекции, депрессию, астму, аутизм, рак. Они также могут действовать как эндокринный орган, способный регулировать воспалительные, метаболические и инфекционные заболевания * *.
Кроме того, бактериальное разнообразие играет решающую роль для функции как врожденного, так и приобретённого иммунитета
*.
Наконец, определённые кишечные бактерии могут повышать эффективность некоторых традиционных противо
Нездоровое состояние кишечной микрофлоры является широко распространённой проблемой. Диета современного человека далека как от диеты охотников-собирателей, так и от диеты аграрного общества, что безусловно сказывается на росте заболеваемости «болезней века» *.
Хотя здоровая микрофлора кишечника не является универсальным ответом на все проблемы здоровья, она способна в значительной мере помочь в их решении.
Преобладающими отделами бактерий здоровой микрофлоры двенадцатиперстной кишки являются Firmicutes и Actinobacteria при отсутствии Bacteroidetes, а в тощей кишке преобладают Lactobacillus, Escherichia coli и Enterococci *, что зависит от функционального назначения каждого их отделов кишечника.
Двумя основными отделами бактерий, распространённых в толстом кишечнике, являются грамположительные бактерии Firmicutes (Clostridium, Ruminococcus, Enterococcus, Lactobacillus) и грамотрицательные Bacteroidetes (Bacteroides, Prevotella). На их долю приходится до 90 % всех кишечных бактериальных клеток. Отдел Firmicutes производит бутират, в то время отдел Bacteroidetes производит ацетат и пропионат. Бутират ассоциируют с уменьшением риска рака груди, однако не менее важное значение для здоровья имеет соотношение между этими короткоцепочечными жирными кислотами.
Баланс между этими двумя группами бактерий определяет здоровое состояние кишечника, и всего организма в целом *. Увеличение доли Firmicutes напрямую связано с общим воспалением, ожирением, диабетом и метаболическим синдромом; а увеличение доли Bacteroidetes связано с улучшением общего здоровья и стройностью фигуры *. С другой стороны, увеличение доли Bacteroidetes может вызывать некоторые заболевания кишечника. Оптимальное значение соотношения Firmicutes:Bacteroidetes всё ещё остается предметом спора *.
Остальную часть микрофлоры толстого кишечника образуют, в основном, отделы Actinobacteria (Propionibacterium, Micromonosporaceae) и Proteobacteria (Escherichia, Helicobacter, Rickettsia). Доля каждого конкретного вида кишечных бактерий (бактериальный профиль), несмотря на общую схожесть для каждого органа, незначительно различается от человека к человеку. Эти индивидуальные отличия обычно стабильны, и сохраняются у человека на протяжении всей его жизни. Тем не менее, микрофлора кишечника может несколько различаться у мужчин и женщин из-за влияния половых гормонов *.
Вся эта сложная экосистема сосуществует в хрупком балансе, который может быть легко нарушен, создавая дисбиоз. Главным разрушителем благополучия биосообщества обычно называют антибиотики. Действительно, у женщин, которым в течение 17 лет наблюдения выписали до 25 рецептов на антибиотики, заболеваемость раком груди на 50 % выше, чем у женщин, которые не принимали антибиотики. А у женщин, которым выписали более 25 рецептов – в два раза выше *. Однако на самом деле существуют и многие другие разрушители, включая некоторые лекарства (например, тамоксифен), токсины, инфекции, а также неадекватные продукты питания.
Даже простое изменение состава пищи может вызвать быстрое изменение бактериального профиля. Если растительная пища не ухудшает микробное разнообразие, то животная пища может сделать это довольно быстро *. Например, переход от вегетарианской пищи к плотоядной приводит к изменению состава кишечных бактерий уже через 24 часа *.
Параллельно с такими явлениями, как систематическое преобладание нездоровой пищи, наступление менопаузы, увеличение индекса массы тела, старение и развитие рака, бактериальный профиль кишечника претерпевает патологические изменения, связанные с обеднением видового разнообразия бактерий и изменением их количественного соотношения * * *. Например, количественное соотношение Firmicutes:Bacteroidetes составляет примерно 3:1 у худощавых людей, в то время как у полных людей оно может достигать 30:1.
Дисбиоз ассоциируется также с риском развития различных видов дегенеративных заболеваний, в том числе рака молочной железы *. В частности, рак молочной железы сопровождается таким изменением баланса внутри порядка Clostridiales, как увеличение доли Clostridiaceae (Faecalibacterium) и Ruminococcaceae, и снижение доли Lachnospiraceae (Dorea) *. Наиболее резкое ухудшение видового разнообразия симбионтов наблюдается уже в самом начале развития рака молочной железы (стадии 0-I) *, и по мере развития болезни оно продолжается *.
Снижение количества и ухудшение качественного состава микрофлоры кишечника, вызванные, например, приёмом антибиотиков, увеличивают риск рака молочной железы *. И наоборот, раковые пациенты с бо́льшим видовым разнообразием кишечника демонстрировали более высокую выживаемость без прогрессирования по сравнению с пациентами с низким или умеренным разнообразием микрофлоры *. Таким образом, поддержание богатства микрофлоры кишечника самым благоприятным образом сказывается на общем состоянии всего организма.
Тем не менее, мы не можем обеспечить проживание в кишечнике желанных нам микрорганизмов, если не мы не сможем предоставить им комфортные условия существования, в первую очередь, пищу. Мы можем поддерживать бактериальное здоровье кишечника диетическим путём – за счёт достаточного потребления растительной клетчатки и растительных полифенолов.
Не вызывает удивления тот факт, что для соотношения Firmicutes:Bacteroidetes важным является источник потребляемых белков и жиров *. Эволюционно сложившаяся у приматов диета преимущественно на растительной основе улучшает это соотношение, тогда как диета на животной основе ухудшает его * *. Кроме того, внутри самого отдела Bacteroidetes растительная пища благотворно увеличивает соотношение между родами Prevotella и Bacteroides *.
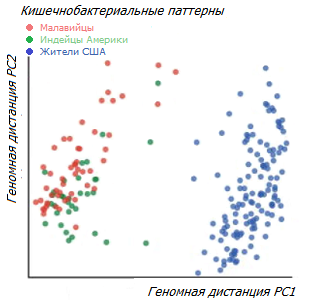
Интересно сравнение данных из микрофлоры кишечника популяций по всему миру, ведущих различный образ жизни – охотников-собирателей, земледельцев, скотоводов, пастухов и городских жителей *. Анализ флорального разнообразия показал, что бактериальный состав кишечника отражает различный образ жизни, представляя собой переход от охотников-собирателей к промышленно развитому населению. Как и ожидалось, население промышленно развитых регионов близко по своему профилю, и отличается меньшим разнообразием кишечных микроорганизмов, чем неиндустриальное население.
Однако в разных категориях неиндустриального населения микрофлора демонстрирует различное видовое разнообразие. В частности, бактериальный профиль скотоводческого и агропастбищного населения, больше похож на профиль городского населения, чем на профиль охотников-собирателей. В то же время профили современных охотников-собирателей, живущих в различающихся между собой географических и природных условиях, больше похожи друг на друга, чем на бактериальный профиль жителей США, находящихся на «западной» диете *.
Фактически, соблюдение диеты, которая поддерживает многообразие и преобладание полезных бактерий кишечника, имеет решающее значение для иммунного здоровья *. Чем больше мы предоставляем пищи нашим кишечным симбионтам, тем лучше условия для их процветания. Чем разнообразнее потребление растений, тем богаче микрофлора кишечника. Поэтому рекомендуется не менее 3 кг 30 различных растений в неделю.
Симбионтам требуются как растворимая, так и нерастворимая клетчатка, поэтому нам следует потреблять не только фрукты, овощи, корни, клубни и стебли, но также цельные зерновые и бобовые, орехи и семена. Это также будет улучшать снабжение организма растительными полифенолами, витаминами и некоторыми химическими элементами. Переход на низкокалорийную вегетарианскую диету может принести пользу кишечнику путём снижения жировой массы тела *.
Дополнительно к изменению своего рациона, мы можем корректировать микробное богатство и разнообразие путём приёма бактериальных добавок – пробиотиков.
Пробиотики, по определению, это непатогенные для человека микроорганизмы, которые, при введении в достаточном количестве, способны формировать здоровую микрофлору органов, а также губительно действовать на патогенные и условно-патогенные бактерии. Для каждого человека, в зависимости от его специфического состояния, могут потребоваться специфические штаммы пробиотиков. Тем не менее, существуют некоторые универсальные штаммы бактерий, одинаково полезные для улучшения общего здоровья большинства людей.
Наибольшее внимание традиционно уделялось Bifidobacterium и Lactobacillus, которые являются доминирующими видами у вскармливаемых молоком детей, но имеют ограниченную ценность у взрослых. Ряд последних клинических исследований выявил безусловную пользу Streptococcus thermophilus, Bifidobacterium longum, Bifidobacterium breve, Bifidobacterium infantis, Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus casei, Lactobacillus bulgaricus. В настоящее время к ним добавились новые перспективные кандидатуры, такие как Ruminococcus bromii, Roseburia intestinalis, Eubacterium rectale, Faecalibactrium prausnitzii. Кроме того выяснилось, что эффективность пробиотиков в укреплении здоровья сильнее зависит от штамма, чем от вида бактерий.
При адекватном рационе нет безусловной необходимости регулярного приёма пробиотиков; однако время от времени к ним приходится прибегать. Например, после очистительных клизм, при расстройствах стула, во время и/или после приёма антибиотиков, при резком изменении рациона (например, в зарубежном турне), при длительном недостатке клетчатки, или вследствие других событий, негативно вмешивающихся в жизнь кишечной микрофлоры. В то время, как нарушение бактериального баланса в кишечнике может быть очень быстрым, его полноценное восстановление может потребовать не менее 2 недель.
Задача пробиотиков не состоит в том, чтобы обеспечить необходимую массу кишечных бактерий; такая цель может быть достигнута лишь достаточным обеспечением пищи для этих бактерий. Задача пробиотиков состит в том, чтобы обеспечить необходимое разнообразие кишечных бактерий; периодический приём пробиотиков поможет постоянно поддерживать адекватный бактериальный профиль кишечника. Однако протиотиками не стоит злоупотреблять без особой на то нужды. Они употребляются в качестве временной меры при дисбиозе точно так же, как фиксация гипсом употребляется в качестве временной меры при переломе кости.
Пробиотики могут иметь специфичную цель, которая не ограничивается здоровьем толстого кишечника. Например, смесь Lactobacillus helveticus Rosell-52 и Bifidobacterium longum Rosell-175, способна значительно улучшать настроение, реакцию на стресс и эмоциональный баланс * *. А Lactobacillus rhamnosus CRL 1505 стимулируют иммунную систему в дыхательных путях и кишечнике *. В общем случае, полученный эффект зависит от бактериального состава пробиотической смеси.
На рынке присутствует большое количество предложений пробиотиков от многих поставщиков. Однако не все они были протестированы и подтверждены как эффективные в клинических исследованиях. Даже многие популярные кисломолочные продукты могут не соответствовать уровню требуемых научных доказательств. Лишь немногие штаммы бактерий могут быть названы настоящими пробиотиками, потому что характер действия каждого штамма так же отличается от остальных, как отличаются между собой характеры породы собак.
Важный совет – приобретать только те пробиотики, которые имеют клиническое подтверждение своей эффективности. Следует убедиться, что присутствующие в пробиотике штаммы микроорганизмов подходит для достижения поставленной цели, а их количество соответствует рекомендованым по результатам клинических исследований.
Для добавок следует выбирать кишечнорастворимые капсулы, содержащие как минимум, 8 различных видов бактерий, при этом каждого из них должно быть не менее, чем 6 млрд. единиц. Многие из них предлагаются в составе готовых бактериальных комплексов:
• Вивокапс форте™ содержит все вышеперечисленные клинически исследованные штаммы бактерий с доказанной эффективностью. Дозировка: 2 капс/сут на протяжении не менее 2-4 недель. Курсы повторяют 1-2 раза в год для поддержания жизнедеятельности микрофлоры, а также каждый раз для её восстановления после приёма антибиотиков, пищевых отравлений, глубоких очищающих клизм, расстройствах пищеварения, изгнания гельминтов и других событий и процедур, негативно влияющих на кишечную микрофлору. Пробиотики обычно сочетают с приёмом витаминов В9 и В12.
• Prescript-Assist™ содержит около 30 почвенных микроорганизмов, типичных для здорового кишечника. Рекомендуется для обогащения бактериального разнообразия. Комплекс показал клиническую значимость при синдроме раздражённого кишечника * *. Дозировка: 2 капс/сут на протяжении от 2 недель до 2 месяцев.
• Лактовит Форте™ содержит споры стойких к антибиотикам лактобактерий Lactobacillus sporogenes в комплексе с витаминами В9 и В12, которые требуются для их развития. Этот комплекс рекомендуется во время и после грубого вмешательства в микрофлору кишечника (антибиотики, патогенные бактерии, клизмы). Одно ограниченное клиническое исследование показало улучшение симптомов у пациентов с дисбиозом через месяц приёма Лактовит Форте *. Дозировка: 2-4 капс/сут на протяжении от 4 до 6 недель.
• БиоГая® Протектис (BioGaia ProTectis) содержит лактобактерию Lactobacillus reuteri, участвующую в формировании микрофлоры не только всего ЖКТ, но также мочевыводящих путей, кожи и молочной железы. Она укрепляет кишечный клеточный барьер, подавляет действие патогенных микроорганизмов и снижает уровень местного воспаления. Хотя имеется ряд публикаций в пользу Lactobacillus reuteri при различных расстройствах ЖКТ, о результатах клинических исследований самой добавки BioGaia не сообщалось. Дозировка: 1-3 таб/сут.
• Буларди™ содержит стойкий к антибиотикам дрожжевой грибок Saccharomyces boulardii, который подавляет патогенные микроорганизмы при расстройствах ЖКТ, а также повышает иммунитет за счёт стимулирования производства иммуноглобулина. Клинические исследования признали грибок безопасным и эффективным для профилактики и лечения желудочно-кишечных расстройств *. Дозировка: 1 пак/сут.
• ЭМ-курунга – комплекс бифидо- (Bifidobacterium spp.) и лактобактерий (Lactobacterium spp.), кисломолочных стрептококков (Streptococcus lactis, Streptococcus cremoris) и дрожжей (Torolopsis). Обладает антагонистической активностью по отношению к хеликобактеру, стафилококку и кишечной палочке. 1 г сухого концентрата или закваски содержит 104 бактерий.
При выборе пробиотика предпочтение отдают сухим лиофилизованным бактериям (ещё лучше – спорам бактерий) в кишечнорастворимых капсулах, поскольку после приёма внутрь им предстоит пройти долгий путь к кишечнику через агрессивное содержимое желудка и двенадцатиперстной кишки.
Многие пищевые продукты также способствуют поддержке бактериального разнообразия кишечника – живой йогурт или кефир, квашеная капуста, чайный гриб, натто, другие живые ферментированные продукты.
Существует принципиальная разница в том, заселяются ли бактерии в стерильную среду, такую как кишечник новорожденного, или же они заселяются в уже существующее сообщество конкурирующих бактерий, которые выстроили свои отношения. В последнем случае, для изменения бактериального профиля может потребоваться сильное и настойчивое вмешательство, потому что сформировавшаяся микрофлора может не принять «новичков».
Опять же, для создания здорового кишечного сообщества микроорганизмов требуется, кроме самих пробиотиков, обеспечение их питательными веществами (пребиотиками). Бактериальный профиль кишечника зависит, в бо́льшей степени, от вносимой в него пищи для бактерий, чем от вносимых в него готовых бактерий. Общий вес кишечных бактерий исчисляется килограммами, в то время как вес принимаемых добавок исчисляется граммами. Таким образом, добавки могут обеспечить разнообразие полезных видов бактерий, но добавки вряд ли смогут существенным образом помочь увеличению количества бактерий, если для их роста нет источника пищи. Однако как только где-то появляется какая-то подходящая пища, вместе с нею появляется колония микроорганизмов, потребляющих её.
Таким образом, снижение калорийности питания * или потребление пищи, богатой пребиотиками (клетчаткой), является регулярной мерой обеспечения здоровья кишечника, в то время как приём пробиотиков – аварийной и корректирующей мерой.
Пребиотики, по определению, это неусваиваемые организмом вещества, которые питают здоровую микрофлору кишечника. Пребиотики осуществляют механическое очищение кишечника, обеспечивают благоприятную среду для размножения кишечных бактерий, связывают канцерогены, ускоряют прохождение пищевой массы по кишечнику, и снижают риск рака груди *. В отличие от прочих компонентов содержимого кишечника, пребиотики способны не просто формировать бактериальный спектр, но также избирательно поддерживать именно полезную часть микрофлоры.
Различные группы бактерий в кишечной среде ведут непрерывную борьбу за выживание и вытеснение конкурентов. Аналогичная картина наблюдается и в других органах со слизистой оболочкой. Щедро обеспечивая питанием бифидо- и лактобактерии, мы предоставляет нашим полезным симбионтам более комфортные условия для процветания и господства. И соответственно, менее благоприятные условия для патогенных микроорганизмов.
Каждый вид бактерий предпочитает какой-то свой источник питания. Поэтому численность и бактериальный спектр кишечной микрофлоры непосредственно зависят от состава принимаемой пищи * *. Бактерии, ассоциированные с высоким риском рака, предпочитают животные белок и жир, и производят сероводород. А бактерии, ассоциированные с низким риском, предпочитают клетчатку, и производят бутират.
Пребиотики – это, главным образом, клетчатка и устойчивый (к действию пищеварительных ферментов) крахмал. Клетчатка бывает водорастворимая (например, овёс, бобовые, орехи, ягоды), и водонерастворимая (например, оболочка злаков).
К растворимой клетчатке относятся пектин, содержащийся в яблоках, моркови, крыжовнике, апельсине, груше, сливе, айве; инулин, содержащийся в злаковых, луке, банане, чесноке, спарже, в корнях топинамбура и цикория; бета-глюкан, содержащийся в зерновой оболочке; камедь и слизи, содержащиеся в смолах деревьев или, например, в овсянке.
К нерастворимой клетчатке относятся лигнин, целлюлоза, фруктоолигосахариды.
Рекомендуемая норма потребления растворимой клетчатки для женщин – от 25 г/сут, а нерастворимой – от 50 г/сут. Реконструкция диеты палеолитического человека показывает, соотношение нерастворимые:растворимые волокна было в ней примерно 1:1 при общем потреблении 150 г/сут *.
Слишком высокое потребление грубой клетчатки может иметь негативные последствия, такие как излишнее раздражение и даже травмирование кишечника, увеличивающие риск рака толстой кишки. Кроме того, избыток клетчатки может снизить поступление в организм таких ценных минералов, как кальций, фосфор, магний и калий – как по причине их связывания и выноса клетчаткой, так и по причине слишком быстрого удаления пищевой массы из кишечника.
Источником клетчатки является растительная пища – цельное зерно и зерновые отруби (пшеничные, ржаные, ячменные, овсяные и пр.); сухофрукты; бобовые; а также молотое льняное семя, которое тормозит рост опухоли за счёт стимулирования дифференцировки клеток и снижения экспрессии факторов роста ILGF и EGF. Клинически установлено, что наиболее полезной является клетчатка, полученная из зерновых *.
Отруби в виде пищевой добавки могут решить сразу несколько задач: обеспечение инозитолом, клетчаткой, микроэлементами и бета-глюканом. Потенциальной проблемой является то, что отруби, как и зерно в целом, могут быть заражены токсинами плесени, пестицидами или другими канцерогенными загрязнителями. Поэтому очень важен выбор надёжного поставщика.
Другой проблемой является то, что отруби зерновых содержат такие лектины, как глютен, который у некоторых чувствительных к нему людей может вызывать воспалительные или аутоиммунные реакции. В этом случае, альтернативой могут быть отруби с низким содержанием лектинов, например, отруби семян подорожника (псиллиум). Менее предпочтительной добавкой клетчатки является порошковый инулин.
Большинство пребиотиков, обладающих способностью стимулировать бифидобактерии, относится к нейтральным углеводам. Наиболее изучены из них фруктоолигосахариды (ФОС), трансгликозилированные олигосахариды (ТОС), соевые олигосахариды (COC), лактулоза. Примерами источников ФОС могут быть топинамбур, цикорий, бананы, инжир, лук.
Ингибиторы проницаемости кишечника. Целостность слизистой оболочки кишечника имеет решающее значение для здоровья. Ослабление кишечного барьера (т.н. «протекающая», или «дырявая кишка») способствует попаданию из кишечника в кровь не только потенциальных токсинов, но и потенциально опасных микроорганизмов.
Это увеличивает как местный, так и общий воспалительный уровень, способствуя развитию или осложнению многих дегенеративных заболеваний включая болезнь Паркинсона, аутизм, сердечно-сосудистые заболевания, метаболический синдром, заболевания почек и печени, диабет II типа, ожирение и другие. Кроме того, кишечные бактерии, проникая в общий кровоток и разносясь далее по всему телу, могут существенно изменить бактериальный профиль других органов.
Проницаемость кишечника может увеличиваться под действием многих факторов, среди которых – старение; лучевая и химиотерапия; инфекции и воспаления; низкий уровень гормонов щитовидной железы; приём антибиотиков, ацетилсалициловой кислоты, витамина C и ингибиторов протонных насосов; недостаток клетчатки, цинка и витаминов А и D; алкоголь, провоспалительная диета и пищевые аллергены.
Для укрепления слизистой оболочки кишечника можно применять деглицирризированный экстракт солодки, кору скользкого вяза и корень алтея. Для восстановление прочности стенок кишечника также помогают витамин D, рыбный жир, полифенолы из экстракта виноградных косточек, L-глютамин (белок, который кормит клетки кишечника).
Метформин при длительном применении вызывает значительные положительные изменения в бактериальном профиле микрофлоры кишечника *, которые сопровождаются увеличением производства бутирата.
Между тем, на здоровый баланс кишечной микрофлоры оказывает влияние не только состав потребляемой пищи. Существует множество других факторов, оказывающих косвенное влияние; например здоровье желудка, печени, поджелудочной и щитовидной железы. Гипотиреоз, так же, как и недостаток соляной кислоты или солей желчных кислот, может вызывать дисбиоз кишечника. И без решения этих проблем здоровья, решение проблемы дисбиоза может оказаться малоэффективным. В организме вообще очень многое взаимосвязано различными механизмами, не всегда явно выраженными.
Бактерии. Долгое время многие ткани организма считались стерильными, и наличие в них любых чужеродных микроорганизмов рассматривалось как заражение. В последнее время эта точка зрения подверглась существенному пересмотру. Практически все слизистые оболочки организма колонизированы бактериями, играющими ту же роль в их заболеваемости, защите и функционировании, что и бактерии в кишечнике. И каждый орган, в том числе, молочная железа, имеет свой специфический бактериальный профиль.
У здоровых женщин и женщин с раком молочной железы бактериальные профили в тканях молочной железы имеют различия. Обнаружено, что каждому подтипу рака молочной железы соответствуют уникальные бактериальные, вирусные, грибковые и паразитарные профили *. При этом ткани ER+- и HER2-опухолей обладают сходными микробными сигнатурами, тогда как TNBC-опухоли демонстрируют широкое разнообразие микробных сигнатур *.
Идентификация микробиома, специфичного для молочной железы, обнаружила, что в ткани здоровой молочной железы, как и в ткани всех четырёх подтипов рака, доминируют такие бактерии, как Proteobacteria, Firmicutes, Actinobacteria и Bacteroidetes. Однако здоровые ткани содержат больше Lactococcus и Streptococcus *. А злокачественные ткани относительно обогащены многими другими, потенциально патогенными микрорганизмами * – Bacillus, Staphylococcus и Enterobacteriacae *. Известно, что популяции Enterobacteriacae и Staphylococcus способны вызывать двойной разрыв цепи ДНК, приводя к геномной нестабильности, подобно тому, как это делает Helicobacter pilori – признанный виновник рака желудка.
Различные виды бактерий могут превращать одно и то же исходное сырьё в различные конечные продукты. Поэтому от исхода межвидовой конкурентной борьбы бактерий, располагающихся на эпителиальном слое протоков и долек молочной железы, зависит состояние её здоровья. Патогенные микроорганизмы способны провоцировать воспаление и проявлять канцерогенные эффекты, в то время как некоторые полезные штаммы бактерий (такие, как лактобактерии) оказывают, наоборот, противо
Изменения бактериального профиля молочной железы и развитие рака в ней идут параллельно. И хотя между ними может существовать взаимное влияние, рак, похоже, является скорее следствием, а не причиной этого. Несмотря на внешнюю незначительность этих изменений, они сопровождаются катастрофическими последствиями.
У нас нет эффективной возможности избирательно снижать уровень нежелательных штаммов микроорганизмов непосредственным путём. Однако у нас есть возможность корректировать бактериальный профиль тканей молочной железы косвенно – через коррекцию бактериального профиля кишечника.
Известно, что обитающие в кишечнике бактерии способны проникать сквозь кишечную стенку в кровь, и достигать отдалённых участков, включая грудь * *, и даже головной мозг. То есть, бактериальный состав микрофлоры кишечника способен влиять на бактериальный состав микрофлоры других органов, и тем самым – на их здоровье и функциональность. Видимо, по этой причине дисбиоз у женщин с раком груди носит системный характер. Нарушения бактериального баланса у них не ограничиваются кишечником, но одновременно затрагивают грудь, мочевыводящие пути * и, по всей видимости, многие другие органы и ткани.
Главным фактором, определяющим разнообразие микроорганизмов в кишечнике и, соответственно, в молочной железе, является диета. В манипуляционном исследовании было обнаружено, что у обезьян на т.н. «средиземноморской» диете численность Lactobacillus в молочной железе увеличивается по сравнению с обезьянами на т.н. «западной» диете. Более того, в молочных железах обезьян, питающихся «средиземноморской» диетой, наблюдались более высокие уровни метаболитов желчных кислот и повышенное количество постбиотиков – биологически активных соединений, произведенных кишечными бактериями * *.
Ряд доклинических исследований на животных показывает
*,
что регулярный приём пробиотиков соответствующего состава может влиять на бактериальный спектр эпителия молочной железы, склоняя его в противо
В одном из наблюдательных исследований было обнаружено, что всего 0,5 стакана в день ферментированных молочных продуктов способны снизить у женщин на треть шанс развития рака молочной железы, по сравнению с контролем, независимо от возраста и всех других факторов риска. А 1,5 стакана (225 г) – наполовину *. Это удивительно, как такое простое и дешёвое вмешательство может вызвать настолько благоприятные последствия.
К сожалению, клинических исследований, посвящённых связи рака молочной железы и потреблению пробиотиков, крайне мало. Однако можно серьёзно предполагать, что приём добавок таких микроорганизмов, как Lactobacillus acidophilus, Lactobacillus Casei, Lactobacillus crispatus, Lactobacillus rhamnosus, Lactobacillus plantarum, Lactoccocus lactis, Enterecoccus lactis, Enterococcus faecalis, Staphylococcus hominis, Streptoccocus thermophilus и Lactobacillus delbrueckii, может корректировать в положительную сторону бактериальный профиль не только молочной железы, но и других органов *.
Многие из этих микроорганизмов входят в состав пробиотических смесей:
• Вивокапс форте™. Многоштаммовый концентрированный пробиотик, содержащий 4×1010 лиофилизованных лакто- и бифидобактерий.
• Бак-Сет Форте™. Многоштаммовый пробиотик. При дозировке 9×1010 бактерий защищает молочную железу от воспалений
*
благодаря иммуностимулирующей бактерии Lactobacillus fermentum и противо
• Probiotic-30™. Многоштаммовый пробиотик компании New Food, содержащий Streptococcus thermofilus и Lactobacillus salivarius.
• Primal Defense Ultra®. Пробиотик, обеспечивающий в каждой капсуле 5×109 бактерий 13 различных видов, включая Saccharomyces boulardii, Lactobacillus plantarum, Bacillus subtilis, Bifidobacterium lactis, Bifidobacterium bifidum, Lactobacillus rhamnosus, Bifidobacterium breve, Lactobacillus casei, Lactobacillus salivarius, Lactobacillus acidophilus, Lactobacillus brevis, Bifidobacterium longum, и Lactobacillus paracasei. Пробиотик проходил клинические испытания с участием женщин с раком молочной железы * (3 капсулы перед сном в течение 4 недель), однако их результаты пока неизвестны.
Можно заметить, что одни те же группы бактерий оказывают своё положительное действие как на кишечник, так и на молочную железу. Таким образом, проявляя заботу о своих кишечных питомцах, мы одновременно оказываем большую услугу и своей молочной железе.
Грибки. Бактерии – не единственная разновидность микрорганизмов, которые колонизируют наши органы. До сих пор основное внимание было приковано к бактериям, в то время как грибкам внимание уделялось очень слабое. Между тем, грибки были обнаружены при 35 типах рака и часто были внутриклеточными. При этом каждый тип опухоли имеет характерный грибковый профиль, а количество и преобладающий тип грибков позволяют прогнозировать клинические исходы болезни *.
Среди всех исследованных опухолей, ранее не подвергавшихся лечению, наибольшее количество грибковых ДНК наблюдалось при раке костей и молочной железы. При примерно равном грибковом разнообразии, в тканях здоровой молочной железы преобладали виды Sporobolomyces roseus, Cladosporium и различные виды Aspergillus, то в тканях доброкачественной опухоли – Yarrowia porcina, Aspergillus glabripes и Aspergillus penicilliodides, а в тканях злокачественной опухоли – Malassezia arunalokkei, Malassezia restrikta и Malassezia globosa. Было обнаружено, что Malassezia globosa коррелирует с более короткой выживаемостью при раке молочной железы *.
Нельзя, конечно, утверждать, что грибки являются причиной опухоли. Однако несомненно, что они занимают важную позицию в микроокружении опухоли и вступают с клетками опухоли и с бактериями опухоли в сложные отношения, от которых зависит развитие болезни. Хотя в количественном отношении грибки уступают бактериям, их роль может быть не менее значительной, чем роль бактерий. Поскольку различные виды грибков вызывают уникальные иммунные реакции хозяина, а некоторые из них способны деактивировать имунные клетки * * *, то их присутствие в опухоли может сделать иммунотерапию неэффективной.
Пока ещё наши знания об активности грибков требуют серьёзного осмысления, каким образом мы можем использовать их для оздоровления ткани молочной железы. Что вынуждает микрофлору груди к деформации видового доминирования; должны ли мы для восстановления нормального грибкового профиля специфически подавлять Malassezia или же принудительно инфицировать Sporobolomyces roseus; каким образом изменение грибкового профиля может повлиять на бактериальный профиль и наоборот; и какой профиль микрофлоры принципиально является наиболее здоровым – на все эти вопросы нам придётся искать ответы в ближайшие годы.