Стратегия здоровья.
Несмотря на то, что нет 100 %-ной гарантии избежать рака груди, некоторые принципы образа жизни могут значительно снизить риск его появления и развития. Как впрочем, и других видов рака. Все профилактические рекомендации принципиально сводятся, в конце концов, всего к двум
*:
А. Избавление от тех факторов риска, от которых возможно избавиться.
В. Компенсация тех факторов риска, которые изменить невозможно.
Экологические меры включают в себя блокировку поступления канцерогенов, их непосредственную нейтрализацию, а также нейтрализацию последствий их деятельности. Постарайтесь максимально избавиться от внешних канцерогенных токсинов, включая сигаретный и автомобильный дым, алкоголь, асбест, ксеноэстрогены, не проверенная на безопасность косметика и бытовая химия т.д. Избавьтесь от алюминия на кухне и от свинца в пломбах зубов.
Питание † должно быть низкокалорийным, но полноценным, т.е. богатым незаменимыми и биоактивными веществами, такими как витамины, минералы, клетчатка и биофлавоноиды. Старайтесь есть то, что вырастили и приготовили сами, а не купили у кого-то. Так легче контролировать качество и состав готовой пищи. Состав пищи должен быть слабощёлочеобразующим, а не кислотообразующим.
Дети могут снизить риск рака молочной железы в более позднем возрасте, максимально сократив в рационе жир и молочные продукты. Для людей любого возраста будут полезны еженедельные одно-двухсуточные посты.
Добавки † для здоровых молодых людей не являются необходимыми при соблюдении всех остальных рекомендаций, особенно диеты. Однако для людей от 40 лет и старше некоторые добавки могут оказаться полезными.
Гормональный профиль † должен быть сбалансированным, даже если абсолютный уровень гормонов низок по причине возраста. Работа и отдых, активность и сон должны совпадать с естественным циркадным циклом.
Противовоспалительные меры † включают в себя повышение уровня антиоксидантных ферментов, нейтрализацию свободных радикалов (натуральные полифенолы, витамины С и Е, другие антиоксиданты) и подавление метаболизма арахидоновой кислоты (глицирретиновая кислота, N-ацетил-цистеин, НПВП, растительные полифенолы).
Иммунитет †. Поддержание адекватной иммунной реакции организма (НПВП, селен, витамин Е).
Нормализация массы тела † помогает снизить риск практически всех болезней. Увеличение индекса массы тела на каждые 5 кг/м2 перед диагностикой связаны с повышением риска общей смертности на 17 % и повышением смертности от рака груди на 18 % *.
Физическая и социальная активность, ритмичный циркадный ритм, адекватный сон повышают уровень витальности.
Духовные практики. Дышите жизнью глубже. Каждый миг неповторим, наполняйте его радостью, а не суетой. Живите здесь и сейчас. Нам дарована жизнь для великих дел, а не для мелких склок. Спешите исполнить своё предназначение. Думайте о Вечности, а не о себе. Смотрите на небеса, а не под ноги. Любите других, как Господь любит вас.
Диагностика не предупреждает болезнь. Тем не менее, более раннее обнаружение опухоли повышает эффективность лечения и улучшает прогноз. Но гораздо важнее не столько обнаружение самой опухоли, сколько обнаружение её причин. Устранение причин приведёт к дальнейшему исчезновению самой проблемы. Держите под контролем все основные показатели здоровья – начиная от кислотности крови и заканчивая воспалительными маркёрами.
Каждый человек, желающий быть здоровым, должен следить за своими основными показателями, перечисленными в разделе «Контрольные показатели» †.
В настоящее время считается, что выполнение самообследования не снижает риск заболевания раком груди, смерти от рака груди или выявления опухолей на более ранних стадиях. Тем не менее, женщинам может быть полезно знать, как правильно проводить контроль состояния груди, в первую очередь – внешний осмотр и пальпацию. Его советуют проводить на 5-6 день от начала менструального цикла, когда молочная железа находится в расслабленном состоянии, а в постменопаузе – в одно и то же число месяца. Кливлендская клиника предлагает следующий порядок самообследования *.
I. Первый этап проверки – это внешний осмотр груди.
1. Станьте раздетой по пояс перед большим зеркалом в хорошо освещённой комнате. Посмотрите на свои груди. Не пугайтесь, если они покажутся неодинаковыми по размеру или форме; абсолютно одинаковых грудей нет. Расслабив руки по бокам, обратите внимание на любые изменения размера, формы, текстуры или кожи груди. Ищите любые язвы, любые сморщивания, ямочки или обесцвечивание кожи. Осмотрите свои соски и поищите любые язвы, шелушение или изменения в области сосков.
2. Затем положите руки на бедра и крепко надавите, чтобы подтянуть грудные мышцы под грудью. Поворачивайтесь из стороны в сторону, чтобы осмотреть грудь снаружи.
3. Наклонитесь вперёд к зеркалу. Сведите плечи и локти вперёд, чтобы напрячь мышцы груди. Ваша грудь упадёт вперёд. Ищите любые изменения в форме или контуре вашей груди.
4. Теперь сложите руки за голову и вытяните руки вперед. Ещё раз, поворачиваясь из стороны в сторону, осмотрите внешние части вашей груди. Не забудьте осмотреть границу под вашей грудью. Возможно, вам придётся поднять грудь рукой, чтобы увидеть эту область.
5. Проверьте соски на наличие жидкости.
Поместите большой и указательный пальцы на ткань, окружающую сосок, и потяните наружу к концу соска.
Ищите любые выделения. Повторите процедуру на другой груди.
II. Второй этап проверки – это пальпация.
6. Чтобы почувствовать комки, используйте чувствительные подушечки средних трёх пальцев левой руки, а не кончики пальцев. Хорошо, если ваши пальцы будут скользкие от мыла и воды.
7. Проверьте обе груди на наличие комков или утолщений под ключицей. Мягко нажимая подушечками пальцев, круговыми, растирающими движениями ощупайте грудь, выискивая комочки. Проверьте наличие комков или утолщений в области подмышек. Положите левую руку на бедро и вытяните правую руку, чтобы почувствовать левую подмышку. Повторите процедуру на другой стороне.
8. Поддерживайте грудь одной рукой, в то время как другой мыльной рукой прощупайте ткань. Используйте плоскую часть пальцев, чтобы аккуратно надавить на грудь. Следуйте рисунку вдоль груди вверх-вниз, двигаясь от линии бюстгальтера к ключице. Продолжайте, пока не пройдёте всю грудь. Повторите процедуру на другой стороне.
9. Затем лягте и положите небольшую подушку или сложенное полотенце под правое плечо. Положите правую руку за голову. Положите левую руку на верхнюю часть правой груди, сложив пальцы и плоско. Исследуйте правую грудь левой рукой. Лосьон для тела может помочь облегчить пальпацию. Надавливайте достаточно сильно, чтобы почувствовать различные ткани молочной железы, используя следующие три различных техники. Во-первых, лёгкое давление, чтобы просто двигать кожу без толкания ткани ниже неё, затем среднее давление – на полпути в ткань, и, наконец, чтобы прощупать глубже до рёбер – глубокое давление, до момента чуть слабее ощущения дискомфорта.
10. Представьте свою грудь в виде табло на циферблате часов. С шагом в мелкую монетку, не отрывая пальцев, начните с самого внешнего края груди и двигайтесь по спирали к соску.
Начните с 12 часов и двигайтесь к 1 часу маленькими круговыми движениями. Продолжайте движение по всему кругу, пока снова не достигнете 12 часов. Держите пальцы плоскими и в постоянном контакте с грудью. Когда круг завершится, продвиньтесь на пару сантиметров к соску и совершите следующий полный круг, и так далее, пока вся ваша грудь не будет прощупана. Обязательно пальпируйте верхние наружные области, которые простираются в вашу подмышку.
11. Полностью прощупайте всю грудь и область грудной клетки под мышкой, вплоть до ключицы и полностью до плеча, чтобы покрыть отходящую в этом направлении внешнюю часть молочной железы. Положите пальцы прямо и прямо на сосок. Поищите любые изменения у себя под соском. Аккуратно вдавите сосок внутрь. Он должен двигаться легко. Повторите шаги 9, 10 и 11 на другой груди.
При обнаружении каких-то описанных ниже изменений, следует обратиться к врачу.
• Область, которая заметно отличается от любой другой области на любой груди.
• Комок или утолщение в груди или под грудью или около нее, которое сохраняется в течение менструального цикла.
• Изменение размера, формы или контура груди или состояния соска.
• Ощущаемая масса или комок размером с горошину.
• «Мраморная» область под кожей.
• Изменение внешнего вида груди или внешнего вида кожи на груди или соске (с ямочками, морщинистыми, чешуйчатыми или воспалёнными – красными, тёплыми или опухшими).
• Кровавые или прозрачные выделения из соска, которые можно также увидеть на белье.
• Покраснение кожи на груди или соске.
Появление любых уплотнений в груди говорит о её неблагополучии. Более 80 % комочков не являются раковыми, тем не менее, вам стоит достоверно убедиться в этом, чтобы не упустить момент образования раковой опухоли.
Женщинам от 20 до 40 лет рекомендуется делать УЗИ каждый год, а женщинам после 40 лет – маммографию каждые два года, если какие-то либо патологии отсутствуют (насчёт необходимости и частоты маммографии существуют споры). Если же имеются каких-то патологии, то в течение первых двух лет после её обнаружения осмотр специалистом проводится дважды в год.
Все профилактические обследования молочной железы рекомендуется проводить в первой фазе цикла, начиная с 5 дня, но не позже 12 дня цикла. В эти дни ткань молочной железы наименее чувствительна к воздействию посторонних факторов.
Образ жизни. Хотя ранняя диагностика помогает раньше обнаружить опухоль, она не может снизить риск появления рака. Спасением является не диагностика, а профилактика, здоровый образ жизни, ответственное отношение к своему телу. Правила здорового стиля жизни должны быть возведены в привычку. Придерживайтесь правил, изложенных в разделе «Укрепление витальности» †.
Не менее важно знать, дефициты каких незаменимых веществ и минералов испытывает организм, чтобы можно было компенсировать их за счёт коррекции структуры питания, а в случае неудачи – за счёт приёма соответствующих добавок.
Почти четверть случаев рака молочной железы диагностируются в возрасте до 50 лет *. От момента зарождения раковой опухоли до её выявления проходит в среднем 16 лет, а от момента диагностирования предраковых заболеваний до самого рака – около 10 лет *. Растущее число работ подводит к выводу, что риски заболевания начинают аккумулироваться с самого раннего возраста, особенно в период полового созревания, когда ткань груди у женщины наиболее чувствительна. Поэтому профилактика рака молочной железы должна начинаться в самом раннем возрасте *.
Большинство уплотнений, обнаруженных при пальпации, не являются опухолями. Тем не менее, это свидетельство неблагополучия здоровья груди, которое требует исправления. Не стоит впадать в панику, однако стоит отнестись к появившейся проблеме со всей серьёзностью. То, что сегодня выглядит мелким недоразумением, завтра может обернуться трагедией.
При выявлении опухоли на самой ранней стадии, вероятность излечения может приближаться к 100 %. Особенно это касается люминальных подтипов рака. Но фактор времени работает против пациента. Сначала человек, не осознавая серьёзности симптомов, или не желая думать о плохом, может долгое время не обращаться к врачу и надеяться, что всё пройдёт само по себе. Затем, потеряв надежду, он приходит терапевту; тот направляет его к специалисту; специалист – на дополнительное обследование. Наконец, диагностика получает серьёзные подозрения на опухоль, и пациент получает направление в онкологическую клинику. Каждый из этих этапов требует определённого времени.
Онколог должен изучить состояние дел, получить результаты специализированных исследований, составить план лечения; на это тоже нужно время. Какой-то срок займёт ожидание операции. Необходимых химиопрепаратов может в данный момент не оказаться в наличии, и их тоже, возможно, придётся какое-то время ждать. А опухоль ждать не будет.
К счастью, большинство опухолей молочной железы растёт медленно. Иногда настолько медленно, что вместо лечения может быть назначено наблюдение. Однако в случае запущенной или агрессивной опухоли, два-три месяца без лечения могут дать критические последствия. Каждая неделя болезни увеличивает размер опухоли. Каждый день увеличивает риск метастазирования. Инвазивная опухоль всё дальше вторгается в соседние ткани. Из-за этого лечение становится всё более сложным и травмирующим, а прогноз становится всё менее благоприятным.
Задержка лечения на 3 месяца может снизить 5-летнюю выживаемость пациента с опухолью груди на 12 %, а задержка на 6 месяцев – на 19 % *. Поэтому первый совет: не запускайте болезнь. При первых же симптомах поторопитесь с обследованием.
Отнеситесь к выводам диагностики спокойно, но ответственно. Единственный, кому действительно нужно ваше здоровье – это вы сами. Нельзя принимать судьбоносных решений, основываясь на страхе, на мифах, на ложных убеждениях, опыте и давлении посторонних людей. Если серьёзно подходить к делу, то следовало бы изучить всё связанное с личной проблемой как можно более подробно, пока не созреет разумный осознанный вывод. Но, к сожалению, для человека, пребывающего в цейтноте, и не имеющего достаточной полноты знаний, это трудноосуществимо. Ему остаётся полагаться не на знания, а на веру.
Конечно, специалист знает своё дело лучше, чем дилетант. Тем не менее, слепо доверять единственному специалисту не следует. Всегда будет полезным выслушать альтернативные мнения специалистов других клиник. Они зачастую не совпадают. Всегда стоит пройти повторные и/или дополнительные анализы и обследования. Потому что они иногда могут давать противоположные или вообще ложные заключения. И привести к неудачному выбору плана действий. Чем больше результатов обследования и выводов экспертов имеет на руках специалист, тем полнее он представляет текущую картину заболевания. Тем более верное решение он может принять.
Хотя врач имеет больше знаний и опыта, он ограничен в свободе выбора методик лечения. Кроме того, у него нет ни времени, ни интереса читать пациенту лекции или предупреждать его о негативных последствиях предлагаемой ним программы лечения. А пациенту, прежде чем согласиться с предлагаемым врачом решением проблемы, хочется тщательно разобраться, работает ли оно при данном подтипе рака, и с каким успехом. К каким побочным эффектам и последствиям оно приведёт. Какие страдания и лишения предстоит пройти. С какими потерями ему придётся смириться. Что он точно будет иметь на выходе, на что он может надеяться, а на что – нет.
Если вы полностью передаёте ответственность за своё здоровье другому человеку, то, по возможности, выберите такую клинику и такого онколога, опыту и квалификации которого вы безусловно доверяете. Который был бы готов говорить с вами откровенно и не жалеть на это своего времени. Как бы это ни было трудно из-за высокой загрузки врача, постарайтесь наладить с ним конструктивную работу, потому что результат лечения зависит от вашего сотрудничества. Обсудите с ним не только протокол лечения, но и все те дополнительные меры, которые вы намерены осуществить.
И никогда не сдавайтесь. Рак лечится, а значит лечение может подарить вам несколько лет жизни. Дай Бог, так много лет, что их хватит до глубокой старости.
От момента постановки диагноза до момента начала противо
• Низкокалорийная диета, особенно диета c высоким потреблением цельных злаков, овощей, фруктов, орехов и оливкового масла и низким потреблением насыщенных жиров, жиров омега-6 и красного мяса, может улучшить общую выживаемость после диагностики рака молочной железы *.
• Физическая активность. Умеренные уровни физической активности ассоциируется со значительно более низкой общей смертностью и смертностью от рака молочной железы после её диагностики * * * * и снижением риска рецидива у пациентов с ER–/PR–-опухолями *.
Для определения интенсивности активности используется величина МЕТ. Три единицы MET эквивалентны ходьбе в среднем темпе 3,5-4 км/час в течение 1 часа. Согласно этим расчётам, 4 часа ежедневной ходьбы в среднем темпе способны вдвое снизить относительный риск смерти от рака, особенно у женщин с гормоночувствительными опухолями молочной железы. По сравнению с физической активностью менее 3 МЕТ/нед, при уровне активности 3-9 МЕТ/нед относительный риск смерти от рака молочной железы снижается на 20-35 %, а при уровне активности выше 9 МЕТ/нед – на 40-50 % * *.
• Социальная активность также связана с более низкой общей смертностью после диагностики рака молочной железы *. Однако этот показатель сильно зависит от психологической составляющей общения, и выражен в тех случаях, когда активность приносит положительные эмоции, чувство своей значимости и удовлетворения от своей нужности *.
Хотя врачи могут и не одобрить следующие предложения, их, тем не менее, стоит с ними обсудить. Скорее всего, они не будут против, потому что посчитают эти меры незначительными.
• Противовоспалительные средства – аспирин (100-200 мг/сут).
• Протеолитические ферменты – трипсин, химотрипсин (400-1'200 мг/сут), серрапептаза, наттокиназа, бромелаин и папаин.
• Йод (5 мг/сут), селен (200-400 мкг/сут).
• Витамин D3 (зимой – 4'000 МЕ/сут, т.е 100 мкг/сут; летом – 2'000 МЕ/сут, т.е. 50 мкг/сут).
• Витамин C. Специальный мета-анализ показал, что потребление с пищей 100 мг/сут витамина C со дня постановки диагноза, на 27 % снижает общую смертность и на 22 % – смертность от рака молочной железы *.
• Противофиброзные средства – проантоцианидины (300 мг/сут), бетаин (175 мг/сут), мио-инозитол (200 мг/сут), босвеллиевая кислота (15 мг/сут).
• Водный экстракт Омелы белой (Viscum album) показал высокую эффективность в противодействии опухоли рака молочной железы, в отдельных случаях вызывая даже её регресс *. К сожалению, дозировка стандартизированного терапевтического средства в этом исследовании не была указана.
• Водный экстракт Шлемника байкальского (Scutellaria baicalensis) способен задерживать развитие опухоли, а в отдельных случаях – обращать её вспять *.
• Зелёный чай. Потребление чая (около 100 г сухих чайных листьев за месяц) в течение первых 60 месяцев после постановки диагноза рака ассоциировалось с улучшенной выживаемостью женщин с тройным негативным раком молочной железы *.
• Метформин. Женщины с инвазивным раком молочной железы, получавшие метформин (500 мг/сут в течение 1 недели перед операцией, а затем по 2×1'000 мг/сут в течение 1 недели после неё), показали 3 %-ное снижение уровня маркёра клеточной пролиферации Ki67, в то время как в контрольной группе наблюдалось 2 %-ное его повышение *. В другом клиническом исследовании, женщины, в течение 4 недель принимавшие 1'700 мг/сут метформина в ожидании операции по поводу рака молочной железы, на 12 % снизили маркёры клеточной пролиферации HER2-положительной протоковой карциномы по сравнению с контрольной группой *.
• Экстракты чеснока и лимона. Ежедневное двухнедельное внутрижелудочное введение мышам с привитыми опухолями молочной железы 33 %-ного водного экстракта чеснока (50 мг/кг) было связано с уменьшением размера опухоли на 87 % от её начального размера. Аналогичная обработка экстрактом цельного лимона (50 мг/кг) была связана с уменьшением размера опухоли на 83 %. А комбинация обоих экстрактов была связана с 92 %-ным уменьшением размера опухоли, в то время как в контрольной группе опухоль, наоборот, увеличивалась – в среднем в 5,7 раза *. К сожалению, в человеческом эквиваленте такая дозировка составит около 300 мл экстракта, что выглядит чрезмерно большим.
Конечно, было бы слишком наивным надеяться, что результаты этого единичного исследования на мышах могут дать такой же результат у каждого ракового пациента. Кроме того, достижение заметного результата потребует длительного времени. Один день жизни мыши эквивалентен примерно 40 дням жизни человека; т.о. 14 дней терапии у мышей соответствуют около 1,5 человеческих лет. Тем не менее, этот пример показывает, что против опухоли можно успешно бороться.
В помощь женщинам с диагностированным раком выпущены брошюры, соответственно для случаев неинвазивного *, инвазивного * и метастатического * рака.
Действительно ли необходимо хирургическое удаление опухоли? Как правило – да, но всё зависит от конкретного случая. Удаление основного массива опухоли снижает опухолевую нагрузку на организм и даёт шанс на полное избавление от опухоли. Тем не менее, в редких случаях операция может быть более опасна, чем сама опухоль. Например, если больной по состоянию общего здоровья может её не перенести, или если опухоль расположена таким образом, что её удаление может создать смертельный риск.
В случае, когда опухоль не растёт, или же растёт очень медленно, если она локальна, небольшая по размерам, не мешает прохождению крови, лимфы, жёлчи, пищи, и т.п., не сдавливает нервы и жизненно важные центры, если внутренние органы и иммунная система в порядке, и если есть надежда расправиться с ней иным путём, то, возможно, и нет необходимости спешить с операцией *. Оценить все риски и принять правильное решение может лишь специалист на основании результатов обследования.
Хирургия – это всегда риск и стресс. В дополнение к разрезу, нарушению местного кровотока, повреждению низлежащих тканей и активации местного воспаления, механическое повреждение вызывает также системные нейроэндокринные и метаболические изменения, которые могут влиять на кровоток, коагуляцию и иммунную функцию по всему организму.
Подготовка. Следует выполнять все рекомендации хирурга по подготовке к операции.
Подготовка будет более успешной, если сообщить лечащему врачу следующие возможные обстоятельства:
- приём лекарства или другого средства, разжижающего кровь;
- приём других лекарств, выписанных врачом или принимаемых самостоятельно;
- приём добавок, таких как витамины, минералы, а также натуральные или домашние лечебные средства;
- наличие кардиостимулятора или другого прибора для работы сердца;
- наличие аллергии или непереносимости лекарств или обезболивающих;
- наличие в прошлом проблем при анестезии, при других операциях или при переливании крови;
- наличие апноэ во сне;
- курение, приём алкоголя или лёгких наркотиков.
За семь дней до операции стоит прекратить приём любых добавок. Следует также прекратить приём любых средств, препятствующих агрегации (слипанию) тромбоцитов: инозитола, аспирина, куркумы, имбиря, гинкго, рейши, чеснока, витамина Е, ацетил-L-карнитина, протеолитических ферментов, и других антикоагулянтов, а также кальция, чтобы не увеличивать риск кровотечения после операции.
Приём таких средств, так как зверобой и корень валерианы, следует прекратить, потому что они могут продлить действие анестезии.
На ночь и утром перед операцией может быть полезным голодание
*.
Непосредственно перед операцией следует снять, если они имеются, слуховой аппарат, зубные и другие протезы, парик и тому подобные вещи. Следует также удалить любые металлические предметы, включая ювелирные украшения и пирсинг, потому что используемое во время некоторых операций оборудование при соприкосновении с металлом может вызвать ожоги.
Во время менструаций будет лучше
пользоваться гигиенической прокладкой, а не тампоном.
Усиление апоптоза раковых клеток.
У пременопаузных женщин операция на молочной железе, проведенная во вторую половину менструального месяца (лютеиновая фаза), когда уровни прогестерона максимальные, ассоциируется с более высокой выживаемостью пациентов
*
*.
Некоторые добавки могут оказаться полезными:
• Прогестерон известен как гормон, усиливающий апоптоз эстроген-чувствительных раковых клеток молочной железы. В то время как местное применение на грудь эстрадиола за 12 дней до операции приводит к увеличению пролиферации клеток до 62 %, применение прогестерона снижает его до 72 % по сравнению с плацебо-контролем *.
Геномное исследование выявило, что прогестерон благоприятно модулирует несколько десятков генов, управляющих воспалительной реакцией. По результатам исследования было предположено, что предоперационное воздействие прогестерона может быть полезным для смягчения хирургического стресса *.
Пациенты с концентрацией выше 4 нг/мл прогестерона в крови перед операцией имели вдвое большую 18-летнюю выживаемость по сравнению с пациентами с концентрацией ниже 4 нг/мл (65 % против 35 %) *. Для достижения требуемого уровня прогестерона в ткани груди требуется около 2 недель его передоперационного местного применения в виде крема или геля, однако инъекции (500 мг гидроксипрогестерона) также оказывают благоприятные эффекты на хирургический процесс *.
Прогестерон также несколько снижает тромбообразование *, ослабляя опасность послеоперационной тромбоэмболии.
• Йод также усиливает апоптоз раковых клеток. Добавки 5 мг/сут I2 в течение 7-35 дней до операции и 170 дней после неё (во всё время химиотерапии), показывают значительное ослабление побочных эффектов лечения, отсутствие химиорезистентности опухоли, снижение её инвазионного потенциала, обострение чувствительности эстрогенового рецептора, а также повышение иммунной реакции организма и увеличение 5-летней безрецидивной выживаемости *.
• Доксициклин (2×100 мг/сут), перорально принимаемый за 14 дней до операции по удалению ранней злокачественной опухоли груди (ER–, ER+ и HER2+), значительно снижал показатели опухолевых маркёров стволовых раковых клеток (CD44 и ALDH1) у 90 % пациентов *.
Снижение риска метастазирования. Любое физическое воздействие на опухоль, будь то операция, биопсия или даже просто массаж, способно увеличивать число циркулирующих опухолевых клеток в крови.
Операция является самым критическим периодом для образования метастазов. Удаление первичной опухоли не гарантирует полного избавления от раковых клеток. При этом хирургическое вмешательство нарушает целостность базальной мембраны, окружающую раковые клетки, что позволяет потенциально оставшимся раковым клеткам беспрепятственно вырваться за ограду. Кроме того, хирургический стресс способствует росту ранее существовавших микрометастазов, а также небольших остаточных опухолей в послеоперационном периоде *.
Поскольку метастатическое заболевание является более опасным, чем исходная опухоль, в операционный период следует использовать профилактические меры для предотвращения метастазирования *.
• Модифицированный цитрусовый пектин (15 г/сут), связываясь с молекулами адгезии галектин-3 на поверхности раковых клеток *, способен эффективно противодействовать увеличению адгезии циркулирующих раковых клеток, вызванной хирургическим вмешательством * *. Снижение способности связывания раковых клеток со стенками кровеносных сосудов крайне важно, учитывая то, что хирургическое вмешательство способно увеличить её на 250 % *.
• Циметидин, обычно используемый против изжоги (800 мг/сут), ослабляет адгезию раковых клеток, блокируя экспрессию другой адгезионной молекулы – E-селектин * *. Его применение в качестве дополнения к стандартной терапии может предотвратить локальную инвазию и метастазирование опухоли.
Пациенты с раком толстой кишки, принимающие циметидин сразу после операции, и в течение одного года после неё, значительно увеличивают 10-летнюю выживаемость * *. Кроме того, приём циметидина приводил к улучшению общей выживаемости таких пациентов на 47 % по сравнению с теми, кто этого не делал *.
Пациенты с раком желудка, принимавшие циметидин (800 мг/сут), показали выживаемость в полтора раза выше по сравнению с теми, кто не принимал его *. Циметидин позволяет противодействовать снижению количества Т-клеток, Т-хелперов и NK-клеток *. Тем не менее, связи между предоперационным циметидином и изменением пролиферации опухолевых клеток при раке молочной железы пока не было выявлено *.
• Дезлоратадин или меклизин могут быть более предпочтительными, чем циметидин, поскольку не вызывают подозрений в эстрогенной активности *. Любое из этих трёх веществ в комбинации с модифицированным пектином можно начать принимать за неделю до операции, и продолжать в течение года после неё.
• Диклофенак (75 мг/сут) или кеторолак (20-30 мг/сут), принимаемые во время и после операции, за счёт ингибирования COX2/PGE2 могут быть связаны с более низким риском рецидива или метастазирования рака после хирургического удаления опухолей *.
• Пропранолол, принимаемый во время операции, за счёт ослабления бета-адренергической сигнализации и некоторого улучшения иммунного ответа также может быть связан со снижением количества метастаз *. Сочетание пропранолола и ингибиторов COX2 может иметь синергичный эффект снижения системного воспаления * *. В качестве ингибитора COX2 может быть использован этодолак (400 мг/сут); а пропранолол принимается в следующей дозировке: по 20 мг/сут в течение 5 дней до операции и 5 дней после неё, и 80 мг медленного введения в день операции.
• Удаление мёртвых зубов и оздоровление пародонта перед операцией. Воспаление пародонта способствует метастазированию рака молочной железы в голову и шею *.
Снижение послеоперационного воспаления. Травмирующее вмешательство, каким является операция, вызывает острый воспалительный процесс. С одной стороны, неадекватно завершённое, хроническое воспаление может способствовать развитию опухоли. С другой стороны, сильный всплеск воспалительных сигналов в опухолевой зоне может перезапустить спутанную и противоречивую картину воспалительного процесса, которым является опухоль. Таким образом, нам следует воспользоваться представленным операцией шансом, чтобы послеоперационное воспаление прошло в штатном режиме, синхронизировало все местные процессы восстановления ткани и погасило потенциально оставшиеся воспалительные очаги удалённой опухоли.
Нестероидные противо
Клиническое исследование целекоксиба (REAC), проведенное на основе анализа подгруппы первичного рака молочной железы, за 5 лет наблюдения показало, что у пациентов, принимавших целекоксиб после операции (400 мг/сут), было почти вдвое снижено количество смертей, не связанных с раком *.
Пациенты, получавшие кеторолак (30 мг/сут) перед и во время операции, до 43 % улучшали показатели безрецидивной выживаемости *, и до 41 % снижали число ранних рецидивов по сравнению с пациентами, не принимавшими кеторолак *. С учётом таких высоких показателей трудно удержаться, чтобы не порекомендовать кеторолак или целекосиб во время операции. Существует естественное опасение, что приём такого НПВП, как кеторолак, может повысить риск послеоперационного кровотечения. Однако мета-анализ 27 исследований показал, что оно практически не было увеличено в группе, принимавшей кеторолак, по сравнению с контрольной группой, а побочные эффекты между группами статистически не различались *.
Сообщалось также, что кларитромицин (2×500 мг) улучшает воспалительные реакции после удаления молочной железы, нормализуя температуру, частоту сердечных сокращений и дыхания, а также уменьшая интенсивность и продолжительность боли по сравнению с контрольной группой *.
Некоторые эффективные и доступные натуральные противо
• Босвеллиевая кислота *, куркума * – две известные добавки, способствующие снижению показателей воспалительных маркёров.
• Кофермент Q10 (CoQ10) увеличивает количество и активность макрофагов и Т-лимфоцитов *.
• Комбинация магния (2×50 мг), цинка (2×2 мг), кальция (2×200 мг) и витамина D3 (2×100 МЕ), принимаемая в течение 12 недель, способна значительно снизить показатели C-реактивного белка *.
• Витамины В8 (1-2 г/сут), С (100 мг/сут), Е (15 мг/сут), D3 (4'000 МЕ/сут), альфа-липоевая кислота (100-200 мг/сут) и глутатион (100 мг/сут) также заметно снижают у пациентов уровень такого воспалительного маркёра, как С-реактивный белок.
• В двух клинических испытаниях пациенты, получившие после операции инъекции эсцина – экстракта конского каштана (5-10 мг дважды в день), заметили снижение температуры и отёчности через 3-4 дня после операции * *.
• Бромелаин в двойном слепом перекрестном исследовании демонстрировал противо
Воспаление сопровождается периферическим увеличением окислительного повреждения мембранных липидов. Таким образом, перед операцией могут оказаться полезными антиоксидантные добавки *: куркумин, EGCG, ресвератрол, витамины С, Е, D. Куркумин, несмотря на высокую эффективность, имеет плохую биодоступность, однако добавка пиперина в соотношении 10:1 значительно увеличивает её. Фитосомальный и липосомальный куркумин также биологически высокодоступен. В некоторых исследованиях мелатонин также снижал окислительное повреждение клеток, вызванное хирургической операцией * (60 мг мелатонина внутривенно во время операции и 10 мг перорально в течение трёх ночей после неё *).
Для оптимального процесса заживления ран, а с ним и снижения пролиферации требуются кислород *, витамины (А, С, Е) *, минералы, аминокислоты и жирные кислоты *. Логично будет предположить, что адекватное обеспечение этим и другим материалом (глюкозамин, бромелаин и т.п.) * будет способствовать исцелению упорно не заживающей раны, которую организм видит в опухоли. Например, в одном 9-недельном клиническом исследовании, комплекс, содержащий белок (46 г/сут), аргинин (6,9 г/сут), витамин C (575 мг/сут), витамин Е (87 мг/сут) и цинк (21 мг/сут), улучшал заживление хронических ран *.
Снижение риска послеоперационных осложнений. Движение и ходьба помогают снизить риск образования сгустков крови и пневмонии, а также снизить риск запоров. Важно выполнять упражнения для лёгких, чтобы они могли полностью раскрываться. Это поможет предотвратить пневмонию. Для этого можно использовать различные методики, включая стимулирующий спирометр, а также делать глубокие вдохи и упражнения, стимулирующие откашливание.
Если кожа вокруг разреза сильно покраснела или начала краснеть или если появились выделения, похожие на гной, об этих симптомах следует сообщить врачу.
Иммунная поддержка. Хирургическая операция и анестезия влекут за собой также ослабление иммунных функций * *. Например, у женщин, перенесших операцию по поводу рака молочной железы, активность NK-клеток (натуральных киллеров) в первый день после операции может быть снижена более, чем вдвое *. Это, к сожалению, происходит как раз именно в тот момент, когда они наиболее востребованы.
• Бета-глюкан – длинноцепочечный полимер углеводов, один из самых изученных иммуномодуляторов как врожденного, так и приобретённого иммунитета * * * *. В частности, ферментативно модифицированный экстракт рисовых отрубей активирует NK-клетки (натуральные киллеры), Т-клетки, макрофаги и моноциты * * *. Бета-глюканы, извлекаемые из грибов, таких как Трутовик разноцветный (Trametes versicolor), Чага (Inonotus obliquus), Шиитаке (Lentinus edodes), Рейши, он же Линчши (Ganoderma Lucidum), также увеличивают активность NK-клеток *.
Всего 20 мг бета-глюкана в сутки в течение 10 дней значительно ускоряют заживление послеоперационных травм и количество дней, необходимых для удаления дренажа у пациентов после мастэктомии *. Длительный приём бета-глюкана (7,5 мг/сут на протяжении 15 месяцев) после операции позволяет значительно снизить риск рецидива рака груди. А приём 15 мг/сут значительно продлевает жизнь у неоперабельных пациентов *.
Богатым источником бета-глюкана является оболочка зерновых (отруби) и пивные дрожжи. Ещё одним многоцелевым натуральным средством, содержащим бета-глюканы, является кордицепс (Cordyceps sinensis) * (30 мл/сут или 3 г перед операцией и по 10 мл/сут или 1,5 г/сут в течение 2-8 недель после неё).
• Налтрексон заметно ослабляет вызванное операцией подавление иммунитета *, однако этот опиоид дорог и требует рецепта.
• Для повышения активности NK-клеток могут быть использованы селен, германий, состаренный чеснок *, берберин *, IP6 (инозитол гексафосфат) * и лактоферрин *. Добавки глютамина крысам (1 г на 1 кг пищи) увеличивали активность NK-клеток в 2,5 раза и снижали у них рост привитой опухоли молочной железы на 40 % *.
• Экстракт омелы белой (Iscador™) внутривенно непосредственно перед общей анестезией полностью отменяет вызванное операцией снижение активности NK-клеток *.
• Эхинацея пурпурная (Echinacin®) внутрь может усилить активность NK-клеток на 25 % *, а фагоцитов – на 120 % *, однако по истечению 1-2 недель приёма её эффективность её исчезает *. Сочетание эхинацеи с мелатонином усиливает действие эхинацеи *.
• Тиноспора (Tinospora cordifolia) перорально (1'200 мг/сут) может значительного улучшить послеоперационное состояние за счёт нормализации функции нейтрофилов *.
Другие растительные адаптогены: левзея сафроловидная, шлемник байкальский, родиола розовая, женьшень, аралия маньчжурская. Все растительные адаптогены принимаются в течение не менее 10 дней, а за 3 дня до оперативного вмешательства их приём должен быть прекращён.
• Мелатонин
*,
сулиндак (экв. 400 мг/сут)
*
и интерферон-гамма
*
снижают в опухоли соотношение про-опухолевых макрофагов М1 к противо-опухолевым макрофагам М2 в пользу последних.
Сочетание мелатонина (20 мг) с Алоэ вера (Aloe vera) проявляет синергичный эффект, и способно стабилизировать состояние у половины раковых пациентов
*.
В последнем случае листья алоэ размельчались и смешивались с консервантом (водкой) в соотношении 1:9, после чего настойка принималась в дозе по 1 мл утром и вечером ежедневно.
В связи с операцией пациенту назначают анестезию и антибиотики, которые могут уничтожить полезную микрофлору кишечника, ослабляя поддержку иммунных клеток толстого кишечника и снижая естественную стойкость организма к образованию метастаз. Поддержание здорового бактериального состава кишечника благотворно влияет на иммунное состояние пациента.
• Пробиотики, в основном лакто- и бифидо-бактерии (Lactobacillus acidophilus, Lactobacillus plantarum, Bifidobacterium lactis и Saccharomyces boulardii), позволяют снизить частоту всех серьёзных послеоперационных осложнений (28,6 % против 48,8 %), в том числе послеоперационную пневмонию (2,4 % против 11,3 %) и послеоперационную инфекцию (7,1 % против 20,0 %) *.
Подавление ангиогенеза. Операция усиливает ангиогенез (образование новых кровеносных сосудов), способствующий заживлению ран. Однако повышение уровня ангиогенных факторов также способствует рецидиву опухоли и повышению активности роста дремлющих микрометастазов *. Кроме того, первичная опухоль производит антиангиогенные факторы, которые ограничивают рост метастатического рака в других частях тела * *, и её хирургическое удаление снимает ограничение на рост микрометастаз *. Антиангиогенные вещества могут снизить эти риски, однако они могут также увеличить время заживления ран.
Некоторые добавки способны снизить интенсивность ангиогенеза: цинк; EGCG из зелёного чая (1 г/сут) *; куркумин (до 4 г/сут) *; проантоцианидины из виноградных косточек (20 мкг/мл) *; эллаговая кислота из плодов и соплодия граната (200 мг/сут, или от 250 мл/сут гранатового сока) *. Сочетание эллаговой кислоты с фосфатидилхолином в соотношении 1:4 может увеличить её биодоступность в два раза *.
Восстановление ткани. Послеоперационное восстановление повреждённой ткани может сопровождаться образованием рубцов, спаек, и недостаточно функциональной архитектурой. Как можно более раннее, постепенное восстановление физической активности улучшает процесс заживление травмированных тканей. Для этого врачебный персонал может предложить различные физические упражнения. Возможные после операции боль, чувствительность, онемение и скованность нужно преодолевать.
• Готу кола (Centella asiatica), она же Центелла. Экстракт листьев растения предотвращает образование послеоперационных спаек и уменьшает послеоперационные рубцы * *. Дозировка: 3×200 мг сушёных листьев в сутки. Можно заваривать как чай: 1-2 чайные ложки (5-10 г) листьев на 1 стакан кипятка, дав настояться в течение 10-15 минут *.
• Серрапептаза (серратиопептидаза, Серрата™) – протеолитический фермент, который оказывает противо
Комплексы трипсин+хемотрипсин (Chymoral Forte® 100'000 Е) и трипсин+бромелаин (48 мг + 90 мг) проявляли лучший послеоперационный противо
• Внутривенное введение экстракта Шалфея (Salvia miltiorrhiza) в день операции и в течение 3 дней после неё, позволяло снизить ишемию и некроз кожных лоскутов после удаления груди так же эффективно, как и анизодамин, но без побочных эффектов последнего *. Однако, дозировка, применявшаяся в этом клиническом исследовании, указана не была.
Терапия красным светом (610-625 нм) – безопасное и эффективное средство избавления от боли в период послеоперационной реабилитации, когда более быстрое заживление означает меньший дополнительный риск для здоровья и потерю активности. Клинические исследования подтверждают такие преимущества светотерапии, как снижение боли, уменьшение кровотечений в месте разреза, ускорение процесса заживления * и ослабление процесса образования рубцов *.
Подавление фиброза. В качестве противо
• Солодка (Glycyrrhiza glabra), корень. Принимается в виде водяного настоя: 1 ч.л. корня, выдержанная в 1 ст. кипятка в течение 15 минут трижды в день *. В процессе лечения следует следить за артериальным давлением, а также соблюдать диету с высоким содержанием калия.
• Шалфей (Salvia miltiorrhiza), корень – одно из наиболее сильных противо
• Расторопша (Silybum marianum), семена; обычно применяется против фиброза печени, однако она может быть эффективным противо
• Астрагал (Astragalus mongholicus), корень; и Дудник китайский (Angelica sinensis), корень; в соотношении 5:1. Дозировка настойки: 3 мл/сут, 12 недель * *.
• Готу кола (Centella asiatica), все части растения. В клинических исследованиях сырой экстракт растения предотвращал аномальное образование рубцов в процессе заживления как при местном нанесении * *, так и при приёме внутрь *. Типичная доза настойки свежего растения составляет 3-5 мл три раза в день. Типичная доза капсул сырой травы составляет 1-2 г трижды в день (300 мг/сут азиатикозида). Типичная разовая доза чая составляет 1 ст. л. травы/чашку, настаивается в течение 15 минут в горячей воде; а суточная доза составляет 3 чашки. Стандартизированные экстракты растения используются, как указано на прилагающихся к ним этикетках.
В доклинических исследованиях антифиброзный эффект проявили также такие растения: Куркума (Curcuma longa), корень *; Олива (Olea europaea), лист *; Ревень (Rheum palmatum), корень *; Шлемник байкальский (Scutellaria baicalensis), корень *; Одуванчик (Taraxacum officinale), корень *.
Хоть это строго и не доказано, но, с большой степенью вероятности, сочетание этих растительных средств должно оказывать синергичный или, по крайней мере, суммарный эффект. Препараты йода и витамин D * также противодействуют ненормальному накоплению белков внеклеточного матрикса.
Ингибирование фиброза с использованием местной повязки с коллагеновым кремом может заметно ускорить восстановление лимфатической системы и способствовать регенерации нормальных капиллярных лимфатических узлов открытой раны и, в конечном итоге, снизить симптомы лимфедемы.
Снижение предоперационной тревожности и стресса поможет легче пережить оперативное вмешательство. Диагноз уже сам по себе является сильным стрессовым фактором. Связанные с лечением психологические нагрузки ещё более увеличивают его.
Ослабление симптомов лимфедемы. Удаление лимфатических узлов в ходе операции часто вызывает лимфатический отёк, который называется лимфедема. Лимфедема руки развивается у 10-35 % пациентов, перенесших подмышечную хирургическую или лучевую терапию по поводу рака молочной железы. Лимфедема, которая возникает в первые 18 месяцев после операции или облучения, описывается как острая лимфедема. Её предлагают лечить консервативными мерами, такими как поднимание руки и лёгкая компрессия. Если лимфедема за указанный период не проходит, она описывается как хроническая. Это более серьёзная форма, которая имеет прогрессирующее и, как правило, необратимое развитие.
Хотя руку на стороне операции рекомендуется использовать обычным образом, её не следует перенапрягать тяжестями или другими нагрузками. Не рекомендуется также перегревать её приёмом горячей ванны или посещением сауны. Не следует также носить на этой руке плотно обтягивающую одежду или украшения, чтобы не ухудшать кровоток. Не стоит подвергать эту руку таким испытаниям, как инъекции, забор крови для анализа или измерение артериального давления.
Уменьшение количества лимфоузлов и нарушение их архитектуры не только ухудшает ток лимфы и способствует её местному накоплению, но также увеличивает риск инфекционного заражения. Для предупреждения этого, следует беречь руку на стороне операции от травм, порезов и ожогов. Например, с особой осторожностью следует делать на этой руке маникюр.
Из растительных средств в тяжёлых случаях можно попробовать Донник лекарственный (Melilotus officinalis). Шестимесячные добавки экстракта донника в дозировке 400 мг/сут пациентам с послеоперационной хронической лимфедемой плеча, вызывали у половины из них уменьшение окружности пораженной руки на 5 % по сравнению с исходными значениями *. Комбинация донника с бромелаином и рутином (100 мг натурального донника, содержащего 20 г кумарина, плюс 300 мг рутина и 100 мг бромелаина) может усилить этот эффект *.
Комбинация пробиотиков, пребиотиков и низкокалорийной диеты в течение нескольких недель также может уменьшить объём лимфедемы рук, а также улучшить показатели TGF-β, IL-10 и адипонектина в сыворотке * *.
Ослабление боли. Для снижения после-операционной боли можно принимать трамадол (2'000 мг/сут), который, в отличие от морфина, не подавляет, а наоборот, усиливает иммунную функцию *. Это касается стимулирования активности NK-клеток *.
Улучшение послеоперационного прогноза. Комбинация антиоксидантов (2'850 мг/сут витамина C, 2'500 мкг/сут витамина Е, 32,5 мкг/сут бета-каротина, 387 мкг/сут селена, другие витамины и минералы), незаменимых жирных кислот (1,2 г/сут γ-линоленовой кислоты и 3,5 г/сут ω-3 жирных кислот) и кофермента CoQ10 (90 мг/сут) значительно улучшает выживаемость и качество жизни, и выразительно снижает опасность метастазирования опухоли на лимфатические узлы в подмышечной впадине у пациентов категории «высокого риска» *.
Инфузии PGG-глюкана (коммерческого бета-глюкана) снижали частоту инфекционных осложнений у послеоперационных пациентов в 2,4 раза, продолжительность потребности в антибиотиках внутривенно – в 25 раз, и многократно сокращали продолжительность интенсивной терапии *. Одна доза (0,5 мг/кг) вводилась за 12-24 часов перед операцией, вторая – за 1-4 часа, третья – через 24 часа после операции, четвёртая – через 96 часов. Инъекции PGG-глюкана (2,0 мг/кг) также значительно сокращали количество послеоперационных инфекций *.
В открытом исследовании было обнаружено, что пероральный приём бета-глюкана из пивных дрожжей (7,5 мг/сут в течение 15 месяцев) даёт защитный эффект от рецидива рака после операции. В группе лечения не было рецидивов по сравнению с 22 % рецидивов в контрольной группе, не получавшей дополнительного лечения или плацебо *.
Удаление большого количества раковых клеток первичной опухоли облегчает проведение дальнейшей терапии. Чем меньше остаётся раковых клеток – тем выше шансы на успех. Однако, если есть возможность выбора, лучше прибегать к менее травмирующим методам, которые создают более низкий риск метастазирования *.
Во время курса химиотерапии могут быть использованы многие дополняющие методы лечения рака. Однако есть много конфликтов между ортодоксальным и дополняющим видами лечения, между приёмом химиотерапевтических и дополнительных средств. Если пациент принимает какие-то лекарства, которые нельзя отменить, ему следует проконсультироваться с лечащим врачом, чтобы узнать, совместимы ли они с теми препаратами, которые он собирается назначить.
Проблемы совместимости возникают, когда одно вещество нейтрализует или препятствует действию другого, или наоборот, усиливает его действие. Сочетания большинства химических веществ изучены очень слабо. Поэтому проще всего запретить любые дополнения к стандартному протоколу, что обычно и делают лечащие врачи. Ответственность за желание улучшить процесс лечения, таким образом, перекладывается на пациента. Тем не менее, имеются результаты многих клинических исследований, на которые пациент может положиться.
Если принято решение использовать стандартные химиотерапевтические препараты, у нас есть возможность при помощи дополнительных средств усилить действие химиотерапии, смягчить её побочные эффекты, способствовать подавлению опухоли, предотвратить метастазирование и благоприятствовать ремиссии. Однако ввиду того, что они могут иметь противопоказания, или повлиять на планируемые процедуры, их применение, безусловно, стоит рассмотреть вместе с лечащим врачом. Если он, конечно, захочет обсуждать эту тему.
Усиление цитотоксического эффекта химиотерапии и лучевой терапии. В настоящее время существуют методы лечения, позволяющие значительно снизить дозы цитотоксических средств – инсулинопотенциальная терапия (IPT, ИПТ), таргетная химиотерапия, ингибиторы гликолиза. Можно попытаться найти клиники, где применяются такие протоколы лечения, или обсудить с лечащим врачом возможность их применения в вашем конкретном случае.
Усиление цитотоксического эффекта основного активного вещества. Учитывая возможное негативное взаимодействие между основным терапевтическим веществом и любой другой добавкой, не все дополнения к основному лечению могут оказаться полезными. Добавки, способные вызвать проблемы, включают зверобой, эхинацею, солодку и сибирский женьшень. Тем не менее, существуют клинические исследования, подтверждающие пользу некоторых других растительных добавок.
• Докозагексаеновая кислота (DHA). Женщины с метастатическим раком молочной железы, получавшие 1,8 г/сут DHA, за исключением дня химиотерапии (циклофосфамид/фторурацил/эпирубицин), улучшили показатели выживаемости по сравнению со средними нормами *. DHA, являющийся пищевым компонентом жирной океанической рыбы, не вызывал никаких дополнительных побочных эффектов лечения.
Усиление окислительного стресса. Многие натуральные вещества могут увеличивать уровень оксидантов, помогая химиопрепаратам убивать раковые клетки при помощи окислительного стресса. Когда некоторые натуральные противо
Ослабление энергетики клеток снижает их способность сопротивляться химиотерапии. Раковые клетки, как и другие быстро пролиферирующие клетки, требуют повышенного расхода энергии, и поэтому значительно сильнее страдают от энергетического голода, чем нормальные клетки.
Предварительная обработка раковых клеток непосредственно перед сеансом химиотерапии веществами, которые избирательно токсичны для раковых клеток (куркумин, кверцетин, аспирин, ашвагандха, витания), способствует нарушению работы их митохондрий * *. А митохондриальная дисфункция сокращает производство АТФ в клетке и увеличивает уровни оксидантов, снижая тем самым выживаемость раковых клеток.
• Метформин (500 мг/сут) за счёт многообразных эффектов значительно усиливает эффективность действия большинства химиотерапевтических средств, в том числе доксорубицина и трастузумаба. Основной из его эффектов – снижение выработки АТФ путём ограничения уровня глюкозы. Подавление гликолиза снижает возможности как выработки энергии, так и создания строительного материала для производства новых клеток.
У раковых клеток имеется альтернативный глюкозе источник энергии – глютамин, и они могут компенсировать снижение поставки глюкозы за счёт увеличения поставок глютамина. Таким образом, по крайней мере, на время противо
Ряд натуральных продуктов может усилить эффекты традиционных методов уничтожения раковых клеток, включая лучевую терапию, и в то же время может защитить нормальные клетки от повреждающего действия этих терапевтических процедур * * * *. Флавоноиды, смешанные токоферолы/токотриенолы, витамин C, докозагексаеновая кислота (DHA), селен, магний и байкалеин не конфликтуют со стандартными химиопрепаратами, но усиливают их способность уничтожать опухоли.
• Витамин C (2 г в день) может усилить терапевтическую эффективность доксорубицина, цисплатина и паклитаксела против раковых клеток молочной железы.
• Витамин К синергично усиливает действие витамина C, повышающего чувствительность раковых клеток к обычной химиотерапии
*.
Наиболее сильно противо
• Куркумин (6 г/сут) в течение семи дней подряд каждые 3 недели усиливает действие доцетаксела у пациентов с прогрессирующим и метастатическим раком молочной железы *.
• Кверцетин и генистеин действуют синергично * со многими химиотерапевтическими препаратами, в том числе цисплатином. Экстракт зелёного чая, эмодин и женьшень, также взаимодействуют синергично. Однако их дозировка часто весьма высока.
• Льняное масло и рыбный жир, благодаря наличию жирных кислот омега-3, вызывают повреждение ДНК в раковых, но не в нормальных клетках. Это делает опухоль более чувствительной к лучевой и химиотерапии без увеличения токсичности для нормальных тканей * *. Кроме того, оба они усиливают действие трастузумаба (герцептина).
• DIM в сочетании с трастузумабом приводит к уменьшению жизнеспособности раковых клеток молочной железы, вызову их апоптоза и снижению клоногенности *.
• Селен позволяет усилить эффективность и уменьшить побочные эффекты применения тамоксифена, доксирубицина, паклитаксела, иринотекана и цисплатина, и вызванную ними терапевтическую устойчивость.
• Алоэ древовидное (Aloe arborescens) в виде микстуры, принимаемой внутрь начиная за 6 дней до начала лечения, может двое повысить чувствительность раковых клеток к химиотерапии и вдвое увеличить трёхлетнюю выживаемость метастатических пациентов *. Используется (3×10 мл) в виде микстуры из 300 г листьев алоэ, 500 г мёда и 40 мл 40 %-ного спирта в качестве консерванта.
Ослабление защиты раковых клеток. Хроническое воспаление, сопровождающее опухоль, способствует производству фибрина, а фибрин создаёт защитное покрытие для раковых клеток, которое не даёт возможности распознать антигены на их поверхности, а также затрудняет их поглощение иммунными клетками. В таких условиях усиление иммунной активности будет задевать здоровые клетки организма, вызывая аутоиммунные реакции. В то время как раковые клетки будут в значительной степени оставаться под защитой гликогеновой слизи и фибрина. Растворение фибриновой защиты может усилить терапевтический эффект химио- и иммунотерапии, а также заметно снизить способность опухоли к метастазированию.
• Протеолитические ферменты позволяют избавиться от избыточного количества фибрина. Это могут быть ферменты как животного, так и растительного происхождения. К первым можно отнести трипсин и химотрипсин, ко вторым – папаин, бромелаин, серрапептазу и наттокиназу. Добавки протеолитических ферментов значительно улучшали у пациентов прогноз и снижали побочные эффекты лучевой и химиотерапии *.
Введение в клеточный цикл. Наиболее часто используемые химиопрепараты, называемые митостатиками, нацелены на уничтожение клеток, находящихся в состоянии деления, когда те наиболее уязвимы. Из-за того, что не все раковые клетки в момент сеанса химиотерапии находятся в митозе, приходится проводить несколько сеансов лечения. Однако даже это не гарантирует, что все раковые клетки будут поражены митостатиками, поскольку стволовые раковые клетки могут находиться в состоянии покоя более продолжительное время, чем весь цикл лечения. Для гарантированного поражения, их требуется вывести из состояния покоя и ввести в клеточный цикл в момент действия химиопрепаратов.
Хотя в обычных условиях стимулирование деления раковых клеток – это совсем не то, что нам нужно, во время химиотерапии это может усилить эффективность лечения. Тем не менее, самостоятельно предпринимать мероприятия, которые могли бы стимулировать митоз, не рекомендуется.
Подавление лекарственной устойчивости. Некоторые добавки помогают предупредить развитие устойчивости опухоли против химиотерапевтических средств.
Добавки йода (3-6 мг/сут), начиная с 7-35 дней до операции, и продолжая весь период терапии доксорубицином, практически полностью отменяют устойчивость раковых клеток к лекарственным средствам у пациентов с II-III стадиями болезни. Среди пациентов, принимавших йод, по сравнению с пациентами не принимавших его, число случаев полного ответа вырастает вдвое *, а пятилетняя выживаемость – вчетверо *. Просто невероятно, как такая дешёвая добавка может так сильно повлиять на результат лечения.
Предварительная обработка ресвератролом или эллаговой кислотой, начиная за 48 часов до обработки цисплатином (10 мкМ) приводит к умеренному (в 2-3 раза) увеличению чувствительности раковых клеток к первичной терапии цисплатином in vitro. При постоянном присутствии ресвератрола или эллаговой кислоты воздействие цисплатином в течение 26 недель полностью предотвращает in vitro развитие резистентности к цисплатину *.
Многие вещества проявляют способность противодействовать уже выработанной лекарственной устойчивости.
Полифенолы растительного происхождения способны участвовать в восстановления механизмов апоптоза, таких как р53
*
*.
Пиперин, содержащийся в чёрном перце, а также некоторые другие натуральные вещества, ухудшают работу клеточных насосов, которые выбрасывают из клетки химиопрепараты.
Другие природные вещества могут разрушать белки теплового шока, защищающие раковые клетки. В результате чего лекарственная устойчивость раковых клеток может быть снижена.
Периодическое голодание † или диета, имитирующая голодание, усиливают активность эндокринных терапевтических препаратов тамоксифена и фулвестранта, способствуя регрессии опухоли и ослаблению приобретённой лекарственной устойчивости. Кроме того, как голодание, так и диета, имитирующая голодание, предотвращают индуцированную тамоксифеном гиперплазию эндометрия *.
Уничтожение стволовых раковых клеток. Ортодоксальные методы лечения направлены на уничтожение массива раковых клеток, однако они мало задевают стволовые раковые клетки, что вызывает послетерапийное усиление стойкости опухоли и её последующий рецидив. Поэтому эффективность химиотерапии можно значительно повысить, если часть терапевтических усилий направить на уничтожение стволовых раковых клеток.
• Салиномицин (salinomycin) – антибиотик, избирательно направленный на уничтожение стволовых раковых клеток, способен значительно усилить действие стандартной химиотерапии и предупредить рецидивы. Однако салиномицин обладает высокой токсичностью для млекопитающих, что может ограничить его клиническое применение.
• Паклитаксел (paclitaxel) в сочетании с содержащимся в пижме растительным компонентом партенолидом, сдерживает рост раковых клеток более эффективно, чем каждое из этих веществ в отдельности. Такое явление называется синергией. В то время как паклитаксел уничтожает основной массив раковых клеток, партенолид нацелен на стволовые раковые клетки, подавляя их способность образовывать колонии.
• Траниласт (tranilast) – антигистаминный препарат 4 поколения (блокатор H1-гистаминовых рецепторов). Траниласт сдерживает образование колоний и маммосферы стволовых клеток как HER2+-, так и TNBC-опухолей, выживших после применения митоксантрона
*.
В опытах на мышах с привитой опухолью молочной железы (4T1), траниласт вдвое снижал её рост по сравнению с контролем, а также до 90 % снижал риск метастазирования в лёгкие и печень
*.
Дозировка: 500 мг/сут
*.
• Метформин (metformin) в комбинации с доксорубицином также действуют синергично, убивая как стволовые раковые клетки, так и не-стволовые раковые клетки
*.
После прекращения этого комбинированного лечения у животных сохранялась ремиссия опухоли, как минимум, в течение 60 дней, что укладывается в представление о полном уничтожении опухоли. У животных метформин при пероральном приёме эффективно усиливал несколько стандартных химиотерапевтических средств (доксорубицин, паклитаксел, карбоплатин)
*
*. В этих исследованиях потребление животными метформина, эквивалентное человеческому, составляло примерно 1'500 мг/сут, что не превышает максимальную дозу, предписываемую для лечения диабета II типа.
У мышей комбинация метформина в течение дня (экв. 250 мг) и мелатонина в ночное время (экв. 1 мг) значительно ингибирует рост трансплантированных HER2-опухолей
*.
Некоторые природные продукты способны непосредственно убивать раковые стволовые клетки * *.
Улучшение доставки лекарств. Повышенное внутриопухолевое давление ухудшает местный кровоток и противодействует поступлению лекарственных препаратов к терапевтической цели. Это способно значительно снизить эффективность химиотерапии и повысить риск неудачи лечения. Из всех рассматривавшихся средств, позволяющих снизить внутриопухолевое давление, доступных и дешёвых крайне мало.
• Дексаметазон – противо
• Лозартан (Losartan™), применяемый для снижения артериального давления, уменьшает производство и плотность белков внеклеточного матрикса – коллагена и гиалуронана, тем самым улучшая движение крови сквозь опухоль *. Добавление лозартана к химиотерапии может вдвое улучшить транспорт цитотоксических препаратов внутрь опухоли. В то же время, терапевтическая дозировка для человека, рассчитанная на животных моделях, составляет примерно 120 мг/сут. Такая высокая концентрация лозартана может вызвать значительное снижение артериального давления, и поэтому нежелательна для людей, не страдающих гипертонией. Местные инъекции могли бы позволить достичь большего успеха с меньшими побочными эффектами, однако такой подход клинически не изучен. Другая проблема лозартана – необходимость длительного применения (от 1,5 года более). Кроме того, не рекомендуется его сочетание с селективными ингибиторами COX-2, такими как целекоксиб.
• Иматиниб (Gleevec™) может сдерживать карциному молочной железы не только за счёт антифиброзного эффекта на фибробласты путём ингибирования их пролиферации и синтеза коллагена, но так же за счёт снижения межклеточного давления и подавления роста и инвазивности раковых клеток *.
• Серрапептаза улучшает проникновение антибиотиков в очаг воспаления благодаря способности расширять капилляры и контролировать их проницаемость. Можно осторожно предположить, что другие протеолитические ферменты (папаин, бромелаин) и средства, увеличивающие текучесть крови (аспирин, центелла, гинкго билоба), также могут улучшать кровоток и способствовать улучшению доставки химиотерапевтических средств в опухоль. Однако любое из этих предложений должно быть оценено специалистом на предмет отсутствия противопоказаний.
Снижение негативных побочных эффектов химиотерапии и радиотерапии помогает пациентам лучше переносить эффективные дозы.
Химиотерапия вызывает изменения, способствующие прогрессированию рака, которые могут происходить как внутри, так и вне раковых клеток. Химиотерапевтические препараты повышают экспрессию антиапоптотических генов * и увеличивают способность раковых клеток мигрировать и вторгаться * (внутренние изменения). Кроме того, они склоняют нераковые клетки в организме хозяина не препятствовать раковым клеткам переноситься в отдалённые участки * (внешние изменения).
Несмотря на уменьшение размера первичных опухолей, химиотерапия изменяет микросреду опухоли, что приводит к увеличению выхода раковых клеток в кровоток, и дальнейшему их распространению, а снижение иммунной функции вследствие химиотерапии повышает шансы их выживания. Кроме того, химиотерапия делает тканевое микроокружение на удалённых участках более благоприятным для приёма раковых клеток *.
Поэтому все профилактические меры для предотвращения метастазирования, рекомендованные при операции, остаются в силе.
Химиотерапия повреждает эпителиальный слой кишечника, всвязи с чем возникает три проблемы – очищение кишечника, укрепление стенки кишечника и его защита – как механическая, так и биологическая.
• Скользкий вяз и семена подорожника при соединении с водой образуют гелеобразную слизь, которая действует обволакивающе. У людей с синдромом «протекающего кишечника» она предотвращает просачивание токсинов сквозь стенку кишечника; а у пациентов, находящихся под химиотерапией, она защищает поражённый эпителий кишечника и способствует его заживлению.
• Бентонитовая глина очень мелкодисперсна, и совершенно не содержит песка и других твёрдых примесей. Поэтому при соединении с водой она образует мягкую грязевую гелеподобную массу, которая действует обволакивающе и, подобно активированному углю, обладает высокими абсорбционными свойствами. Кроме того, бентонит богат щелочными минералами и производит антиоксидантное действие.
На время противо
Гибель большого количества здоровых клеток потребует большого количества аминокислот для создания новых клеток, восполняющих эти потери. Это значит, что потребуется увеличить потребление белка. Хотя животный белок более полноценный, растительный белок в данном случае предпочтительнее. Он беднее метионином, который вызывает воспаление и способствует росту раковых клеток.
Повреждение внутреннего слоя кишечника может потребовать отказаться от грубой клетчатки в пользу более деликатной пищи, участить приём пищи, усилить её предварительное измельчение, увеличить потребление жидкости, а также увеличить потребление полезных жиров. Это позволит создать пищевую массу, более щадяще действующую на стенки кишечника.
Ввиду того, что линолевая кислота преобразуется в про-воспалительную арахидоновую кислоту, разумно будет оставить в рационе лишь те растительные жиры, которые бедны линолевой кислотой (такие, как льняное масло, кокосовое масло, пальмовое масло, масло какао и оливковое масло), и увеличить потребление рыбного жира и насыщенных животных жиров, таких как топлёное сало и сливочное масло.
При этом следует не только полностью отказаться от простых углеводов, но и возможно, сократить количество сложных углеводов, чтобы удерживать раковые клетки на голодном пайке. Чтобы это не влекло за собой запоров, вызванных снижением потребления клетчатки, можно добавлять в пищу отруби, а тем, кто имеет чувствительность к глютену – шелуху семян подорожника, которую запивают большим количеством воды.
Химиотерапия поражает другие эпителиальные клетки. Наиболее наглядно это проявляется потерей волос, а также поражениями в ротовой полости и в кишечнике пациента.
• Экстракт Подорожника (Plantago major), раствор 0,12 % хлоргексидина и 5 % бикарбоната натрия используемые для полоскания рта, как показывает рандомизированное тройное слепое клиническое исследование фазы III, могут эффективно лечить мукозит полости рта II-III степени у онкологических больных *.
• Куркумин может быть использован вместо хлоргексидина для полоскания рта для быстрого заживления вызванного терапией мукозита полости рта у пациентов *.
• Алоэ вера (Aloe vera) в качестве жидкости для полоскания рта значительно снижает интенсивность стоматита и боли, вызванных химиотерапией *.
• Кверцетин (2×250 мг) в течение 4 недель могут снизить частоту развития мукозита полости рта у пациентов, проходящих курс высокодозовой химиотерапии *.
• Мёд пчелиный, применяемый местно, может снизить частоту возникновения мукозита полости рта, вызванного химиотерапией и лучевой терапией * * *.
Химиотерапия поражает иммунные клетки и клетки крови. Ни хирургия, ни химиотерапия, ни лучевая терапия не останавливают распространение рака. Они не уничтожают, и не способны уничтожить все раковые клетки в организме. Многие раковые клетки переживают токсический и митотический стресс за счёт улучшенной приспособленности, и готовы далее с новыми силами размножаться. Окончательная их ликвидация ложится на плечи иммунной системы. Однако у человека, который прошёл ортодоксальные методы лечения рака, иммунная система ослаблена, потому что химиотерапия подавляет иммунную функцию, которая крайне необходима в этот ответственный момент.
Помимо того, что снижение иммунной функции может значительно ухудшить результативность лечения, пациенты длительное время остаются уязвимыми для атаки вирусных и бактериальных инфекций. Чтобы снизить риск инфекционных заболеваний, им рекомендуется усилить гигиенические мероприятия, избегать контактов с потенциальными носителями инфекций, а во время эпидемий ОРВИ – использовать защитную маску.
Известно несколько предложений, способствующих сохранению иммунитета даже в условиях химиотерапии.
• Инозитол. У пациентов, получавших во время 6-месячной химиотерапии комбинацию инозитола с инозитолом гексафосфата (IP6), не наблюдалось падения количества лейкоцитов и тромбоцитов *. Суточная дозировка смеси составляла 2×3 мг.
• Циметидин (800 мг/сут) значительно улучшает у больных уровень лимфоцитов при лечении 5-фторурацилом различных видов рака *.
• Женьшень (Panax ginseng). Компонент корня женьшеня – гинсенозид Rg3, снижает миелосупрессию и увеличивает время выживания у пациентов во время стандартной химиотерапии первой линии *.
• Шалфей (Salvia Miltiorrhiza) (20 мг/кг экстракта) в комбинации с Трутовиком разноцветным (Trametes versicolor) (50 мг/кг экстракта) при регулярном пероральном приёме значительно улучшает у пациентов иммунологическую функцию, увеличивая процентное и абсолютное количество В-лимфоцитов и T-хелперных клеток, а также соотношение CD4+(Т-хелперные клетки) к CD8+(Т-супрессорные и цитотоксические Т-клетки) * *.
• Кодонопсис (Codonopsis pilosula), Линчжи (Ganoderma tsugae), Дудник китайский (Angelica Sinensis) и Пеларгония сильнопахнущая (Pelargonium graveolens) также показали свою эффективность у пациенток с раком груди, находившихся на химиотерапии. Приём этой смеси в течение 6 недель вдвое снижал вызванное лучевой/химиотерапией падение уровня лейкоцитов, и втрое – падение уровня нейтрофилов по сравнению с группой плацебо *. При этом разница уровней Т-клеток, Т-хелперов, цитотоксических Т-клеток и натуральных киллеров у пациентов обоих групп было незначительным. Весовое соотношение сухих водных экстрактов этих китайских растений было, соответственно, 9:1:22:125, дозировка – 4'250 мг/сут.
• Астрагал (Astragalus membranaceus) может ингибировать развитие опухоли, снизить токсическое воздействие химиотерапии, повысить иммунную функцию организма и улучшить качество жизни пациентов *. Смесь других растений китайской медицины (Astragalus membranaceus, Poriae cocos, Atractylodes macrocephala, Lycium chinense, Ligustrum lucidum, Paeonia lactiflora, Paeonia obovata, Citrus reticulata, Ophiulia difficile, Scutellaria barbata, Prunella vulgaris и Glehnia littoralis) в дозировке 2 г/сут в течение 21 дня, значительно снижала у пациентов под химиотерапией анемию и лейкопению по сравнению с контролем *.
• Кошачий коготь (Uncaria tomentosa) снижает такие побочные эффекты химиотерапии, как падение уровня нейтрофилов и повреждение ДНК нормальных клеток * *. Уровень нейтрофилов у женщин с раком молочной железы (стадии II A/B), принимавших 300 мг/сут сухого этанолового экстракта кошачьего когтя, оставался на высоком уровне, в то время как в группе, не принимавшей его, уровень нейтрофилов падал более, чем вдвое *. За две недели до операции приём кошачьего когтя прекращают, потому что он может увеличить риск кровотечения.
• Омела белая (Viscum album), в сочетании с традиционной противо
В одном из обзоров были представлены совокупные данные о 74 пациентах с различными типами и стадиями рака, получавших омелу в качестве дополнительной терапии к различным традиционным методам лечения. Экстракт омелы под торговой маркой Isorel™ принимался каждый второй день в перерывах между курсами химиотерапии. Длительность наблюдения за пациентами составляла от 4 месяцев до 13 лет. Эффективность экстракта оценивалась по таким результатам, как предотвращение рецидива опухоли (у 47 % пациентов) и регрессия рака (у 38 % пациентов). Наилучшие результаты были достигнуты при неметастазирующем раке. Явного ухудшения состояния здоровья в течение периода наблюдения не было замечено. Противоопухолевая эффективность выше у неочищенного водного экстракта, чем у любого его компонента самого по себе *.
Экстракт омелы в виде внутрибрюшинных инъекций препарата Helixor®, субъективно значительно улучшал качество жизни и несколько снижал вызванную химиотерапией нейтропению * *. Здесь препарат вводился 3 раза в неделю в плавно наращиваемых дозах от 1 до 50 мг.
Другие коммерческие аналоги Helixor® – Iscador®, Helixor®, Eurixor® или Lektinol® в большинстве случаев показывают аналогичное действие *.
• Голодание, рассмотренное чуть ниже †, помогает снизить риск лейкопении, возникающей вследствие химиотерапии *.
Химиотерапия поражает печень. В организм пациента, проходящего курс цитотоксической химиотерапии, попадает огромное количество токсинов, поэтому очень важно сопровождать этот процесс детоксикационными мероприятиями. В кровоток могут попадать как продукты, образующиеся от жизнедеятельности и распада опухоли, так и остатки цитотоксинов. В этом случае печени будет тяжело достаточно быстро нейтрализовать такой большой объём попавших в кровь токсинов, что может привести к токсикозу и острой печёночной недостаточности.
• Расторопша (Silybum marianum), Куркума (Curcuma longa), Одуванчик (Taraxacum officinale), Коптис (Picrorhiza kurroa), зелёный Чай (Camellia sinensis), Солодка (Glycyrrhiza glabra) и выдержанный Чеснок (Allium sativum) – хорошо известные натуральные средства для поддержки детоксикационной способности печени.
Химиотерапия вызывает кардиотоксичность и усталость.
• Экстракт Гинкго билоба (Ginkgo biloba) – отличное средство для профилактики и снижения острой кардиотоксичности, вызванной доксорубицином и, видимо, он будет так же полезен в случае терапии другими химиопрепаратами. Группа пациентов с IV стадией рака молочной железы, получавшая дополнительно к терапии доксорубицином экстракт гинкго (2×120 мг), имела меньшие сердечные поражения по сравнению с контрольной группой *.
• Йод проявляет у крыс сильные кардиопротекторные свойства во время лечения доксорубицином *.
• Кофермент Q10 (2×100 мг). Ряд исследований на животных показал, что CoQ10 предотвращает появление кардиотоксичности, вызванной приёмом доксорубицина, без снижения его противо
• Шалфей (Salvia miltiorrhiza) проявляет кардиозащитное действие in vitro и in vivo при терапии доксорубицином *.
• Зелёный чай в доклинических исследованиях также показал положительный эффект в отношении снижения повреждения сердца доксорубицином *.
• Ширококолокольчик (Platycodon grandiflorum) оказывает кардиозащитное действие у пациентов с ранним раком груди, проходящих химиотерапию на основе антрациклинов *.
• Ашвагандха (Withania somnifera). Экстракт корня растения (3×2 г), принимаемый внутрь пациентами на II и III стадии заболевания на протяжении всего курса химиотерапии, позволял снизить средний показатель усталости, вызванный процедурами. Кроме того, общая 24-месячная выживаемость у них составляла 72 % против 56 % в контрольной группе *. Более низкие дозировки позволяют нормализовать уровни гормонов щитовидной железы *.
• L-карнитин – эндогенная аминокислота, которая транспортирует жирные кислоты внутрь митохондрий. Пациенты, получавшие 3 г L-карнитина перед каждым циклом химиотерапии, а затем 1 г/сут в течение следующих 21 дня, не имели кардиотоксиности, вызванной антрациклином, в отличие от группы плацебо *.
Химиотерапия вызывает ослабление мозговой деятельности, проявляющиеся в виде нарушения внимания, скорости обработки информации, ухудшения памяти *.
• Жирные кислоты ω-3 в виде EPA (200 мг/сут) и DHA (1'000 мг/сут) позволяют вдвое снизить частоту невропатии
*.
В то же время потребление сахара (сахарозы и фруктозы), вызывает снижение нейрозащитной способности ω-3, и приводит к усилению нейровоспаления и ухудшению работы головного мозга
*.
• Астрагал (Astragalus membranaceus), водно-спиртовой экстракт, облегчает боль и стимулирует механизмы восстановления нервной ткани, повреждённой оксалиплатином *.
• Ним (Azadirachta indica). В опытах на животных лист дерева (экв. доза 2'800 мг/сут) позволял снизить нейротоксичность, вызванную цисплатином, хорошо сохраняя ткань мозга *.
• Гинкго билоба, экстракт (2×60 мг), принимаемый в течение всего курса химиотерапии и далее ещё 1 месяц после её завершения, помогает предотвратить ухудшение когнитивных способностей, вызванных химиотерапией *.
• Донепезил – препарат, использующийся при болезни Альцгеймера для улучшения передачи нервных импульсов. Женщины, принимавшие 5 мг/сут донепезила в течение до 24 недель химиотерапии, по некоторым параметрам функции памяти показали лучшие результаты по сравнению с женщинами, не принимавших его *.
Химиотерапия и лучевая терапия усиливают воспалительный уровень по причине появления большого количества мёртвых клеток. А воспаление, в свою очередь, стимулирует рост раковых клеток, оставшихся в живых *. Фактически, инъекция мёртвых опухолевых клеток в маленькие опухоли, привитые мышам, ускоряет их рост в сотню раз *. Поэтому так важно снижать уровень воспаления средствами, рассмотренными выше.
Химиотерапия нарушает спектр микрофлоры кишечника, что косвенно усиливает негативные побочные эффекты и может снизить эффективность лечения. Состояние и бактериальный профиль микрофлоры кишечника прямыми и косвенными путями может влиять на эффективность таких противо
Йогурты, другие молочные и капсулированные пробиотики обеспечат бактериологическую защиту кишечника в условиях поражения химиотерапией. Наличие в молокопродуктах фактора роста IGF-1 в данном случае не должно нас пугать, потому что стимулирование деления клеток будет вводить их в фазу деления – период, когда они особенно чувствительны к химиопрепаратам. Склоняя раковые клетки к делению во время химиотерапии, мы подставляем их под удар цитотоксических средств.
Для смягчения негативных последствий химиотерапии могут быть также использованы некоторые другие добавки.
• Имбирь и ромашка аптечная способны ослабить тошноту и рвоту, вызванную лучевой или химиотерапией *. Сухой экстракт корня имбиря в капсулах по 250 мг принимают трижды в день в течение шести дней, начиная за три дня до первого дня химиотерапии *. Вместо экстракта можно взять 1,5-2 г порошка сухого корня.
• Ликопин (2×25 мг), принятый перорально через 24-72 часа после введения цисплатина, может облегчить ослабить поражение почек у онкологических больных *.
• Жирные кислоты ω-3 (900 мг/сут) уменьшают частоту вызванных химиотерапией поражений слизистой оболочки, таких как стоматит и диарея *. Добавки жирных кислот ω-3 примерно на 7 % улучшали общую выживаемость пациентов с раком молочной железы, получавших традиционную химиотерапию *. Конъюгированная линолевая кислота (7,5 г/сут) в течение, по крайней мере, десяти дней до операции или химотерапии, снижала у женщин с раком молочной железы маркёры пролиферации раковых клеток * *.
• Аспирин снижает риск тромбоэмболии, вызываемый приёмом цитостатиков и тамоксифена, хотя применение аспирина именно с этой целью может оказаться не слишком выразительным *.
• Мелатонин (20 мг однократно на ночь), в течение семи недель лучевой и химиотерапии, вызывал меньше побочных эффектов химиотерапии по сравнению с группой плацебо *. В сочетании с различными химиотерапевтическими препаратами, мелатонин помогает значительно снизить их токсичность и увеличить показатель годичной выживаемости *. Кроме стандартных химиопрепаратов, мелатонин хорошо сочетается с натуральными действующими веществами, например, содержащимися в листьях алоэ (2 мл/сут) *. Кроме того, мелатонин обостряет чувствительность и снижает лекарственную устойчивость раковых клеток молочной железы к воздействию химиопрепаратов *.
• Модифицированная вода. Замена потребления водопроводной воды водой, обогащённой водородом, в течение 2 месяцев снижает окислительную нагрузку на здоровые ткани, улучшает показатели воспалительных маркёров, и увеличивает разнообразие кишечной флоры *. Кроме того, такая вода уменьшает вызванную цисплатином почечную дисфункцию, по крайней мере, у крыс *. Электроактивированная восстановленная (католитная) вода показывает такие же защитные эффекты у мышей *. Кроме того, католитная (щелочная) вода, по сравнению с контролем, задерживает у животных развитие опухолей молочной железы, уменьшает их множественность и значительно увеличивает безопухолевую выживаемость *.
Химиотерапия и лучевая терапия усиливают окислительный стресс. Антиоксиданты, такие как витамин C, мелатонин и витамин Е, как было выяснено в опытах, защищают животных от медикаментозной токсичности, не вмешиваясь при этом в противо
Антиоксиданты также защищают пациента от некоторых негативных побочных последствий облучения, в том числе язв и фиброза. Эти эффекты часто возникают из-за воспалительных процессов, и антиоксиданты могут этому воспрепятствовать. Особенно полезны в этом отношении витамин Е, рыбный жир и силимарин. Комбинация различных антиоксидантов, видимо, будет более эффективна, чем одиночные их добавки.
Имеются убедительные доказательства того, что ряд натуральных продуктов имеет мощные противораковые эффекты в отношении большого количества видов рака, даже самых устойчивых его форм. Тем не менее, онкологи продолжают убеждать своих пациентов не принимать натуральные антиоксидантные продукты. Некоторые из них даже не советуют есть свежие овощи, считая, что те помешают лечению.
Их аргументация состоит в том, что лучевая и химиотерапия создают огромное количество свободных радикалов, убивающих раковые клетки. Поэтому приём антиоксидантов во время сеансов химиотерапии выглядит нелогичным и контрпродуктивным. Однако за несколько часов до процедуры и после неё, пищевые антиоксиданты, видимо, будут более полезны, чем вредны, потому что они обычно имеют очень быстрый (0,5-1 час) период усвоения и такой же быстрый (3-4 часа) период метаболирования и выведения. Это обстоятельство требует учащения их приёма (2-4 раза в сутки).
Эффективность антиоксидантов сильно зависит от их начального запаса в организме, как это уже было рассмотрено †. При исходно низком антиоксидантном уровне добавки антиоксидантов во время химиотерапии могут защищать скорее нормальные клетки, чем раковые. А при исходно высоком антиоксидантном уровне они могут защищать также и раковые клетки. Это может частично объяснить тот парадоксальный факт, что высокие дозы антиоксидантов во время лечения в некоторых случаях снижают терапевтическую эффективность химиопрепаратов.
Несмотря на все эти разумные опасения, массив клинических исследований говорит скорее в пользу приёма некоторых (но не всех) антиоксидантных добавок пациентами с раком молочной железы. Например, добавки витаминов С и Е после диагностики ассоциировались со снижением риска рецидива на 20-27 % и снижением риска смерти на 18-22 % по сравнению с теми, кто не принимал их * * *. Однако добавки комбинированных каротиноидов ассоциировались с повышением риска рецидива на 23 % и риска смерти от рака в два раза *.
Это может быть связано с тем, что некоторые антиоксиданты, будучи окисленными, проявляют про-оксидантное действие. Соответственно, каротиноиды в высокой окислительной среде будут окисляться, проявляя негативный эффект вместо позитивного. К счастью, находясь в комбинации с другими витаминами, они будут окисляться значительно менее активно, и их негативный окислительный эффект будет снижен.
В качестве примера антиоксидантной добавки можно привести витаминно-минеральный комплекс «Optimal Health 51+» †. Конечно, не обязательно использовать именно его, но состав подобных комплексов * позволяет определиться с перечнем необходимых антиоксидантных компонентов:
витамин А (пальмитат) – 5'000 МЕ/сут,
витамин B1 (тиамин мононитрат) – 4 мг/сут,
витамин B2 (рибофлавин) – 5 мг/сут,
витамин B3 (ниацинамид аскорбат) – 30 мг/сут,
витамин B6 (пиридоксин гидрохлорид) – 5 мг/сут,
фолиевая кислота – 800 мкг/сут,
витамин B12 (цианокобаламин) – 10 мкг/сут,
витамин C (аскорбат кальция) – 1'500 мг/сут,
витамин D3 (холекальциферол) – 400 МЕ/сут,
витамин Е 400 МЕ (d-альфа-токоферилсукцинат – 300 МЕ/сут) + (d-альфа-токоферилацетат – 100 МЕ/сут),
биотин – 200 мкг/сут,
пантотеновая кислота (пантотенат D-кальция) – 10 мг/сут,
цитрат кальция – 225 мг/сут,
цитрат магния – 125 мг/сут,
глицинат цинка – 15 мг/сут,
селен (селено-L-метионин) – 100 мкг/сут,
хром (как пиколинат хрома) – 50 мкг/сут,
N-ацетилцистеин (NAC) – 250 мг/сут,
кофермент Q10– 200 мг/сут,
R-альфа-липоевая кислота – 45 мг/сут,
L-карнитин – 100 мг/сут,
природные смешанные каротиноиды – 15 мг/сут.
Приём добавок начинается, как минимум, за 48 часов до начала стандартной терапии и продолжается в течение 1 месяца после её завершения. Клинические испытания показывают, что такие поддерживающие дозы микронутриентов позволяют снизить риск рецидива опухоли *.
Но опять же, эффект антиоксидантов, как уже говорилось выше, зависит от их исходного уровня в ткани молочной железы. Поскольку у нас нет достоверного способа измерить его, приём антиоксидантов может вызвать неоднозначную реакцию. Кроме того, не будем забывать, что витамины и другие добавки – это не лекарство, а средство восполнения недостающих веществ при их неадекватном поступлении из пищи.
Окислительный стресс усиливает общий воспалительный уровень и, видимо, разумным будет обратиться к противовоспалительным средствам, рассмотренным ранее в разделе «Противовоспалительная терапия» †. Поскольку усталость и качество сна связаны с изменениями маркёров воспаления у пациентов с раком молочной железы, проходящих химиотерапию *, на это тоже стоит обратить своё внимание.
Рекомендации интегративной медицины. Общество интегративной онкологии (Society for Integrative Oncology *) на основе клинических исследований представило ряд рекомендаций по использованию дополнительной терапии во время и после курса лечения рака молочной железы * *.
Для ослабления вызванной химиотерапией тошноты и рвоты рекомендуются акупунктура * *, в том числе электроакупунктура *; и не рекомендуется глютамин * во время химиотерапии.
Для снятия тревожного состояния рекомендуется музыкальная терапия * *, медитация * *, программы управления стрессом * * и йога * * * *.
Для преодоления хронической усталости рекомендуются гипноз * *, женьшень * *, акупунктура * * и йога * *, хотя их эффективность может оказаться низкой; и не рекомендуются ацетил-карнитин * и гуарана *.
При нейропатии не рекомендуется ацетил-карнитин *.
Для уменьшения боли с небольшой уверенностью в успехе рекомендуются иглоукалывание * *, гипноз * и музыкальная терапия *.
Для улучшения качества жизни рекомендуются медитация * и йога *.
При расстройствах сна может помочь мягкая йога *.
Особенности питания в период противораковой терапии. Процедура традиционного лечения сопровождается рядом проблем, связанных питанием, таких как тошнота, потеря аппетита, изменения во вкусе или запахе, запор или диарея, сухость или боль во рту или горле, рвота, прибавка или потеря в весе. Национальный онкологический институт США (National Cancer Institute) разработал рекомендации, позволяющих облегчить все эти симптомы *.
Диета раковых больных должна быть основана на продуктах и напитках, которые не питают раковые клетки и не мешают лечению.
Белок обеспечивает раковые клетки готовым строительным материалом для создания новых клеток. Поэтому раковым пациентам, видимо, будет полезным снизить потребление белка до физиологического минимума, который составляет 0,8 грамма на 1 кг массы тела *. Тем не менее, при химиотерапии, когда требуется большое количество аминокислот для восстановления погибающих здоровых клеток (в первую очередь – клеток крови и иммунных клеток), некоторое увеличение потребления белка может быть оправданным. При этом более разумным будет выбрать растительный белок. Он содержит достаточное количество незаменимых аминокислот, однако мало аминокислот, способствующих росту раковых клеток.
Эпителиальные клетки, выстилающие поверхность толстого кишечника, обновляются очень быстро, и легко поражаются цитотоксичными препаратами, использующимися во время химиотерапии. Поэтому в этот период рекомендуется диета, щадящая кишечные клетки. Семя льна *, чиа и рыжея, благодаря своей способности создавать слизь, могут снизить механическое травмирование эпителия ЖКТ пищевой массой.
Голодание. Как показали ограниченные исследования, краткосрочное голодание (допускающее только воду) значительно улучшает общее состояние и снижает симптомы, вызванные химиотерапией *. Здоровые клетки метаболически более гибкие, чем раковые, и поэтому при дефиците глюкозы им легче переключиться на потребление жирных кислот и кетоновых тел. В то же время опухолевые клетки хуже адаптируются к голоданию. Гликолизные клетки требуют поставок большого количества глюкозы, белков и факторов роста, дефицит которых делает их более слабыми и чувствительными к химиотерапии *. Краткосрочное голодание защищает от различных химиопрепаратов нормальные клетки, одновременно с этим ослабляя раковые клетки * * *.
В здоровых клетках лишение питания активирует защитные метаболические пути, которые останавливают деление клеток, очищают цитозоль клетки, и направляют энергию на повышение устойчивости к стрессу, в том числе активируют множественную лекарственную устойчивость. В то же время в опухолевых клетках этот защитный эффект ограничен вследствие генетических/эпигенетических мутаций метаболических путей, которые склоняют клетку к неконтролируемому росту. Кроме того, ограничение калорий способно изменять характеристики микроокружения опухоли, ухудшая обеспечение раковых клеток, уменьшая циркуляцию факторов роста и снижая местное воспаление *.
В доклинических моделях было выявлено, что уже одних только циклов голодания достаточно для замедления роста опухоли. В некоторых случаях голодание по своей эффективности соответствовало химиотерапии и синергично действовало со стандартной терапией * *. Опыты на грызунов подтвердили эти наблюдения. Если кризотиниб или голодание сами по себе снижали рост привитой опухоли примерно на треть, то их сочетание – ещё на столько же *. Небольшая потеря веса животными во время голодания быстро компенсировалась в перерывах между циклами голодания. В опытах на собаках 24-часовое голодание перед химиотерапией значительно снижало частоту рвоты, вызванной доксорубицином *.
Размеры и количество опухолей у грызунов, вызванных химическим канцерогеном, значительно уменьшались при ограничении калорийности пищи * *. В одном из опытов обнаружилось, что снижение калорийности заметнее влияет на появление опухоли, чем на скорость её дальнейшего развития *. То есть, профилактический эффект низкокалорийной диеты выражается сильнее, чем терапевтический.
Кроме того, 50 %-ное ограничение калорийности питания мышей оказывало сильный антилейкемический эффект. После воздействия гамма-излучения, только у 3 % грызунов из опытной группы развился лейкоз, тогда как в опытной группе, получавшей питание без ограничений, лейкоз развился у половины животных *. Другие подобные опыты на животных показали близкие результаты * *.
Клиническое исследование показало, что пациентов с HER2-подтипом рака груди голодание в течение 36 часов до химиотерапии и 24 часов после неё снижает побочные эффекты химиотерапии *. В другом клиническом испытании, пациенты со II-III стадией HER2-негативного рака молочной железы, которые придерживались голодания, начавшегося за 24 часа до начала химиотерапии (доцетаксел/доксорубицин/циклофосфамид) и закончившегося после 24 часов после неё, имели значительное увеличение среднего количества эритроцитов и тромбоцитов через 7 дней после лечения, а также снижение вызванной химиотерапией повреждение ДНК и/или ускорение его восстановления *. Снижение тяжести побочных эффектов химиотерапии в этом исследовании не было выразительным, что можно объяснить слишком коротким периодом голодания: для серьёзных изменений уровня фактора роста IGF-1 требуется более длительный период голодания * *.
В другом клиническом исследовании голодание у пациентов с различными видами рака продолжалось в течение 48 часов до химиотерапии на основе платины, и 24 часов после неё. Увеличение продолжительности голодания до 48 и 72 часов снизило повреждение ДНК в лейкоцитах, и незначительно снизило нейтропению по сравнению с голоданием в течение 24 часов. Уровни IGF-1 снижались на 30 %, 33 % и 8 % соответственно при 24, 48 и 72-часовом голодании *. Легче всего побочные эффекты химиотерапии переносились пациентами в группе 72-часового голодания.
Ещё один обзор описал 10 случаев пациентов с раком, добровольно голодавших в общей сложности 48-140 часов до химиотерапии и/или 5-56 часов после неё. У них значительно снижались такие вызванные химиотерапией симптомы, как рвота, диарея, слабость, головная боль, тошнота, колики в животе, сухость и язвы во рту *. Побочными эффектами были лишь чувство голода и головокружение. При этом не нашлось никаких оснований полагать, что краткосрочное голодание мешает эффективности химиотерапии или защищает опухоль. К сожалению, число научных отчётов ограничено, поэтому данная тема требует дополнительных исследований.
В противоположность краткосрочному, долгосрочное голодание потенциально способно повысить выживаемость раковых клеток за счёт увеличения в них аутофагии * *. Можно предположить, что длительное голодание может оказаться эффективным механизмом лечения опухоли *, если её сочетать с иммуномодуляторами и ингибиторами аутофагии, однако этот подход пока практически не изучен.
Пока не ясно, как голодание может повлиять на появление рецидива и выживаемость пациента. Однако краткосрочное голодание в комбинации с химиотерапией является многообещающей стратегией повышения эффективности химиотерапевтических веществ и снижения их негативных эффектов. При этом оно безопасно и хорошо переносится * *, однако, как и любая другая терапия, имеет ряд условий, оговорок и точек контроля.
Хотя существует несколько концепций терапии голодом *, пока не разработаны стандартные протоколы краткосрочного голодания при опухолевых заболеваниях. Лечащий врач, скорее всего, не согласится с этой идеей. Таким образом, принятие решения о голодании во время химиотерапии остаётся в зоне ответственности самого пациента.
Кетогенная диета может быть дополнительной стратегией терапии различных видов рака, включая рак молочной железы.
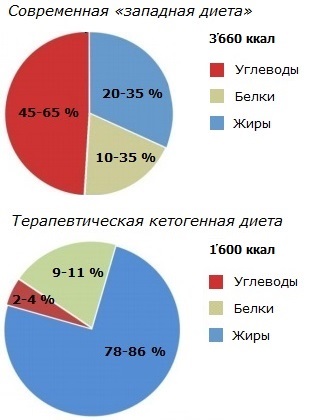
Классическая кетогенная диета определяется как диета с ежедневным потреблением 1 грамма белка на 1 килограмм массы тела, 10-15 г углеводов и оставшимися калориями из жира *. Фактически, это низкокалорийная (~ 1'600 ккал/сут) диета, при которой от 75 % до 90 % всей энергии поступает из жиров (желательно, среднецепочечных), от 8 % до 20 % – из белков, и от 2 % до 6 % – из углеводов (по возможности, сложных) *.
Кетогенная диета должна вводить организм в метаболическое состояние, которое называется кетоз. При кетозе клетки питаются не глюкозой, а почти полностью кетоновыми телами (β-гидроксибутират, ацетоацетат и ацетон), которые метаболируются из пищевого жира. Терапевтическая цель кетогенной диеты – создать энергетический голод для высокогликолитических (раковых) клеток, лишив их обильного снабжения основным источником энергии – глюкозы. Предполагается, что в результате нехватки энергии основная часть раковых клеток погибнет через апоптоз, а оставшиеся в живых значительно замедлят свой рост.
Глюкоза может превращаться в энергию либо путём окислительного фосфорилирования в митохондриях, либо путём ферментирования в цитозоле клетки. Первый путь метаболизма характерен для нормальных клеток, а второй – для раковых клеток. В отличие от глюкозы, кетоновые тела не являются ферментированным источником для производства энергии, и метаболируются только через окислительное фосфорилирование.
Поэтому, чтобы эффективно переключить свой метаболизм с глюкозы на кетоновые тела, клетки должны иметь функциональные митохондрии. В раковых клетках митохондриальный способ производства энергии в той или иной степени ослаблен из-за деградации митохондрий, а гликолиз, хотя и усилен, но по сравнению с митохондриями даёт очень мало энергии на единицу глюкозы. По этой причине жизнь раковых клеток очень сильно зависит от поступления глюкозы.
Снижение потребления углеводов при кетогенной диете резко ограничивает возможности клетки получать энергию из глюкозы. Кроме того, кетоновые тела и жирные кислоты не могут заменить глюкозу в клетках с дефектными митохондриями. Поскольку они не ферментируются, для получения энергии из них требуется окислительное фосфорилирование. Это значит, что раковые и нераковые клетки с дисфункциональными митохондриями *, будут испытывать недостаток энергии, и риск их смерти будет увеличен. Гибель нераковых клеток со слабыми митохондриями может приводить к «омоложению» здоровой ткани, а гибель раковых клеток с нефункциональными митохондриями может приводить к сокращению опухоли.
В то время, как метаболизм глюкозы может протекать при любой концентрации кислорода, кетоновые тела и лактат могут метаболизироваться раковыми клетками только при наличии достаточного количества кислорода *. Поэтому от кетогенной диеты сильнее всего будут страдать клетки в наиболее гипоксических местах, таких как опухолевая ткань. Им труднее производить энергию из кетоновых тел, даже имея функциональные митохондрии.
Усилить эффективность кетогенной диеты можно за счёт дополнительного сокращения поступления глютамина – ещё одного источника энергии раковых клеток, образуемого в результате метаболизма пищевого белка *. На данный момент не предложено высокоэффективных и безопасных ингибиторов глютаминолиза. Доступным, хотя и малоэффективным средством ингибирования глютаминолиза являются полифенолы зелёного чая *. Хотя кетоны сами по себе уменьшают поглощение глютамина, представляется разумным ограничить потребление белка, особенно животного, который является очень обильным источником глютамина. Проще не допустить поступления глютамина, чем бороться с ним потом.
Кроме того, в данной терапии также может оказаться полезным ацетил-L-карнитин, поскольку он помогает транспортировать жирные кислоты внутрь митохондрий здоровых клеток.
Теоретически, кетогенная диета может: одновременно воздействовать на несколько факторов быстрого роста опухоли; способствовать доставке лекарств в опухолевую ткань; усиливать действие антиглютаминных стратегий; снижать кислотность в опухолевой ткани; увеличивать метаболическую эффективность в нормальных клетках *. Таким образом, она выглядит достойным кандидатом дополнительной терапии. Тем не менее, увеличение концентрации в организме кетонов имеет более глубокое и разнообразное влияние, причём не всегда положительное.
В одном их опытов на мышах при питании без ограничения калорий, кетогенная диета вызывала значительное снижение уровня глюкозы в крови, скорости роста опухоли и увеличение среднего времени выживания животных на 57 % по сравнению с контрольной группой, а её сочетание с гипербарической оксигенацией увеличивало время выживания до 78 % *. Даже просто добавки кетонов в пищу значительно продлевали выживаемость мышей с метастатическим раком *. Однако, не все исследования показали такие выразительные результаты.
В 2020 году около 60 % доклинических исследований (в основном, глиобластомы) сообщили о противо
При этом кетогенная диета, похоже, не является универсальной, её эффективность может зависеть от типа или даже подтипа рака, генетического фона или синдрома, связанного с опухолью * *. Она наиболее перспективна при миоглиоме (одной из форм рака головного мозга); но при раке молочной железы единичные клинические исследования показывают более скромные результаты. Тем не менее, в клинических исследованиях кетоз на протяжении 3 недель улучшал показатели биологических маркёров при HER2-раке молочной железы *.
Кетогенная диета на протяжении 3-12 месяцев способна значительно снизить у пациентов уровень глюкозы в крови, индекс массы тела, общий холестерин, триглицериды, липопротеины низкой плотности (ЛПНП), а также улучшить показатели липопротеинов высокой плотности (ЛПВП) * *. Падение уровня глюкозы сопровождается падением уровня инсулина и инсулино-подобного фактора роста (IGF-1) *, снижением уровня молочной кислоты в опухолевой ткани *, а также ферментов, активируемых инсулином * *.
Контролируемое клиническое исследование 3-месячной кетогенной диеты с участием пациентов с раком молочной железы, проходящих курс стандартной химиотерапии, показали в опытной группе снижение уровня TNF-α на 36 %, а также небольшое снижение уровня инсулина и IGF-1. При местнораспространённом раке опухоль сократилась по сравнению с первоначальным размером: в опытной группе пациентов на 50 %, а в контрольной группе – на 15 %. Однако при метастазирующем раке сокращение размеров опухоли не наблюдалось *.
В этом иследовании суточная калорийность в опытной группе была уменьшена с 1'704 ккал до 1'325 ккал, а в контрольной – с 1'767 ккал до 1'600 ккал. Доля жиров в общей калорийности в опытной группе составляла 74 %, белка – 19 %, углеводов – 7 %; а в контрольной, соответственно, 30 %, 15 % и 55 %. Как видим, даже обычная, но низкокалорийная диета позволила химиотерапии реверсировать развитие опухоли.
Сообщалось также, что у женщины с TNBC, которая одновременно с химиотерапией, гипертермией и гипербарической оксигенацией придерживалась 6-месячной кетогенной диеты, наблюдались полный клинический, радиологический и патологический ответ *. Однако это был единственный клинический отчёт о ремиссии, которая была связана с кетогенной диетой.
В интернете достаточно много ресурсов, помогающих желающим перейти на кетодиету *. Однако многие из предлагаемых диет, строго говоря, не являются кетогенными, а всего лишь представляют собой диеты с повышенным потреблением жиров, которые могут не обеспечить кетоз, а значит, не позволят достигнуть поставленной цели, и лишь ухудшат начальные условия. Не удивительно, что практически все онкологические организации рекомендуют структуру диеты, прямо противоположную кетодиете, а именно – много овощей и мало жира.
Фактически, настоящая кетогенная диета – это не диета с высоким абсолютным количеством жира, это диета с высоким относительным количеством жира. Иначе говоря, это низкокалорийная диета с очень низким уровнем углеводов и белков, что автоматически увеличивает долю жира в общей калорийности. Абсолютное же количество потребляемого жира, по сравнению с питанием без ограничений, если и увеличивается, то не радикально.
Многие люди, практикующие кетогенную диету, упускают ещё одно важное обстоятельство – необходимость постоянного мониторинга уровня кетоза. Зона терапевтического кетоза определяется как устойчивая гипогликемия (уровень глюкозы ~ 2,5-3 мМ/л, т.е. 55-75 мг/дл) с повышенным уровнем кетонов в крови (~ 4 мМ/л; не менее 2 мМ/л, и не более 10 мМ/л) *. Ориентироваться следует на соотношение кетоны:глюкоза в крови, равное 1:1, или выше, в мМ/л. Стабильный кетоз в течение последующих 6-8 недель позволяет обострить чувствительность раковых клеток к химиотерапии при глиобластоме * и к лучевой терапии при глиоме *. Надёжным косвенным индикатором состояния кетоза является запах ацетона в выдыхаемом воздухе *.
Обычно пациентам на кетодиете предлагают потреблять, в основном, среднецепочечные жиры, добавляя в небольших количествах жирную рыбу, сыр, мясо, орехи, авокадо и некрахмалистые овощи. Один из корифеев кетогенной диеты, Томас Сейфрид (Thomas Seyfried) *, рекомендует плавный переход на неё в течение нескольких дней, чтобы переключение метаболизма не вызывало стресса * *.
Рекомендуемые при кетогенной диете жиры – оливковое, кокосовое, сливочное масла, масло авокадо, масло макадами, рыбный жир. Все они не склонны вызывать гормональную сигнализацию (MTOR, лептин, инсулин) и воспаление. Обычно рекомендуют рафинированное кокосовое масло, содержащее не менее 85 % среднецепочечных триглицеридов (MCT). Хотя насыщенные жиры гораздо легче и полнее превращаются в кетоны, чем полиненасыщенные, возможно, даже при кетогенной диете будет оправданным соблюдать соотношение насыщенных жиров к ненасыщенным ~ 1:4. А соотношение жиров ω-3:ω-6 ~ 1:3.
Если следовать руководящим рекомендациям кетогенной диеты, то при калорийности 1'800 ккал/сут весовое потребление макронутриентов будет выглядеть примерно так: углеводы – 8 г/сут, белки – 36 г/сут, жиры – 180 г/сут. В пересчёте на обычные продукты питания это можно представить как 20 г хлеба, 150 г мяса и 200 г масла в сутки. При дальнейшем снижении калорийности до 1'200 ккал/сут, количество этих продуктов придётся пропорционально сократить на треть.
Структура потребления должна корректироваться по результатам измерения уровня глюкозы и кетонов в крови. Если рекомендации по структуре питания выдерживаются, но уровень глюкозы недостаточно низок, снижают потребление углеводов и белка. Если уровень кетонов недостаточно высок, увеличивают жировую составляющую диеты, не выходя за предел заданной суточной калорийности. Если нужно уменьшить уровень глютамина, снижают потребление белка.
Потребление 200 граммов жира в сутки – это в абсолютных цифрах даже больше, чем в таких странах-рекордсменах по раку груди, как Бельгия и Франция. Множество наблюдательных исследований демонстрирует, что при питании без ограничения калорий увеличение доли жира в общей калорийности выше 20 % ассоциируется с ростом риска рака груди. В опытах на грызунах, заболеваемость раком груди росла одновременно с ростом энергии, получаемой из жира, вплоть до значения 35 %E, после чего она выходила на плато *.
При одной и той же калорийности рациона увеличение доли жира в поступающей с пищей энергии происходит, в основном, за счёт уменьшения доли углеводов, потому что потребление белка меняется незначительно. Т.о., рост заболеваемости раком груди ассоциируется с изменением соотношения углеводы:жиры в общей калорийности. При пропорции 3,5:1 риск минимальный, но при пропорции 1:1 он увеличивается вдвое †. В кетогенной же диете предлагается ещё большее ухудшение этой пропорции – 1:10. Конечно, имеющиеся данные указывают на то, что при низкой калорийности питания негативное влияние жиров если и проявляется, то слабо *, что может смягчить наши опасения.
Помимо плюсов кетогенной диеты, существуют и минусы. Высокожировая диета может увеличить нагрузку на печень, перерабатывающую жир в кетоны; на почки, выводящие продукты распада; на поджелудочную железу, вырабатывающую жирорасщепляющие ферменты; и на жёлчный пузырь. Всё это может создать некоторые проблемы у пациентов с хроническими проблемами этих органов.
В действительности кетогенная диета неестественна и некомфортна, поэтому большинство исследований обнаружило плохое соблюдение её режима *. В основном, пациенты увеличивают суточное потребление калорий. В то же время, опыты на мышах показали, что кетогенная диета без ограничения калорий может увеличивать массу тела и уровни глюкозы *, что, конечно же, будет действовать контрпродуктивно.
В опытах с мышами на диете без ограничения калорий, инъекции кетоновых тел увеличивали рост TNBC-опухоли примерно в 2,5 раза *. Это не является доказательством, однако хорошо согласуется с высокой заболеваемостью раком больных диабетом, у которых производство кетонов увеличено. Кетоны, подобно лактату, сильно влияют на экспрессию генов, которые усиливают «стволовые» характеристики ER+ раковых клеток *, чем значительно снижают выживаемость пациентов. В опытах на крысах длительная кетогенная диета без ограничения калорий, по сравнению с равной по калорийности стандартной диетой, вызывает закисление крови (кетоновые тела кислые), анемию (более низкие уровни эритроцитов, гемоглобина и гематокрита) и падение уровня антиоксидантных ферментов *.
Доклинические исследования показывают, что кетогенная диета без ограничения калорий не может снизить уровень глюкозы в крови и сдерживать рост опухоли * * * * * * * * *. В то время как дополнительное ограничение калорий и увеличение доли жира за счёт белков и углеводов приводит к значительному снижению уровня глюкозы в крови и торможению роста опухоли мозга * * * *. Все эти данные подталкивают к выводу, что противоопухолевый эффект терапевтической кетодиеты на самом деле обуславливается именно снижением общей калорийности, что снижает уровень циркулирующей глюкозы, в то время как диеты без ограничения калорий малоэффективны против рака.
Кетогенная диета увеличивает количество перекисных липидов, ухудшает снабжение глюкозой эритроцитов, нейронов и других клеток, неспособных к эффективному метаболизму жиров. Кетогенная диета противопоказана пациентам с диабетом I типа, гипертонией, высоким индексом массы тела, а также людям преклонного возраста. Побочными эффектами кетогенной терапии могут быть тошнота, диарея, запор, слабость, усталость, головокружение, бессонница, запах ацетона изо рта.
Сообщалось также, что кетоновые тела не всегда оказывают противоопухолевое действие. Они сами по себе могут вести себя как онкометаболиты, а ферменты, участвующие в их метаболизме, являются метаболическими онкогенами. Имеются некоторые генетические доказательства того, что производство и повторное использование кетоновых тел ведёт к прогрессированию и метастазированию опухоли молочной железы *. Кетогенные фибробласты обеспечивают производство кетоновых тел непосредственно в опухоли, а раковые клетки используют их для производства энергии в своих митохондриях. Таким образом, теоретические основы кетогенной диеты остаются недостаточно разработанными.
Классическая кетогенная диета является неполноценной и поэтому требует приёма соответствующих добавок *. Даже при потреблении продуктов, богатых питательными веществами, она значительно снижает поступление многих фито- и микро-нутриентов *, что может негативно отразиться на результате лечения. Особенно это касается пищевых полифенолов, витаминов группы B, C, D, K, а также йода, селена, калия, кальция, цинка, железа и магния. У тех, кто придерживается строгой кетогенной диеты, было обнаружено недостаточное потребление 17 микроэлементов, витаминов и минералов *.
При недостаточности клетчатки, кетогенная диета будет угрожать нарушением баланса кишечной микрофлоры и усилением бактериального проникновения через кишечную стенку. Деградация кишечной микрофлоры может дестабилизировать микрофлору других органов, снизить иммунитет, вызвать витаминный дефицит и увеличить риск рака толстой кишки *. Поэтому при кетогенной диете можно порекомендовать добавки клетчатки, а также растительный белок вместо животного. Манипуляционные исследования выявили, что кетогенные диеты на основе сывороточного или растительного белка имеют более безопасный профиль и обеспечивают более здоровый состав микробиоты, чем препараты, содержащие животные белки *.
На сегодняшний день нет достаточного количества убедительных доказательств, демонстрирующих эффективность кетогенной диеты против прогрессирования опухоли в длительной перспективе или общей выживаемости больных раком *, поскольку большинство клинических исследований являются наблюдательными, неконтролируемыми и краткосрочными.
Так же, как и голодание, краткосрочная низкокалорийная кетогенная диета теоретически может оказаться безусловно полезной перед любым хирургическим вмешательством, во время лучевой * или химиотерапии *. Естественно, при отсутствии противопоказаний и при одобрении лечащего врача. Однако кетогенная диета не годится как стиль регулярного питания даже при одновременном приёме добавок микронутриентов, клетчатки, пробиотиков и жирорасщепляющих ферментов. Даже когда кетогенная диета используется с целью добиться снижения веса, она не демонстрирует выразительных преимуществ по сравнению с низкокалорийной низкожировой диетой * * *.
Все разновидности длительной кетогенной диеты могут вызывать устойчивую скорость потери костной массы, измеренную в позвоночнике *, предположительно из-за того, что кетоны являются кислыми соединениями. Они также могут вызывать у пациентов желудочно-кишечные проблемы *. Кроме того, они не дают возможности наращивать мышечную массу *, могут способствовать ослаблению сердечной мышцы и, что не исключается, даже катастрофической потере веса раковыми пациентами (кахексии).
Несмотря на широко распространённые надежды на кетогенную диету, она всё ещё остаётся экспериментальной. Единичные клинические исследования дают оптимистичные результаты при её использовании в течение ограниченного времени. Что же касается долгосрочной кетогенной диеты, то до сих пор нет убедительных клинических подтверждений перевеса её плюсов над её минусами для большинства людей *. Снижение калорийности питания до уровня физиологического минимума нивелирует наглядную пользу кетогенной диеты, которая остаётся неполноценной без добавок тех нутриентов, которые естественно присутствуют в диете с высокой долей клетчатки.
Убедительным плюсом кетогенной диеты является урезание энергетического снабжения раковых клеток, однако таких же точно успехов можно добиться более изученными и щадящими, и при этом менее опасными и дискомфортными методами *. Например, низкокалорийной, низкогликемической овощной диетой, которая сопровождается регулярными постами, увеличением длительности ночного воздержания от пищи, имитацией голодания и т.п. *. Несмотря на то, что в краткосрочных исследованиях кетогенные диеты незначительно выигрывали у диет с ограничением жиров в плане улучшения показателей здоровья *, в долгосрочной перспективе они не выглядели лучше *, сохраняя при этом все перечисленные выше недостатки.
Многие люди утверждают, что кетогенная диета позволила им улучшить своё самочувствие и некоторые физические показатели. Нет никаких оснований приписывать все эти случаи эффекту плацебо. Кетогенная диета может отбраковывать клетки с дефектными митохондриями, а это, несомненно скажется на здоровье благоприятным образом. Исходя из этого, периодическое краткосрочное обращение к настоящей терапевтической кетогенной диете может оказаться полезным не только для людей, подвергающимся традиционной противораковой терапии, но и для людей с метаболическим синдромом, с предраковым состоянием, диабетом II типа, а также пожилым людям. Однако её нельзя рекомендовать в качестве постоянной диеты даже этим категориям.
Физическая активность. Интенсивные физические упражнения во время курса химиотерапии оказывают положительный эффект для выживания при раке молочной железы. В течение года после лечения, женщины, занимавшиеся аэробикой, ощущали значительное снижение усталости, облегчение общих симптомов, снижение избыточной массы тела, улучшение эмоционального состояния, и скорее возвращались к трудовой деятельности *.
Физические упражнения, проводимые во время и после курса лечения рака молочной железы, явно снижают показатели общей смертности, независимо от возраста, индекса массы тела и стадии заболевания пациентов *.
Существует два типа лучевой терапии. Внешняя лучевая терапия для направления излучения к опухоли использует оборудование, которое расположено вне организма. Внутренняя лучевая терапия использует радиоактивные вещества в запечатанных капсулах, которые размещаются непосредственно в опухоли или вблизи неё, внутри организма.
Оба эти подхода не только поражают клетки раковой опухоли, но также неизбежно повреждают здоровые клетки – соседние или лежащие по пути следования гамма-лучей. Если облучение становится неизбежным, попытайтесь найти клинику, оборудование которой обеспечит более точное нацеливание на опухоль и более щадящее воздействие на организм, например, используя гамма-нож или протонное излучение.
Ионизирующее излучение разрушает белковые структуры и молекулы, включая клеточные органеллы и ДНК, и создаёт высокую концентрацию свободных радикалов, что приводлит к гибели поражённых клеток. Фактически, оно создаёт умеренный внутренний ожог, подобный тому, который может наблюдаться на коже под действием облучения. Последовавшее за этим сильное воспаление может перезапустить процессы репарации ткани, которые в опухоли спутаны и хаотизированы.
Многие натуральные вещества, а также некоторые используемые для других целей безрецептурные средства, способны усилить эффективность лучевой терапии и снизить тяжесть её побочных эффектов.
Усиление эффективности лучевой терапии. Лучевая терапия создаёт окислительный стресс и разрушает белковые структуры, в том числе молекулы ДНК. При невозможности восстановления поломки ДНК, клетки погибают путём апоптоза. При помощи дополнительных средств можно усилить оба эти действия ионизирующего излучения.
Усиление окислительного стресса в некоторых случаях может быть достигнуто с использованием следующих средств.
• Сульфасалазин, противо
• Мебендазол, противо
• Тайленол, обезболивающий и жаропонижающий препарат. Ацемитофен в течение четырёх часов после внутрибрюшинной инъекции (экв. 40 мг/кг) снижал у мышей уровень глутатиона на 70-80 % *.
• Партенолид из Пижмы девичьей (Tanacetum parthenium) вызывает почти полное истощение глутатиона и гибель раковых стволовых клеток лейкемии, вызывая в то же время при значительно меньшей токсичности ограниченное и обратимое истощение глутатиона в нормальных клетках *. Партенолид in vitro (20 мкМ) уже сам по себе значительно подавлял жизнеспособность клеток TNBC (MDA-MB231, BT20 и MDA-MB436), оказывая при этом на здоровые клетки лишь умеренный эффект *. У мышей с привитой TNBC-опухолью (MDA-MB231) он значительно снижал её рост, и повышал выживаемость животных *. У мышей с привитой опухолью простаты партенолид (экв. 8 мг/кг) защищал нормальные, но не опухолевые ткани простаты от апоптоза, вызванного высокими дозами радиации *. Проблемой остаётся низкая биодоступность партенолида.
• Витамин C в виде высокодозовых внутривенных вливаний (экв. 25 г/сут) также истощает внутриклеточные запасы антиоксидантов, а кроме того, подавляет гликолиз, заставляя гликолизные клетки голодать *. Оба эти эффекта могли бы усилить результативность лучевой терапии. Добавки доксициклина сокращают дополнительно к этому и клеточную энергию, получаемую из аэробного дыхания. Предварительная 2-недельная обработка доксициклином (200 мг/сут) предположительно могла бы усилить действие витамина C *.
Истощение внутриклеточных антиоксидантов могло бы помочь достигнуть требуемого эффекта при более низком уровне облучения. Но врачи по ряду причин вряд ли согласятся на изменение протокола лечения. Их позиция понятна: процесс управления уровнем антиоксидантов конкретно в опухоли представляет значительные трудности и не позволяет объективно его контролировать.
Вопрос, какой из двух вариантов выбрать – оксидантный или антиоксидантный, вызывает непримиримые споры.
Оксидантный подход, как можно опасаться, может усилить уничтожение не только раковых, но и здоровых клеток, а также усугубить некоторые побочные эффекты лечения. Тем не менее, перечисленные здесь средства показывают в исследованиях положительное действие. Можно предположить, что нормальные клетки способны быстрее восстанавливать внутриклеточные запасы антиоксидантов, чем раковые. Если это недоказанное предположение верно, то введение препаратов, истощающих глутатион, следует проводить на протяжении 3-4 часов, и закончить за 1-2 часа до начала сеанса лучевой терапии. За это время они должны попасть в опухолевую ткань и накопиться там, но успеют в значительной мере удалиться из нормальной ткани.
Антиоксидантный подход позволяет любым клеткам легче пережить окислительный стресс, вызванный облучением. Однако опухолевым клеткам антиоксиданты попадают в меньшем количестве из-за транспортных затруднений, вызванных густой сетью волокон внеклеточного матрикса и внутриопухолевого давления. Исходя из этих соображений, небольшие количества антиоксидантов могут, видимо, поддержать нормальные клетки без существенной поддержки раковых клеток. По причине, изложенной в предыдущем абзаце, пероральное введение антиоксидантов, видимо будет наиболее полезным примерно за 1 час до начала сеанса лучевой терапии. За это время их концентрация должна достигнуть максимума в нормальной ткани, но не успеет в значительной мере увеличиться в опухолевой ткани.
Различные антиоксиданты могут по-разному проявлять своё действие. В то время как глутатион может поддерживать жизнестойкость раковых клеток, пищевые антиоксиданты не делают этого. Дегидроаскорбиновая кислота, продукт метаболизма аскорбиновой кислоты, обостряет чувствительность раковых клеток гипоксической опухоли к лучевой терапии *.
На основе научного подхода был разработан комплекс витаминов * *, который должен обеспечить наилучшее действие антиоксидантов во время лучевой терапии, главных из которых четыре: буферированый витамин С (аскорбат кальция, 9'000 мг/сут), натуральный витамин Е (α-токоферилсукцинат, 1'000 МЕ/сут), натуральный витамин А (ретинола пальмитат, 10'000 МЕ/сут) и натуральный витамин В (β-каротин, 90 мг/сут). Высокие дозы этих витаминов повышают эффективность лучевой терапии, в то время как их низкие дозы могут наоборот, способствовать выживанию раковых клеток. Т.е. в данном случае они действуют не как метаболические, а как терапевтические вещества.
Во время фазы активного лечения эти пищевые микронутриенты ежедневно вводятся перорально дважды в день, начиная за 48 ч до облучения, и продолжаются в течение всего периода лучевой терапии. После завершения лечения дозировка в течение 4-недельного периода плавно снижается наполовину, и сохраняется в течение поддерживающей фазы. Таким образом, повреждение в раковых клетках начинается до облучения, действует в течение терапийного периода, и препятствует рецидиву после него.
Низкий уровень кислорода в опухолевой ткани может увеличивать радиационную стойкость опухолевых клеток, что требует для их поражения значительно более высоких доз радиации. Поэтому увеличение концентрации кислорода могло бы повысить уровень свободных форм кислорода и тем самым усилить окислительный эффект лучевой терапии.
• Метформин, вводимый мышам непосредственно перед облучением, увеличивал уровень кислорода в ткани, чем заметно улучшал радиационный эффект лечения привитой опухоли. А у пациентов с локализованным раком простаты, получавших лучевую терапию, использование метформина было связано со значительным снижением частоты ранних рецидивов *.
• Мелатонин. Обработка мелатонином перед лучевой терапией была связана с уменьшением пролиферации клеток и увеличением экспрессии мРНК р53, что приводило к увеличению радиочувствительности клеток рака молочной железы. В то же время было отмечено снижение побочных эффектов, вызванных радиацией, у пациентов с раком молочной железы *.
• Гипертермия является эффективным дополнением лучевой терапией благодаря своей способности повышать насыщенность опухоли кислородом, и может повышать действие метформина против раковых клеток, в том числе, стволовых *.
Подавление восстановления молекул ДНК. Некоторые вещества могут усилить действие лучевой терапии путём препятствования ремонта повреждённых радиацией белковых структур, что будет способствовать гибели облучённых клеток.
• Метформин, снижая энергетическое обеспечение клеток, может усложнить энергозатратный процесс репарации повреждённых радиацией молекул ДНК, и повысить таким образом чувствительность раковых клеток к лучевой терапии. Добавление метформина (2'000-3'000 мг/сут) к стандартному химио-радиационному протоколу с использованием цисплатина показало обнадёживающее улучшение двухлетней безрецидивной выживаемости пациентов с немелкоклеточным раком лёгких *.
• Доксициклин in vitro очень сильно снижает экспрессию белка DNA-PK, который восстанавливает повреждённую лучевой терапией ДНК, тем самым усиливая чувствительность CSC молочной железы в 4,5 раза *. Дозировка: 200 мг/сут.
• Никлозамид, противо
Другие усилители.
• EGCG (эпигаллокатехин галлат) в капсулах (3×400 мг) во время лучевой терапии (2-8 недель) заметно улучшает некоторые маркёры опухоли. По сравнению с пациентами, получавшими только лучевую терапию, пациенты с добавкой EGCG показывают значительно более низкие уровни в сыворотке крови фактора роста эндотелия сосудов (VEGF), фактора роста гепатоцитов (HGF) и сниженную активацию металлопротеиназы-9 (MMP9) и металлопротеиназы-2 (MMP2). Таким образом, EGCG, главный компонент зелёного чая, подавляет рост и инвазию раковых клеток и усиливает их гибель вследствие γ-излучения *.
• Курение. Несмотря на то, что курение создаёт большое количество свободных радикалов, и могло бы усилить действие лучевой терапии, факты говорят об обратном. Комбинированное воздействие курения и лучевой терапии снижает эффективность лечения. Риск рецидива для курящих может возрасти в 2,4 раза, а риск смертности от всех причин – в 3,4 раза * по сравнению с некурящими. Таким образом, настоятельно рекомендуется бросить курение хотя бы на тот отрезок времени, которое займут все процедуры лучевой терапии.
Снижение побочных эффектов лучевой терапии.
Антиоксидантные вещества защищают клетки от разрушений, вызываемых свободными радикалами. Это позволяет снизить тяжесть побочных эффектов лучевой терапии, особенно при облучении больших участков здоровой ткани или всего организма. Однако остаётся опасность того, что антиоксиданты могут помочь пережить вызванный радиацией окислительный стресс также и раковым клеткам. Такое двойственное поведение антиоксидантов является причиной противоречивых результатов исследований их пользы при лучевой терапии, и неодобрения их применения со стороны практических врачей.
• Обогащённая водородом вода, как было выяснено в опытах на мышах, защищает от вызванных радиацией иммунной дисфункции *, заболевания сердца * и лёгких *, не ослабляя терапевтическое действие лучевой терапии. У пациентов, в течение 6 недель принимавших обогащённую водородом воду во время лучевой терапии, снижалась концентрация в крови гидроксидных окислителей и значительно улучшались показатели качества жизни по сравнению с пациентами, получавшими плацебо *.
• Альфа-липоевая кислота, витамины C и E также могут применяться как эффективные натуральные антиоксиданты. Существует великое множество различных веществ и коферментов, прямо или косвенно поддерживающих антиоксидантную систему организма. Это йод, жирные кислоты омега-3, кофермент Q10, витамин K2, биофлавоноиды, каротиноиды и др. Многие растительные продукты, особенно ягоды, являются богатым источником антиоксидантов *. Однако стоит ещё раз напомнить, что речь идёт о приёме добавок в физиологических концентрациях, а не о сверхдозах.
• Селен увеличивает количество антиоксидантных ферментов в нормальных, но не в раковых клетках *.
• Гинкго билоба принимают внутрь в течение одного месяца после лучевой терапии. Экстракт листьев растения действует антиоксидантно, а также способствует очищению крови и улучшает кровообращение. Рекомендуемая доза экстракта составляет 100 мг/сут.
Предотвращение фиброза.
• Пентоксифиллин (3×400 мг/сут) и витамин Е (3×100 МЕ/сут), принимаемые внутрь в течение полугода-года, начиная через месяц после облучения, могут предотвращать и обращать вспять вызванный радиацией фиброз груди
*
*
*,
в том числе у пациентов с высоким риском
*.
В исследовании пациентов с плоскоклеточным раком головы и шеи пентоксифиллин давался прямо во время лучевой терапии, в результате чего последующие изменения кожи и фиброз были более мягкими, чем в контрольной группе
*.
• Супероксиддисмутаза цинка и меди в составе мази (в общей дозе 40 мг при концентрации 3'600 Е/мг, в течение 90 дней) позволяет снизить фиброз, вызванный облучением *.
• Метформин, принимаемый перорально, может значительно уменьшить вызванное ионизирующим излучением утолщение кожи и накопление коллагена *.
Поддержка иммунных клеток.
• Диклофенак или индометацин помогают также восстанавливать у пациентов с раком молочной железы нарушение функции лимфоцитов, вызванное лучевой терапией, что может увеличить показатели выживаемости *.
• Кордицепс (экв. 5 мг/кг) защищает у мышей костный мозг и кишечник от общего облучения, и ускоряет восстановление уровня лейкоцитов в крови *.
• Бета-глюкан из грибов Рейши (экв. 33 мг/кг) увеличивает у облучённых мышей массу селезенки и количество лейкоцитов после общего облучения γ-лучами *.
Смягчение радиационного дерматита.
• Мелатонин, применяемый местно, может помочь предотвратить раздражение кожи в результате лучевой терапии. В фазе II клинических испытаний эмульсию мелатонина (Praevoskin®) наносили на грудь пациентов с раком молочной железы во время лучевой терапии и ещё две недели после её окончания. В то время как в контрольной группе 90 % пациентов испытывали вызванные облучением дерматит и раздражение кожи, в испытуемой группе этот число составило 59 % *.
• Куркумин (внутрь, 6 г/сут) уменьшает тяжесть радиационного дерматита у пациентов с раком молочной железы *.
• Целекоксиб (400 мг/сут), хотя и не может уменьшить дерматит, однако значительно уменьшает у пациентов зуд и боль, вызванные ионизирующим излучением *.
• Острые кожные реакции на лучевую терапию может смягчить местное применение сока алоэ вера * * *, зелёного чая * и крема с гиалуроновой кислотой * *, однако их успех может оказаться слабым. Экстракт алоэ сам по себе лишь незначительно снижает силу воспаления, вызванного лучевой терапией * *.
Через неделю после последней процедуры, даже при нормальном самочувствии, стоит сдать, как минимум, общий и биохимический анализы крови, а также общий анализ мочи А при ухудшении самочувствия их, видимо, придётся сдать ещё раньше, чтобы врач мог оценить обстановку и принять соответствующие меры.
Наиболее частые последствия химиотерапии – тошнота, диарея, мукозиты. Некоторые диетические изменения помогут легче переносить тошноту. Диетологи советуют избегать жирной, острой и горячей пищи и пищи с сильным запахом, а также обогатить рацион белком и умеренно потреблять жидкости. Для защиты кишечного эпителия следует отказаться от пищи, способной травмировать стенку кишечника, использовать для приготовления пищи блендер, а также увеличить потребление слизеобразующих продуктов, таких как жидкая овсянка, рыжей, чиа или лён.
Химиотерапия обычно вызывает лейкопению. Но при анализе крови, кроме количества лейкоцитов, важно понимать абсолютное количество нейтрофилов (гранулоцитов), которые существенно защищают от инфекций, особенно от бактериальных. При падении количества нейтрофилов ниже 1'000/мкл резко увеличивается опасность инфекций, вызванных бактериями, находящимися в повседневной пище. Это может привести к развитию молниеносных смертельных инфекций. Но даже при удовлетворительных показателях нейтрофилов следует максимально снизить возможность бактериального заражения.
Специалисты советуют усилить санитарные мероприятия, особенно в отношении животного белка и скоропортящихся продуктов *. Кроме того, можно попытаться укрепить иммунную систему путём добавок пробиотиков (Lactobacillus bulgaricus, Streptococus thermophillus), растительной клетчатки (шпинат, кинза, тыква, лён), бета-глюкана (грибной порошок, отруби, пивные дрожжи), рыбного жира, чесночного порошка и других натуральных средств. В тяжёлых случаях врач может назначить иммуностимуляторы, стимулирующие рост нейтрофилов, такие как нейпоген. Это позволит держать уровень нейтрофилов в пределах 1'500-10'000 /мкл.
Среди других добавок, которые могут оказаться полезными – кофермент CoQ10 (200 мг/сут); селен (200 мкг/сут); германий, полуторная окись (до 200 мг/сут); витамин В6 (3×50 мг); витамин В12 (200-1'000 мкг); протеолитические ферменты, такие как бромелаин и папаин (1'000 мг/сут), сок или экстракт алоэ (2×1-2 мл).
Во время перерыва между курсами лечения будет также полезным вести записи, какие наблюдались осложнения, продолжительность и степень их тяжести, какие принимались меры по их смягчению и какова была из результативность. Это поможет лучше контролировать тенденции течения болезни.
По окончании первого этапа лечения (21-30 дней) следует пройти повторное обследование. Опираясь на результаты анализов, можно делать вывод о результативности курса и дальнейшей стратегии.
Субъективным критерием эффективности лечения является самочувствие. Субъективные и объективные критерии оценки успеха лечения:
• Уменьшение боли.
• Улучшение самочувствия.
• Повышение аппетита.
• Увеличение энергии и выносливости.
• Увеличение веса.
• Увеличение мышечной силы.
• Улучшение показателей крови и мочи.
• Уменьшение размеров опухоли.
• Снижение маркёров воспаления.
• Уменьшение показателей маркёров опухоли.
В результате проведенного лечения массив раковых клеток опухоли должен уменьшиться, соответственно, сократившись в размерах на снимке. Чем более злокачественной была опухоль, тем большему изменению размеров она должна подвергнуться.
Основное лечение рака, вопреки устоявшемуся мнению, заключается не столько в уничтожении раковых клеток, сколько в устранении причин, приведших к их появлению и развитию.
Традиционная терапия нацелена на уничтожение быстроделящихся клеток опухоли или на подавление специфических сигналов, стимулирующих рост опухоли (например, EGFR или HER2). После курса такой терапии врачи, добившись исчезновения видимого симптома, считают работу успешно завершённой. Хотя, на самом деле, она не доделана.
Не стоит полагать, что отныне с раком навеки покончено. Отсутствие симптомов и хорошие результаты обследования не означают полной и окончательной победы. Факторы, вызвавшие болезнь, не исчезли, а значит, над опухолью одержана временная победа.
Несмотря на уничтожение массива опухоли в результате лечения, остаются условия для её реванша. Это фиброз и укрывшиеся в труднодоступных для иммунных клеток и терапевтических токсинов местах субклоны стволовых раковых клеток, которые выжили благодаря своим уникальным мутациям, способным противостоять проведенному лечению. Кроме того, белки внеклеточного матрикса в сохранившихся местах повышенной плотности ткани могут способствовать потере дифференцировки клеток.
Сохранение семян (раковых клеток) и благоприятной почвы (воспаление, фиброз, эстрогенная или оксидантная нагрузка) создают условия для возвращения болезни на расчищенную от слабых клеток территорию. Поэтому обычно наблюдаемый значительный первоначальный успех часто сменяется появлением стойких к терапии опухолей и возвращением болезни.
Снижение риска рецидива.
Снижение плотности ткани – в т.ч. протеолитические ферменты. Рассмотрено выше, в послеоперационных мероприятиях.
Снижение воспалительного уровня – антиоксиданты и противо
Ослабление про-опухолевых и усиление противо-опухолевых эпигеномных влияний – брокколи, чай, гранат и пр.
Снижение гормонального стресса – гормоны, ингибиторы ароматазы, баланс метаболитов эстрогена.
Стиль жизни. Женщины с более длительной физической нагрузкой (≥ 2,5 часа в неделю) имели более низкий риск общей и рецидивирующей/специфической смертности по сравнению с женщинами без физической нагрузки *.
У женщин с тройным негативным раком молочной железы, постоянно потребляющих зелёный чай, риск рецидива на 46 % ниже, а выживаемость в течение пяти лет после постановки диагноза на 43 % выше, чем у женщин, не потреблявших чай *.
Потребление цимицифуги (Actaea racemosa) может снизить риск рецидива у пациентов, принимающих тамоксифен
*.
Комбинирование ростков брокколи и зёленого чая повышает чувствительность к тамоксифену при ER-негативном раке молочной железы
*.
<Ликвидация микрометастаз. Поскольку процесс метастазирования начинается на самых ранних этапах заболевания *, то организм пациента, перенесшего рак, наполнен микрометастазированными узелками, которые могут находиться в неактивном состоянии на протяжении многих лет. Чтобы уничтожить возможные метастатические колонии раковых клеток, оставшиеся после противоопухолевой терапии, можно попытаться применить различные подходы.
Противотромбозные средства. Раковые клетки мигрируют и приживаются на новом удалённом месте под прикрытием слоя слизи (гликопротеина) и фибрина *. Ферменты поджелудочной железы (трипсин, химотрипсин и амилаза), а также протеолитические ферменты растительного происхождения (папаин и бромелаин) способны растворять белковую оболочку, маскирующую раковые клетки. В результате обнажаются мутировавшие антигены на поверхности раковых клеток, что позволяет иммунным клеткам распознавать их и уничтожать.
Кроме того, метастазирование чаще происходит в месте образования тромба, где мигрирующим раковым клеткам легче укрыться в сгустке фибрина. Неудивительно, что пациенты с сердечно-сосудистыми заболеваниями, принимающие противо
Однако и гепарин, и аспирин, и антагонисты витамина К – это очень сильные средства. Они могут применяться против тромбообразования только краткосрочно, по решению лечащего врача и только при отсутствии противопоказаний. Но они являются плохой идеей в нашем случае, который требует долгосрочного настойчивого и низкоуровневого применения.
• Витамин В3 (ниацин) *, витамин C и мультивитаминные комплексы, уже рассматривавшиеся ранее, способны хотя и менее эффективно, но более безопасно снижать плотность кровяных сгустков *.
• Личинки восковой моли (Galleria mellonella). Липаза, вырабатываемая незрелыми личинками восковой моли, названная цераза (cerase) – единственный относительно доступный фермент, который способен эффективно разлагать такие плотные жиры, как воск. Терапевтическую перспективу представляет способность этого фермента разъедать липопротеины, покрывающие поверхность туберкулёзных бактерий, и защищающие их от антибиотиков и иммунных клеток *. Водно-спиртовой экстракт личинок восковой моли снижает свёртываемость крови, и в концентрации 0,6 мл/кг показывает кардиозащитный эффект в опытах на крысах и лягушках *. А в опытах на морских свинках, заражённых туберкулёзной палочкой, внутримышечные инъекции церазы обеспечивали излечение большинства из них *. В последнем случае животным инъекции вводились из расчёта 50 мг/кг церазы каждые 4 дня на протяжении 10 недель.
Дозировка использовавшегося здесь 20 %-ного водно-спиртового экстракта гомогената личинок, эквивалентная человеку, составит примерно 3×2 мл (3×60 капель), а дозировка фермента, использовавшаяся для инъекций, в пересчёте на человеческий масштаб, составит примерно 0,5 г. Хотя экстракт не токсичен даже при высокой концентрации, такая дозировка, как минимум, втрое выше рекомендуемой в популярной литературе. Экстракт принимается курсами по 3 недели каждый, затем 6 недель перерыва. Заметим однако, что жирная пища может нейтрализовать эффект фермента, если он принимается внутрь. Кроме того, следует внимательно следить за состоянием артериального давления, которое может значительно снизиться.
Существуют также различные противо
- антикоагулянтов, которые вмешиваются в систему свёртывания крови и препятствуют дальнейшему росту тромба. Это, например, витаферин (withaferin) из корня Ашвагандхи (Withania somnifera)
*;
вогонин (wogonin) из Шлемника байкальского (Scutellaria baicalensis)
*;
глицирризин (glycyrrhizin) из корня Солодки голой (Glycyrrhiza glabra)
*.
- антиагрегантов, которые снижают агрегацию тромбоцитов и ингибируют образование тромба. Это, например, андрографолид (andrographolide) из листьев Андрографиса метёльчастого (Andrographis paniculata)
*;
буплерумин (bupleurumin) из корня Володушки серповидной (Bupleurum falcatum)
*;
таншинон (tanshinone IIA) из корня Шалфея (Salvia Miltiorrhiza)
*;
гинкголид (ginkgolide C) из листьев Гинкго билоба (Ginkgo biloba)
*;
диосгенин (diosgenin) из корня Ямса дикого (Dioscorea zingiberensis)
*
*;
азиатиковая кислота (asiatic acid) из листьев Центеллы (Centella asiatica)
*,
ахойен (ajoene) из луковицы Чеснока (Allium sativum)
*.
- фибринолитирующих средств, которые непосредственно растворяют уже существующий тромб. Это, например, протеолитические ферменты серрапептаза (serratiopeptidase)
*
(2 таб. 3 раза в день); наттокиназа
*
*
и люмброкиназа
*; а также
пионифлорин (paeoniflorin) из корня Пиона молочноцветкового (Paeonia lactiflora)
*.
Используя противо
Противовоспалительные и противо
Самыми эффективными вырабатываемыми организмом ферментами, которые рассасывают нефункциональные здоровые клетки и доброкачественные опухоли, являются пепсин, трипсин и химотрипсин. Таким образом, необходимо позаботиться о том, чтобы они в достаточном количестве присутствовали в крови. Для этого необходимо стимулировать работу желудка, печени и поджелудочной железы, например, принимать соответствующие травяные сборы и достаточные дозы витамина B3 (ниацин, никотиновая кислота). Добавки экзогенных ферментов, таких как папаин и бромелаин, а также ферментов поджелудочной железы, тоже будут очень кстати.
Не следует перегружать органы пищеварения белком, чтобы освободить ферменты для работы против опухоли. При отсутствии противопоказаний, можно также дополнительно принимать протеолитические ферменты серрапептаза, церраза, наттокиназа и панкреатические ферменты (как отдельно, так и в составе комплексов или БАДов).
Продолжительные умеренные добавки наттокиназы и серрапептазы могут помочь растворить нефункциональные образования, рубцы, кисты, склеротические бляшки, а также избыточное накопление внеклеточного матрикса. У 85,7 % пациентов, жаловавшихся на нагрубание молочніх желез, уже после 3 дней приёма таблеток серрапептазы (3×10 мг) уменьшались отёк, уплотнение и боль в груди *.
Сочетание экстракта босвеллии (200 мг/сут) с бетаином (700 мг/сут), мио-инозитолом (800 мг/сут) и поливитаминным комплексом, подавляет воспаление, ослабляет боль и снижает повышенную плотность молочной железы. После 6 месяцев приёма этой смеси, объём доброкачественной опухоли молочной железы уменьшался * *.
Молекулярный йод (6 мг/сут), принимаемый на протяжении нескольких месяцев, субъективно и объективно улучшает состояние молочной железы при фиброзно-кистозных состояниях * и снижает циклические боли в груди у женщин *. Между тем, допустимым верхним уровнем пищевого потребления йода в настоящее время считается 1,1 мг/сут *.
Дигоксин и другие сердечные гликозиды на основе наперстянки, принимаемые пациентами в связи с сердечными заболеваниями, как сообщалось, значительно улучшают их прогноз. Уровень смертности у пациентов с раком молочной железы, хронически принимавших препараты, составлял 6 % против 34 % у пациентов, не принимавших их *, а частота рецидивов у них была 9,6 раза ниже *. Дозировка сердечных гликозидов должна подбираться специалистом индивидуально; обычно при длительной поддерживающей терапии дигоксин принимают по 0,125-0,75 мг/сут. При этом, скорее всего, потребуются добавки калия и магния, поскольку дигоксин способствует потере этих элементов.
Хотя использование дигоксина не увеличивает риск рецидива у женщин с раком груди, проходящих лечение *, имеются исследования, показывающие повышение риска появления первичного рака груди вследствие приёма дигоксина * * *.
Восстановление иммунной функции. После противо
Особенно это касается В-клеток, участвующих в создании антител, клеток CD4+ (хелперных Т-клеток) и клеток натуральных киллеров. Уровень В-клеток, например, вследствие химиотерапии может упасть до 6 % от начального. И даже спустя год после лечения запас иммунных клеток может не вернуться к до-терапийному уровню *. При этом у курящих женщин восстановление В-клеток было менее полным, достигая через 9 месяцев после терапии только 51 % от начального уровня против 80 % у некурящих женщин.
Такое положение дел вынуждает прибегать к различным методам восстановления иммунной функции, рассмотренным выше.
Повышение выживаемости и улучшение качества жизни.
Диета. Женщины, придерживающиеся диеты с низким содержанием жиров (≤ 20 % общей калорийности), имеют показатель выживаемости на 22 % выше, чем женщины, придерживающиеся обычной диеты с высоким содержанием жиров (≥ 30 %) *. Снижение потребления жира ниже 20 % в поступаемой с пищей энергии с одновременным увеличением потребления фруктов, овощей и зерновых, способно вдвое увеличить срок выживаемости у пациентов после курса лечения *.
Потребление всего одной порции крестоцветных овощей в день вдвое снижает риск рецидива рака молочной железы у женщин, принимающих тамоксифен *.
Высокое потребление энтеролинганов (льняного семени, кунжута, семечек подсолнечника и тыквы) также может оказать значительное влияние на выживаемость постменопаузных пациентов с раком молочной железы *.
Добавки. Мета-анализ когортных исследований показал, что использование антиоксидантных добавок после лечения рака молочной железы увеличивает показатель выживаемости пациентов *.
Ежесуточный приём в течение 3-5 лет после противо
Длительный приём мелатонина (≥ 3 мг/сут) позволяет снизить потерю костной массы у пожилых людей *.
Массаж. Опыты с мышами показали, что ежедневное мягкое механическое растягивание опухоли (10 минут один раз в день, в течение четырёх недель), вдвое тормозили рост привитой опухоли молочной железы без применения какой-либо другой терапии *.
Деликатность. При удалении лимфатических узлов нормальный отток лимфы нарушается, что может привести к отёкам в руке на стороне операции, которые называются лимфедема. Ухудшение движения лимфы делает руку более уязвимой к инфекциям, что потребует к ней особого внимания.
По сравнению с женщинами, которые продолжают курить после диагноза рака молочной железы, у женщин, бросивших курить, наблюдается более высокая общая выживаемость * * *.
Снижение потребления спиртных напитков, как минимум, до 10 г чистого алкоголя в день снижает риск рецидива первичного рака молочной железы *.
Гормональные контрацептивы повышают риск развития рака молочной железы через гормональные нарушения. И хотя барьерные контрацептивы во время репродуктивной жизни женщины также способны увеличить риск рака молочной железы из-за снижения благотворного воздействия факторов спермы мужчины *, этот риск, по-видимому, на порядок ниже, чем гормональное вмешательство.
Психологический настрой. Стрессы, связанные с диагнозом, лечением и изменением уклада жизни, могут очень болезненно сказываться на душевном состоянии пациентов. Всех их беспокоит неуверенность в завтрашнем дне, опасность скорого рецидива, возможность крушения своих жизненных планов.
Однако, в действительности, их страхи и опасения чаще всего слишком завышены. Страх хуже любой самой страшной болезни. В отличие от оптимизма, страх не улучшает, а ухудшает ситуацию. Не стоит давать ему возможность отравлять свою жизнь. Рак молочной железы лечится, а особенно эффективно в том случае, когда пациент ответственно и с пониманием относится к своему диагнозу. С ним нужно жить дальше, стараясь дожить до глубокой старости. Жить счастливо и надеяться на лучшее, невзирая ни на что.
Иногда рак возвращается после лечения. Это называется рецидивом. Рецидив может случиться через несколько недель, месяцев или даже многих лет после завершения лечения рака. Существуют различные типы рецидивов, в зависимости от того, в каком именно месте рак вернулся в организм.
Локальный рецидив – это когда новая опухоль начинает расти в том же месте или очень близко к месту возникновения рака, но не распространяется на другие части тела.
Местный рецидив – это когда рак возвращается в лимфатические узлы и ткани в области, где рак начался.
Отдалённый рецидив – это когда рак распространился в другую часть тела, и образовал там новую опухоль. Новая опухоль называется метастазирование, или метастатический рак. При раке молочной железы случается т.н. билатеральный рак – это когда новая опухоль образуется в молочной железе на другой стороне тела.
У врачей на эти случаи имеются терапевтические протоколы второго и третьего эшелона обороны. А пациенту остаётся продолжать основное и дополнительное лечение.
Даже когда врачи признают безнадёжность лечения, у нас всё ещё остаются возможности продлить жизнь больного и улучшить её качество. Когда излечение маловероятно, фокус внимания смещается к физическим, эмоциональным и практическим аспектам.
Паллиативные меры. Для борьбы против кахексии часто используются гидразинсульфат, D-рибоза и МСМ (метилсульфонилметан). Гидразинсульфат разрывает биохимический цикл кахексии. МСМ вместе с витамином C также могут помочь организму избавиться от молочной кислоты. D-рибоза способна проникать сквозь молочную кислоту и поддерживать незлокачественные клетки, у которых глюкоза отбирается злокачественными клетками.
Авантюрные меры. Поскольку при терминальном раке речь идёт уже не о ремиссии, а лишь об увеличении срока выживания, некоторые больные готовы рискнуть на самые радикальные действия, не одобренные, и даже осуждённые официальной медициной. Невзирая на то, что они сами по себе угрожают сократить остаток жизни. Например, такие, как высокощелочная терапия с использованием хлорида цезия. Среди других таких же рискованных мер – внутриопухолевые инъекции бикарбоната кальция, салиномицин, дисульфирам.
Невозможно осуждать в таких действиях пациента, когда медицина не даёт ему надежд на спасение. Трудно отговаривать его от опасных экспериментов, когда ему прогнозируют несколько месяцев жизни, не предлагая никаких эффективных решений. Когда у него остаётся простой выбор: умереть от своей безумной затеи, или умереть от бессилия медицины. В конце концов, хозяин своей жизни сам человек, и у него есть право не только на жизнь, но и право на смерть. В том числе путём самолечения.