Стратегия здоровья.
Соматические мутации генов ДНК до сих пор считаются главным фактором появления рака. Однако модификация ядерного ДНК является лишь частью общей картины опухолевого процесса, а не его основной причиной. Даже множественные мутации ядерной ДНК не делают неизбежными проявление раковых характеристик клеток.
Специальные исследования показали, что при объединении ядра раковой клетки с содержимым нормальной клетки признаки злокачественности не проявлялись * * * * *. Даже при наличии опухолеассоциированных мутаций, канцерогенность многих типов опухолей подавлялась, когда ядро опухолевой клетки вводилось в цитоплазму нормальной клетки * * * *. И наоборот, канцерогенность усиливалась при объединении внутриклеточного содержимого раковой клетки с ядром нормальной клетки * *.
Но это касалось слияния материала, а что, если попробовать перекрёстно трансплантировать ядра нормальной и раковой клеток? Такие эксперименты тоже были проведены. Когда в раковой клетке ядро заменяли ядром здоровой клетки, она продолжала проявлять злокачественность. А когда в здоровой клетке ядро заменяли ядром раковой клетки, она продолжала проявлять незлокачественность * *.
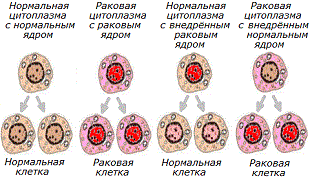
Ядра раковых клеток после их пересадки в здоровую цитоплазму клетки формировали нормальные ткани *. Из раковых клеток, введённых в ранние эмбрионы, формировались здоровые ткани и органы *. После введения ядра раковой клетки лягушки в яйцеклетку с предварительно удалённым из неё здоровым ядром, эта яйцеклетка развивалась в здорового головастика *. Если бы, как это упрямо утверждается, генные мутации ядерной ДНК действительно были бы единственной, или даже главной причиной рака, такие чудеса были бы невозможны. Злокачественные характеристики должны были бы переноситься вместе с ядром злокачественной клетки.
Заинтригованные такими открытиями, исследователи провели аналогичные опыты с переносом митохондрий. При добавлении митохондрий нормальной клетки внутрь опухолевой клетки, онкогенный фенотип последней подавлялся * * *, а её чувствительность к химиотерапии обострялась *. В то же время при добавлении митохондрий опухолевой клетки внутрь нормальной клетки, онкогенный фенотип последней усиливался * *. Таким образом, степень злокачественности клетки диктуется состоянием не её ядра, а её митохондрий и, возможно, других органелл клетки.
Действительно, внутриклеточные факторы могут подавлять опухолевый фенотип * или наоборот, стимулировать его. Мутации митоходриальной ДНК или другие факторы способны привести к нарушению процесса окислительного фосфорилирования *, что вынудит клетку обратиться к гликолизному производству энергии. Кроме того, стойкие патогенные мутации в мтДНК могут приводить также к эпигенетическим изменениям, вызывающим геномную нестабильность в ядерном геноме.
Самое разумное объяснение результатов перечисленных выше опытов состоит в том, что для злокачественной трансформации клеток генетические изменения ядерной ДНК недостаточны, если вообще необходимы. Похоже, что злокачественное перерождение клеток – результат дефектов в цитоплазме, а не дефектов в ядре *. Когда митохондрии функционируют нормально, то у канцерогенных мутаций ядерной ДНК мало шансов реализоваться. Здоровые митохондрии могут отменять раковое поведение клеток даже с мутировавшей ядерной ДНК, и наоборот – дисфункция митохондрий будет вынуждать клетки увеличивать гликолиз и ферментацию, склоняя клетки с нормальной ДНК к злокачественной трансформации.
Опухолевый фенотип может быть возращён к нормальному фенотипу не только на уровне клетки. Состояние ткани и, по большому счёту, состояние всего организма является решающим в вопросе, будет ли образовываться опухоль или нет, и какова будет её судьба. Ткань с полностью дифференцированными клетками способна успешно влиять на поведение появившихся злокачественных клеток в сторону их исправления.
Пересадка раковых клеток в здоровую ткань может приводить к потере ними злокачественных свойств, несмотря на наличие мутаций * *. Не только у единичной раковой клетки, но даже у достаточно большой группы раковых клеток нет шансов образовать опухоль, если ткань, в которую их внедряют, здорова. Для того, чтобы у человека могла образоваться опухоль, требуется одномоментное введение не менее 10 миллионов раковых клеток *. При внедрении слишком малого количества раковых клеток из опухоли в здоровую ткань, они полностью теряют свою злокачественность и превращаются в нормальные клетки * *, хотя при необратимых дефектах генома такого быть не должно в принципе.
Раковые клетки способны не только останавливать свой рост, но и обращаться к нормальному фенотипу, несмотря на возможные генетические мутации * *. Такие случаи называются спонтанная ремиссия. Все эти факты как-то плохо согласуются с господствующей теорией, что рак происходит из единственной потерявшей контроль мутировавшей клетки, и что его развитие необратимо.
Постоянно нарастающий массив данных даёт убедительные основания полагать, что текущий взгляд на происхождение и природу рака нуждается в пересмотре. Что опухоль является в большей степени метаболическим, чем генетическим заболеванием *. И что митохондриальная метаболическая теория (ММТ) может лучше объяснить признаки рака, чем теория соматических мутаций (СМТ) *.
С точки зрения метаболизма, именно патологическое нарушение клеточного дыхания предшествует *, и является причиной нестабильности генома, сопровождающей процесс развития опухоли. Хотя краткосрочной нестабильности генома может оказаться недостаточно для генетических мутаций, долгосрочная нестабильность увеличивает этот риск. Среди возникших мутаций ядерной ДНК могут оказаться такие, которые способствуют дальнейшему нарушению метаболизма, злокачественным преобразованиям и прогрессированию болезни.
Нацеливание противораковой стратегии на генетическую проблему, которой руководствуется современная медицина, не имеет практического смысла. За десятилетия исследований не было выявлено ни одного конкретного причинного гена или набора генов для подавляющего большинства видов рака. Мутации в раковых клетках происходят в миллионах непредсказуемых мест ДНК, что придаёт каждому случаю свои индивидуальные особенности. И, с точки зрения генетики, каждый из них может требовать индивидуального лечения, в то время как клетки опухоли будут приобретать всё больше и больше новых мутаций. В конце концов, могут существовать раковые клетки вообще без каких бы то ни было мутаций.
В то же время митохондриальная проблема является общей практически для любого случая рака. Это общая патология клеток ракового фенотипа независимо от того, какие мутации в них произошли. Клетки с плохо функционирующими митохондриями могут и не быть раковыми. Однако вряд ли найдутся раковые клетки с полностью функциональными митохондриями. С этой точки зрения, лечение большинства случаев рака может быть сведено к общему протоколу.
Если дефект опухолевых клеток действительно кроется в митохондриях, а не в ядре клетки, то это полностью меняет подход к лечению рака. Вместо того, или вместе с тем, чтобы ориентироваться на уничтожение клеток с необратимо мутировавшими генами, следует ориентироваться на восстановление нормальной работы митохондрий во всех клетках организма.
Живым механизмам присуще стремление к организованности, упорядоченности и развитию, в то время как неживым механизмам присуще стремление к хаотичности, неупорядоченности и разрушению. Химия живой природы отличается от химии неживой природы тем, что процессы в ней протекают управляемо, при помощи соответствующих ферментов и слаженной работы электрохимических механизмов. Однако биохимические реакции требуют расхода энергии, поэтому ни один живой организм не может существовать без энергоснабжения.
Основная часть производимой человеческими клетками энергии извлекается из молекул глюкозы. Сначала глюкоза транспортируется в клетку и участвует в процессе под названием гликолиз. Это многостадийный биохимический процесс, протекающий в цитозоле клетки. Каждая из десяти метаболических реакций гликолиза требует определённых ферментов, и не требует кислорода. Гликолиз не расщепляет молекулу глюкозы до конца, и поэтому не высвобождает всю имеющуюся в ней энергию.
В результате гликолиза из каждой молекулы глюкозы образуется 2 молекулы пирувата (пировиноградной кислоты) и заряжается энергией 2 молекулы аденозинтрифосфата (АТФ), который используется всеми клетками организма в качестве энергетического агента. Полученный в результате гликолиза пируват может затем метаболироваться в лактат и выводиться из клетки как метаболический отход. Большинство примитивных форм жизни производят энергию именно этим путём, и делали они это задолго до того, как в атмосфере планеты появился кислород (около 2,5 миллиардов лет назад). Этим одноклеточным организмам присущи также такие характеристики раковых клеток, как безудержное деление и бессмертие.
Клетки высокоорганизованных организмов обладают возможностью расщеплять пируват дальше, образуя в качестве метаболических отходов лишь воду и углекислый газ. Это осуществляется в клеточных органеллах, называемых митохондриями, – сначала в ходе циклического биохимического процесса, называемого цикл Кребса (ЦК), а затем в ходе электрохимического процесса, называемого окислительное фосфорилирование (ОФ). У таких клеток из каждой молекулы глюкозы может производиться 2 молекулы АТФ как и прежде, при помощи гликолиза, и ещё до 36 молекул АТФ дополнительно – при помощи ОФ. Последний процесс требует расхода кислорода, который служит здесь ацептором электронов в конечном этапе производства энергии – т.н. «цепи переноса электронов».
В человеческих клетках более 90 % внутриклеточного АТФ производится именно за счёт ОФ *. Несмотря на то, что ОФ нуждается в поставках кислорода, такой способ производства энергии многократно эффективнее, чем гликолиз. Как ни удивительно, некоторые клетки человеческого организма продолжают использовать гликолиз как основной источник энергии (например, эритроциты, клетки сетчатки глаза, клетки семенников). Это нормальные гликолитические клетки. Однако все остальные нормальные клетки, в том числе эпителиальные клетки, используют в качестве основного генератора энергии ОФ.
Нарушение клеточного энергетического метаболизма является определяющей характеристикой почти во всех случаях рака. Если в нормальных эпителиальных клетках подавляющая часть всей энергии производится митохондриями, то в раковых клетках митохондрии в значительной степени теряют свою функцию. Это не только радикально меняет картину энергетического метаболизма. Во время различных этапов гликолиза в качестве метаболических отходов образуется химическое сырьё, позволяющее строить из него дочернюю раковую клетку. Чем интенсивнее гликолиз, тем больше такого строительного материала, тем быстрее может делиться раковая клетка.
Итак, в большинстве случаев раковые клетки характеризуются повышенным гликолизом – преобразованием глюкозы в пируват и дальнейшим повышенным метаболированием полученного пирувата в лактат. Многие нормальные клетки при гипоксии тоже могут временно увеличивать ферментативное производство энергии, однако при восстановлении адекватного уровня кислорода они всегда возвращаются к митохондриальному производству энергии. С раковыми клетками такого, однако, не происходит – они используют гликолиз даже при наличии достаточного количества кислорода (явление, называемое аэробный гликолиз).
Усиление производства энергии путём ферментации является не только следствием предыдущих этапов развития опухолевого процесса, но и причиной последующих его этапов. Длительная зависимость клеток от ферментативной выработки энергии проявляет такие раковые характеристики клеток, как нестабильность генома, нарушение внутриклеточного метаболизма *, кислотно-щелочной реверс *, потерю дифференцировки и неконтролируемый рост *. Таким образом, усиление митохондриального дыхания клеток имеет важное терапевтическое значение * *.
Восстановление естественного клеточного метаболизма включает два взаимодополняющих действия: ослабление анаэробного дыхания и усиление дыхания аэробного.
Поддержка митохондрий. Митохондрии – активные органы клетки (клеточные органеллы), число которых в каждой клетке может колебаться от 200 до 2'000. Они имеют свою собственную ДНК, которую они используют для своего воспроизводства, и являются своего рода внутриклеточным сожителем-симбионтом. Предположительно, митохондрии произошли от свободноживущих бактерий, которые использовали для производства своей энергии механизм ОФ.
Считается, что несколько сотен миллионов лет назад они были поглощены древней гликолитической клеткой-хозяином, но были не усвоены, а вместо этого были включены в её внутриклеточные процессы, что обеспечило такой клетке значительные эволюционные преимущества. Далее эта клетка-симбионт стала прародителем всех живых организмов, клетки которых используют ОФ.
Основной клеточной функцией митохондрий является производство энергии, необходимой для протекания метаболических процессов клетки. Источником энергии для клеток человеческого организма могут быть разные питательные вещества, однако в конечном итоге запасается эта энергия лишь в молекуле под названием аденозинтрифосфат (АТФ). АТФ используется для получения энергии всеми клетками – как здоровыми, так и раковыми.
Митохондрии не только производят энергию, но также принимают участие в ряде других чрезвычайно важных клеточных функций. Это регуляция мембранного потенциала и дифференцировка; клеточная сигнализация через активные формы кислорода (АФК); кальциевая сигнализация, управление апоптозом и аутофагией; регуляция клеточного метаболизма; регуляция метаболизма железа и синтеза гема; регуляция синтеза стероидов *. Таким образом, от здоровья митохондрий зависит здоровье клетки и здоровье всего организма.
Митохондрии претерпевают при раке специфические структурные и функциональные изменения, и они активно участвуют в метаболическом перепрограммировании. Снижение количества митохондрий и/или их функциональности считаются характерным признаком раковых клеток. Конечно, потеря митохондриальных функций не всегда связана со злокачественной трансформацией; для такого переключения требуются и другие условия, однако злокачественные трансформации почти всегда связаны с потерей митохондриальных функций.
В процессе производства АТФ в митохондриях появляется большое количество свободных радикалов (оксидантов), таких как активные формы кислорода (АФК) и активные формы азота (АФА). Чем больше в митохондрии поступает сырья для энергии, и чем активнее она производится, тем больше образуется свободных радикалов, тем сильнее их разрушительный эффект. И не так уж важно, производится энергия из глюкозы, липидов или аминокислот, важно их общее количество.
Образовавшиеся свободные радикалы повреждают любые белки, в первую очередь самой митохондрии, что приводит к деградации внутреннего слоя её мембраны и нарушению процесса окислительного фосфорилирования. Поэтому даже при большом количестве поступающего сырья производство энергии через ОФ может падать. Непереработанный избыток сырья накапливается в клетке, засоряя её внутреннее пространство. Окислительный стресс в митоходриях вызывает также нестабильность митохондриального, и даже ядерного генома, и усиливает экспрессию онкогенов. Кроме того, высокий уровень оксидантов вызывает каскад событий, которые снижают активность протеасом, длину теломер и ухудшают иммунную функцию.
Поскольку образование свободных радикалов является таким же естественным явлением в процессе производства энергии, как образование дыма при сжигании дров, для их нейтрализации в клетке предусмотрены естественные защитные механизмы. Это, в первую очередь, глутатион, который является самым сильным внутриклеточным антиоксидантом. Недостаточное производство глутатиона, или его истощение из-за большого количества оксидантов, или всё это вместе, будет приводить к деградации ОФ.
Помимо окислительного повреждения, митохондрии могут испытывать другие агрессивные посягательства, которые приводят к ослаблению процесса ОФ, и к дальнейшему увеличению уровня свободных радикалов и других митохондриальных токсинов, например, цианиды. Это ещё более усугубляет ситуацию, разгоняя разрушительный замкнутый круг *. При этом митохондриальные функции, в том числе и производство АТФ, естественным образом подавляются, что влечёт за собой самые серьёзные последствия.
Митохондриальная токсичность может вызываться некоторыми лекарствами, через различные механизмы, такие как истощение митохондриальной ДНК (например, нуклеозидные ингибиторы обратной транскрипазы), ингибирование бета-окисления жирных кислот (например, вальпроевая кислота), открытие переходных пор митохондриальной проницаемости (например, антрациклины), создание окислительного стресса и истощение запасов митохондриального глутатиона (например, ацетаминофен), разобщение транспорта электронов от синтеза АТФ (например, тамоксифен) и ингибирование комплексов митохондриальной цепи переноса электронов (например, статины) *.
Значительная часть вырабатываемой митохондриями энергии расходуется на работу встроенных в клеточную мембрану ионных насосов *, которые поддерживают баланс между внутриклеточными ионами (калия и магния) и внеклеточными (кальция и натрия). Количественная разница ионов натрия и калия по обе стороны клеточной мембраны создаёт на ней определённый электрический потенциал, который поддерживает многие клеточные функции.
Из-за нехватки энергии эффективность мембранного натриево-калиевых насосов падает. Внутриклеточный уровень ионов натрия относительно ионов калия увеличивается, что негативно влияет на функцию клеточных мембран. По причине дисбаланса ионов натрия и калия, электрический потенциал на мембране трансформирующейся клетки снижается, создавая вокруг неё всё более отрицательное поле. Это ухудшает функциональное состояние клетки. Кроме того, такая клетка приобретает свойство отталкивать отрицательно заряженные лекарства и такие клетки, как эритроциты и лимфоциты, не позволяя кислороду и иммунной системе противодействовать опухоли.
Другая часть энергии клетки расходуется на синтез ферментов, благодаря которым химические реакции внутри клетки становятся управляемыми. Недостаток определённых ферментов ещё больше ухудшает ЦК и ОФ. Когда поступление в клетку глюкозы и других источников энергии достаточно, однако митохондрии не в состоянии обеспечивать необходимый уровень энергии, клетка вынуждена обращаться к более древнему и менее выгодному принципу производства энергии, усиливая гликолиз и ферментацию *. А это один из первых шагов злокачественного перерождения клетки.
Глубокий дефицит энергии вынуждает производить только те ферменты, которые нужны лишь для выживания клетки. Со снижением энергообеспечения ухудшаются такие клеточные функции митохондрий, как дифференцировка, сдерживание клеточного роста, апоптоз. Благодаря апоптозу ненормальные клетки отбраковываются, предотвращая тем самым раковый процесс. Если же апоптоз работает плохо, то такие клетки могут оставаться в живых, и воспроизводить потомство с такими же дефектными митохондриями.
Кроме того, клетка многоклеточного организма обязана согласовывать своё поведение с другими клетками. Делает она это путём улавливания малейших нюансов концентрации химических сигналов и электрических полей. Работа таких сенсорных механизмов также требует расхода энергии. Чем сильнее дефицит энергии в клетке, тем хуже коммуникация клетки, тем меньше она откликается на общественные требования, тем слабее откликается на сдерживающие необузданный рост сигналы, тем глубже погружается в эгоистичное поведение своего одноклеточного предка, тем больше приобретает раковых признаков.
Как плохо функционирующие митохондрии, так и малое их количество, способствует переключению фенотипа клетки в злокачественный. В раковых клетках может наблюдаться фактическое увеличение количества митохондрий, чтобы таким способом скомпенсировать потерю их функций *. Однако подобные усилия не способны принципиально решить энергетическую проблему, пока не будут устранены её фундаментальные причины. Без этого митохондрии, даже при большом их количестве, останутся дефектными.
Таким образом, длительное нарушение функций митохондрий, проявляющееся в виде недостаточности окислительного фосфорилирования, в сочетании с повышенным гликолизом и глютаминолизом может привести к тому, что клетка войдёт в устойчивое состояние несдерживаемой пролиферации – с дальнейшей потерей дифференцировки, с устойчивостью к апоптозу, и с другими характерными признаками раковой клетки. Более того, всё факты указывают на то, что митохондриальные изменения способствуют не только злокачественному перерождению клеток, но также ангиогенетическому, инвазивному и метастатическому поведению раковых клеток *.
Митохондриальная дисфункция является выразительным сигналом старения организма и признаком практически всех дегенеративных заболеваний *, а не только рака * *. Ухудшение работы митохондрий по мере прожитых лет наблюдается не только у людей, но и у остальных животных. Однако мы можем в определённой мере улучшить митохондриальное здоровье. Митохондриальное дыхание можно усилить несколькими способами, например, снижением окислительного стресса; увеличением количества митохондрий; нормализацией их метаболизма; способностью заменять дефектные компоненты; митофагией и апоптозом *.
Улучшению митохондриальных функций может способствовать приём некоторых добавок * *. Они способны снизить окислительную нагрузку, предоставить дополнительные возможности для окислительного фосфорилирования, укрепить протекающие мембраны митохондрий и удалить нефукциональные митохондрии.
Кофакторы и антиоксиданты:
• Кофермент Q10 (coenzime Q10, CoQ10) участвует в митохондриальном производстве АТФ, а именно на этапе ОФ. Приём CoQ10 увеличивает митохондриальное производство клеточной энергии, а также количество и активность макрофагов и Т-лимфоцитов *, и уровень антител иммуноглобулина G (GIg) * * *.
Лучшим считается CoQ10 японской компании Kaneka, который извлекается из грибов. Пищевыми продуктами, богатыми CoQ10, являются лосось, субпродукты, цельнозерновые продукты, арахис, фисташки, грецкие орехи, фундук, семена кунжута, соевые бобы, оливковое масло, авокадо, брокколи и шпинат.
В сочетании с креатином (2×3'000 мг) и липоевой кислотой (2×300 мг), CoQ10 (2×120 мг) увеличивает у пациентов митохондриальное производство АТФ и снижает в плазме концентрацию лактата в состоянии покоя *. В этой комбинации CoQ10 усиливает функцию цепи переноса электронов, липоевая кислота действует как антиоксидант, а креатин – как энергетический буфер.
Другим усилителем CoQ10 может быть мумиё (200 мг/сут), позволяющее коферменту дольше сохранять свои антиоксидантные свойства
*.
С возрастом уровень эндогенного CoQ10 падает, так что его экзогенные добавки могли бы улучшить работу митохондрий и повысить активность митохондриального комплекса I в цепи переноса электронов. Дозировка мумиё: 3×100 мг для профилактики и 3×200 мг во время курса лечения
*.
• Никотинамид рибозида – одна из форм витамина B3, метаболический предшественник NAD+, который является кофактором более чем 200 клеточных окислительно-восстановительных реакций, включая митохондриальное производство АТФ. За счёт улучшения функций митохондрий стареющие стволовые клетки разных тканей становятся более молодыми при повышении уровня NAD+ в клетках * *.
Более высокий уровень NAD+ в клетках коррелирует с улучшением показателей здоровья *, и наоборот, более низкие уровни NAD+ способствуют развитию многих денеративных заболеваний *. С возрастом концентрация NAD+ постепенно падает: к 50 годам – на 40 %, а 80 годам – на 90-95 % по сравнению с 21-летним возрастом *. Однако добавки никотинамид рибозида (2×500 мг/сут) быстро восстанавливают уровень NAD+ в крови до значений в более молодом возрасте. По сравнению с группой плацебо, приём в 300 мг/сут никотинамид рибозида на 51 % поднимал у пожилых людей клеточный уровень NAD+ и, кроме того, увеличивал количество глутатиона и снижал показатель усталости *.
Поскольку NAD+ является эндогенным веществом, его добавки в пожилом возрасте фактически означают приведение уровня NAD+ к уровню, соответствующему молодому возрасту. В то время как CoQ10, добавляя энергии, может одновременно увеличивать число свободных радикалов в митохондриях, никотинамид наоборот, уменьшает их количество *. Можно предположить, что комбинация их обоих будет иметь лучший эффект, чем одного лишь CoQ10.
• N-ацетилцистеин (NAC) является предшественником глутатиона. Он повышает активность митохондриальных комплексов I, IV и V; укрепляет митохондриальную мембрану и улучшает митохондриальный гомеостаз *. Дозировка: 250-1'800 мг/сут * *, (обычно 600 мг/сут). N-ацетилцистеин плохо усваивается, поэтому рекомендуют принимать его липосомальную форму (2×250 мг) или S-ацетилглутатион (2×100 мг).
Использовать предшественников глутатиона лучше, чем использовать введение непосредственно глутатиона (в виде ингаляций или же внутривенно). В первом случае организм производит глутатиона ровно столько, сколько ему требуется. Во втором же случае глутатиона может оказаться как слишком мало, так и слишком много.
Комбинация NAC с глицином позволяет увеличить концентрацию глутатиона внутри митохондрий, и наполнить клетки более молодыми и более эффективными митохондриями. При этом снижаются окислительный стресс и показатели воспаления, а также улучшается метаболизм жиров в клетке. Это было убедительно доказано классическим двойным слепым рандомизированным клиническим исследованием продолжительностью 16 недель *. Здесь суточная дозировка NAC и глицина составляла по 100 мг каждого на 1 на килограмм веса пациента; т.е. по 6 грамм при весе 60 кг, что вдвое выше суточной потребности глицина. Интересно, что положительный эффект добавок проявлялся лишь у пожилых, но не у молодых людей.
• Альфа-липоевая кислота (ALA) – сильный антиоксидант, а также хелатор ионов металлов, таких как медь и железо. Она действует как критический кофактор митохондриальных процессов, и увеличивает концентрацию митохондриальных антиоксидантов – глутатиона и витамина C.
Потребление альфа-липоевой кислоты (2×500 мг) увеличивает потенциал митохондриальной мембраны, а также защищает ДНК и мембраны клеток от окислительного стресса, вызванного физической нагрузкой
*.
• Мелатонин (3 мг перед сном, но не более 15 мг) – нестероидный гормон широкого спектра действия, эффективно защищающий функции митохондрий
*.
Мелатонин способствует переключению от гликолизного к митохондриальному производству клеточной энергии. В одном клиническом исследовании мелатонин эффективно противодействовал окислительному стрессу и митохондриальной дисфункции, которые были вызваны сепсисом
*.
Тем не менее, мелатонин лучше принимать лишь при проблемах со сном, а не в качестве простой добавки.
Витамины и минералы:
• Пирролохинолин хинон (pyrroloquinoline quinone, PQQ), он же метоксантин (витамин B14), защищает митохондрии от окислительного разрушения
*,
повышает эффективность работы митохондрий за счёт их омоложения и усиления активности
*
*
*.
Кроме того, метоксантин поднимает уровень гемоглобина и снижает концентрацию IL-6 и CRP в плазме
*.
Добавление метоксантина в рацион животных увеличивает у них количество митохондрий в клетках
*
*.
Приём 20 мг/сут метоксантина в течение 12 недель помогает предотвратить снижение функции мозга у пожилых людей, особенно в отношении внимания и рабочей памяти
*,
а кроме того, снижает уровень липопротеинов низкой плотности в крови по сравнению с контролем
*.
Дозировка: 15-25 мг/сут
*.
PQQ не вызывает острой токсичности при дозировке до 60 мг/сут.
• Витамин C (3×300 мг)
*;
витамин Е; витамины группы В
*
– тиамин (100 мг/сут)
*
*,
рибофлавин (100 мг/сут)
*,
ниацин (50 мг/сут), пантотеновая кислота (50 мг/сут), биотин (30 мкг/сут);
цитрат магния (2-3×500 мг)
*;
смешанные фосфолипиды (1-2×1'000 мг)
*
*;
янтарная кислота (125 мг/сут); гинкго билоба (40 мг/сут); сукцинат (125 мг/сут)
также могут различными путями улучшать функцию митохондрий
*.
Однако это касается, видимо, тех случаев, когда их поступление с пищей недостаточно.
Смеси различных этих антиоксидантов будут, видимо, более эффективны, чем каждый из них в одиночку
*.
Однако до сих пор существует слишком мало клинических исследований, оценивавших их комбинации
*
*
*.
Хотя добавки витаминов и минералов обычно бывают полезны лишь в случае их дефицита, именно такое состояние чаще наблюдается у раковых больных.
• Кальций и магний имеют важное значение для производства энергии митохондриями, поэтому нужно следить за их достаточным поступлением в организм вместе с пищей.
• Литий улучшал митохондриальные функции в доклинических исследованиях * *. Однако доказательства его пользы при раке пока не были предоставлены.
Липиды и транспортёры:
• Жирные кислоты ω-3 (3×1'000 мг) помогают сохранять целостность митохондриальной мембраны и восстанавливать её при окислительном повреждении.
• Среднецепочечные жирные кислоты (MCFA), в сравнении с длинноцепочечными, обеспечивают лучшую дыхательную способность митохондрий без увеличения окислительного стресса *.
• L-карнитин (L-carnitine) помогает прохождению жирных кислот сквозь внутреннюю митохондриальную мембрану. Он способствует увеличению производства энергии из жирных кислот, защищает митохондрии от окислительного стресса, а также увеличивает скорость окислительного фосфорилирования в митохондриях
*.
Клинические исследования показывают увеличение функциональности митохондрий вследствие приёма 1-2 г/сут L-карнитина
*
*
*,
(обычно 3×500 мг).
• Ацетил-L-карнитин (acetyl-L-carnitine) является более эффективным вариантом L-карнитина. Он действует синергически с альфа-липоевой кислотой, омолаживая дряхлеющие митохондрии. Дозировка: 300-3'000 мг/сут, (обычно 3×250 мг).
Митохондриальные модуляторы:
• Метформин (metformin) на самом деле является митохондриальным токсином. Он затрудняет работу ОФ, что, казалось бы, противоречит тому, что нам нужно. Тем не менее, метформин производит отбраковку самых слабых митохондрий, по сути, просто добивая их. Такой процесс называется митофагия. Предполагается, что уничтоженные митохондрии в дальнейшем заменяются более молодыми и качественными. Благодаря этому, выработка энергии путём ОФ растёт, а негативное влияние нефункциональных митохондрий снижается.
Таким образом, при максимально допустимых при диабете дозах (36 мг/кг), метформин способствует улучшению в клетке качества митохондрий *. Вещества с подобными свойствами, способствующие улучшению работы митохондрий раковых клеток, имеют название митоканы (аббревиатура от слов митохондрия и рак).
Другим объяснением парадокса, почему митохондриальные токсины приводят к обратному эффекту, является теория гормезиса. В соответствие с этой концепцией, низкие токсические дозы вызывают полезные компенсаторные реакции, которые превосходят восстановление вызвавшего их повреждения и фактически приводят к улучшению клеточной приспособленности по сравнению с исходными состояниями.
У пременопаузных пациенток, долгосрочно принимавших метформин (1'500 мг/сут в течение 16 недель), в митохондриях наблюдались рост потребления кислорода, увеличение мембранного потенциала, митохондриальной массы, а также снижение концентрации свободных радикалов по сравнению с контролем *. Дозировка: до 1'500 мг/сут *.
Кроме того, при помощи других механизмов метформин имитирует некоторые биологические преимущества, достигаемые путём ограничения калорий (улучшение физической работоспособность, повышение чувствительности к инсулину, снижение уровня липопротеинов низкой плотности и холестерина) без фактического снижения потребления калорий.
Как видим, метформин действует в направлении, которое противоположно другим митохондриальным модуляторам. Например, CoQ10 является активным игроком электрон-транспортной цепи , а метформин блокирует работу электрон-транспортной цепи. Возникает справедливый вопрос, можно ли комбинировать метформин, например, с коферментом CoQ10? Некоторые опыты на животных дают основания предположить, что CoQ10 и метформин не мешают действию один другого * *. Похоже, в то время, как метформин удаляет клетки со слабыми митохондриями, CoQ10 укрепляет клетки с более-менее функциональными митохондриями. Тем не менее, данный вопрос всё ещё остаётся открытым.
• Уролитин А (urolithin A), подобно метформину, способствует гибели нефункциональных митохондрий. Действие обоих этих веществ можно сравнить с действием хищников в живой природе, которые в целом способствуют выживанию биологических видов своих жертв путём уничтожения наиболее слабых особей.
Систематический обзор, включавший в общей сложности 41 исследование на животных отметил нейропротективную, антиметаболическую активность, а также нефропротекторную, миокардиальную, противовоспалительную и скелетно-мышечную защиту уролитина А, уролитина В и синтетического аналога метилированного уролитина А *.
Контролируемое 4-месячное клиническое исследование показало, что приём 500-1'000 мг/сут уролитина А (Mitopure™) у пожилыми людьми (40-64 года) несколько улучшал функции митохондрий. Это проявлялось в повышении повышении мышечной силы, работоспособности и пикового потребления кислорода. Кроме того, уролитин А снижал показатели воспалительных маркеров, таких как С-реактивный белок *. Другое 4-месячное контролируемое клиническое исследование с участием старых людей (65-90 лет) показало подобные результаты. Приём 1'000 мг/сут уролитина А по сравнению с плацебо повышал мышечную выносливость и снижал уровень С-реактивного белка, хотя здесь эти изменения не были выразительными *.
В организме человека уролитин А естественным путём вырабатывается из эллаговой кислоты и её производных при помощи кишечных бактерий. Богатым источником предшественников уролитина А являются такие пищевые продукты, как гранат, клубника, грецкий орех, малина и миндаль. Однако не все кишечные бактерии способствуют производству уролитина. Одно исследование показало, что люди с более высоким соотношением Firmicutes:Bacteroidetes (где низкое соотношение было связано с дисбиозом кишечника) и большим количеством Clostridiales, Ruminococcaceae и Akkermansia muciniphilia являются лучшими производителями уролитина А *.
У огромной части населения наблюдается ухудшение соотношения бактерий Firmicutes к его антагонистическому отделу бактерий (Bacteroidetes) в пользу последнего. Нормализация баланса между этими двумя группами бактерий, несомненно, принесла бы значительную пользу. Однако с практической точки зрения, микрофлору кишечника трудно корректировать, точно так же, как и контролировать результаты этой коррекции. Таким образом, добавки уролитина А выглядят более надёжным и эффективным способом увеличить его концентрацию в организме.
• Бетаин, он же триметилглицин, которым богата столовая красная свекла, in vitro стимулирует увеличение количества и активность митохондрий *, и приводит к усилению митохондриального дыхания *.
Комбинации некоторых из вышеперечисленных средств прошли клинические исследования. В одном двухмесячном исследовании пациенты с трудноизлечимой хронической усталостью улучшили показатели утомляемости на треть, принимая комплекс, состоящий из мембранных фосфолипидов (2'000 мг/сут), CoQ10 (35 мг/сут), микрокапсулированного NADH (35 мг/сут), L-карнитина (160 мг/сут), α-кетоглутаровой кислоты (180 мг/сут), а также липидов и других добавок * *.
Физическая активность. Функциональность митохондрий могут быть улучшена и поддержана стимулированием аутофагии, а также путём снижения потребляемых калорий и умеренной физической активностью * *. Действительно, увеличение физической нагрузки приводит к усилению аутофагии * * и увеличению потребности в энергии, а значит к более эффективной работе митохондрий. Это стимулирует клетки увеличивать количество и качество митохондрий.
Дополнительно, могут оказаться полезными такие практики снижения стресса, как медитация или йога, а также полноценный сон. Здоровая диета, детоксикация, снижение воспаления и связанного с ним окислительного стресса также защищают митохондрии от химических повреждений, которые уменьшают количество копий митохондриальной ДНК и производство АТФ. Методы снижения уровня воспаления будут рассмотрены разделе «Противовоспалительная терапия» †.
Эмоциональный фон. Как бы невероятно это ни звучало, но в одном из исследований сообщалось об ассоциации между положительными эмоциями и способностью митохондрий к производству энергии *. Повышенное позитивное настроение увеличивало ферментативную активность дыхательной цепи митохондрий, а также количество копий митохондриальной ДНК. По психологическому состоянию людей в течение 3 дней до забора крови можно было предсказать их митохондриальный индекс здоровья, но не наоборот, что предполагает причинно-следственную связь.
В данном случае исследовались митохондрии иммунных клеток – лейкоцитов, что может быть непосредственно связано с их способностями уничтожать патогены. Но, как можно предположить, митохондриальное здоровье других клеток организма точно так же может зависить от эмоционального настроя человека через сложную систему гормональной и другой клеточной коммуникации.
Ограничение энергетических ресурсов. Митохондрии раковых клеток не в состоянии вырабатывать достаточный уровень энергии из-за структурной и/или функциональной аномалий *. И хотя раковые клетки значительно увеличивают производство энергии за счёт гликолиза, митохондриальное производство энергии всё ещё остаётся для них критически важным. Дальнейшее снижение энергетики раковых клеток может привести их к гибели, а опухоль – к снижению скорости роста.
Результаты более чем 30-летних исследований убедительно доказывают, что ограничение калорий является, видимо, самым мощным и широко действующим пищевым вмешательством для подавления процесса канцерогенеза *. Метаболическая перегрузка питательными веществами вызывает дефрагментацию сети клеточных митохондрий, тогда как периодическое голодание вызывает аутофагию, при которой нефункциональные митохондрии удаляются.
Можно обоснованно предположить, что избыток калорий и недостаток кислорода значительно ослабляет сдерживание пролиферации клеток и ускоряет формирование ракового фенотипа клеток. С другой стороны, недостаток калорий и обилие кислорода сдерживает клеточный рост и стимулирует аутофагию, в ходе которой удаляются слабофункциональные органеллы и клетки, включая раковые клетки.
Действительно, теоретические модели показывают, что повышенное обеспечение ткани топливным сырьём приводит к быстрому проявлению таких отличительных признаков раковых клеток, как безудержный рост и тканевая инвазия *. Если при нехватке глюкозы конкурентное преимущество находится на стороне клеток с более экономичным аэробным дыханием, то при обилии глюкозы оно на стороне клеток с более быстрым анаэробным дыханием *.
Иначе говоря, неограниченные ресурсные условия способствуют распространению ракового фенотипа, а ограниченные ресурсные условия препятствуют этому. Исходя из данного принципиального положения, энергетический голод должен не только снижать риск рака, но также способствовать подавлению раковых клеток и склонять их к митохондриальному дыханию.
Действительно, ограничение поступления в клетки сырья для производства энергии значительно замедляет рост и развитие многих типов рака, включая рак молочной железы *. При этом снижается не только уровень инсулина, но и уровень фактора роста IGF-1, который стимулирует метаболизм и рост опухолевых клеток *. В то время как любое терапевтическое средство нацелено на одну или несколько мишеней, ограничение клеточной энергии накрывает целый ряд терапевтических целей, в том числе воспаление и ангиогенез * *.
Ограничить энергетические ресурсы клеток можно при помощи следующих приёмов:
Снижение объёма и калорийности пищи. Ограничение калорий может вызвать подавление множества генов и метаболических путей, регулирующих гликолиз *. Физиологический минимум, рекомендованный Управлением по профилактике заболеваний и укреплению здоровья США (The Office of Disease Prevention and Health Promotion) для женщин среднего телосложения составляет ~ 1'600 ккал/сут *, однако это значение должно быть скорректировано в зависимости от возраста, роста, индекса массы тела и уровня физической активности *. При заданном минимальном уровне, максимальная калорийность суточного рациона не должна превышать 2'400 ккал/сут. Именно такое диапазон значений суточной калорийности ассоциируется с наинизшими показателями заболеваемости *.
Тем не менее, даже низкокалорийное питание должно быть адекватным. Если пища не сможет обеспечить поступления достаточного уровня незаменимых веществ, их придётся принимать в виде добавок. Особенно это касается рибофлавина, никотинамида, пантотеновой кислоты, других витаминов и ферментов, участвующих в михондриальной функции.
Поскольку наибольшей калорийностью обладают жиры, а наименьшей – углеводы, легче всего снизить потребляемые калории именно за счёт жира.
Ухудшение усвоения углеводов в кишечнике. Существует несколько предназначенных для похудения препаратов, основанных на принципе снижения усвоения углеводов из пищи.
Наиболее известный и изученный из них – это метформин. Другие натуральные ингибиторы поглощения глюкозы, такие как ресвератрол (resveratrol), физетин (fisetin), мирицетин (myricetin), кверцетин (quercetin), апигенин (apigenin), цианидин (cyanidin), даидзеин (daidzein), гесперетин (hesperetin), нарингенин (naringenin), катехин (catechin) *, генистеин (genistein) *, а также силибинин * показали аналогичный эффект в доклинических исследованиях. Тем не менее, результативность последних по сравнению с метформином довольно низкая.
Угнетение производства глюкозы в печени (ингибирование глюконеогенеза).
Самым доступным, испытанным и безопасным препаратом, снижающим глюконеогенез, является всё тот же метформин.
Истощение уровня глюкозы в крови за счёт усиленного её расходования. Мышечные клетки используют глюкозу в качестве основного источника энергии, а нейроны головного мозга – в качестве единственного источника энергии. Увеличение физической и умственной нагрузки будет, таким образом, увеличивать расход глюкозы и снижать уровень инсулина в крови. В свою очередь, стабильно низкий уровень глюкозы и инсулина будет способствовать поддержанию оптимального митохондриального здоровья.
Замечено, что в условиях гипоксии клетки молочной железы накапливают большой запас энергии в виде гликогена, что способствует защите клеток от окислителей и пролиферации. Причём, чем более агрессивна опухоль, тем больше гликогена в ней накапливается *. Удельные запасы гликогена в агрессивной опухоли могут быть сравнимы с его запасами в печени. Отключение способности использовать эту энергию при помощи гликогенфосфорилазы (ингибитора фермента, ответственного за расщепление гликогена), делает злокачественные клетки намного менее агрессивными *. Примечательно, что эффективна здесь лишь та изоформа фермента, которая характерна для головного мозга, а не для печени. Несмотря на всю заманчивость такого предложения, до его практического применения пока ещё очень далеко.
Ограничение поступления глюкозы внутрь клетки. Глюкоза транспортируется внутрь клеток при помощи либо пассивных мембранных транспортёров GLUT, либо при помощи АТФ-зависимого и натрий-зависимого транспортёра SGLT. Парализуя работу этих транспортёров, можно снизить поступление глюкозы внутрь клетки. Известно несколько растительных средств, способных в незначительной степени подавлять работу транспортёров глюкозы in vitro.
Это катехин, даидзеин, гесперетин, физетин, нарингенин
*
и другие флавоноиды. Способы действия натуральных ингибиторов могут, однако, заметно различаться.
Генистеин, например, связывает транспортер GLUT1 на внешней поверхности, в то время как кверцетин взаимодействует с его внутренней поверхностью
*.
Кверцетин и EGCG
*,
лютеолин, кемпферол
*,
силибинин, теафлавин ингибируют инсулин-стимулированное поглощение глюкозы.
Думается, что их комбинация будет более эффективна, чем каждый из ингибиторов по одиночке.
Несмотря на логичность предложения ограничить приток глюкозы в клетки, при высокой концентрации глюкозы в крови против такого решения будет решительно протестовать инсулин, задача которого – снизить содержание глюкозы в крови до приемлемого уровня, распихав её по клеткам. Если нам удастся усложнить импорт глюкозы в клетки, в крови может быть высокий уровень как глюкозы, так и инсулина. То есть, мы создадим этим симптомы диабета II типа. Это значит, что прибегать ограничению глюкозы внутрь клетки можно лишь при условии, что её концентрация в крови будет находиться в безопасном диапазоне.
Подавление процесса гликолиза в клетках снижает количество сырья для производства энергии. Как уже говорилось, недостаток пирувата будет замедлять деление раковых клеток, а серьёзный его дефицит – вызывать клеточную гибель.
В настоящее время применяется ограниченное количество специально разработанных ингибиторов гликолиза, и все они имеют определённые недостатки.
• Иматиниб (imatinib) – ингибитор тирозинкиназы. Он подавляет активность первого фермента метаболической цепочки гликолиза – гексокиназы, что блокирует все остальные ферментативные превращения глюкозы в пируват. Кроме того, иматиниб подавляет активность рецепторов фактора роста тромбоцитов (PDGF) и фактора стволовых клеток (SCF). Утверждён для клинического применения при лейкозе. Угнетение гексокиназы, в сравнении с угнетением других ферментов гликолиза, более выгодно тем, что гексокиназа может блокировать апоптоз клеток.
Лонидамин (lonidamine)
*
также подавляет гексокиназу.
• 3-бромопируват (3-BrPA) – клинически применяемый препарат, который подавляет активность гексокиназы. На сегодня это самое сильное из клинически применяемых средств ингибирования анаэробного дыхания. Бромопируват более активно подавляет дыхание в раковых клетках, потому что в нормальных клетках гораздо меньше транспортеров, способных перемещать 3-BrPA в клетки.
• Клотримазол, используемый в противо
Ежедневные подкожные инъекции клотримазола (120 мг/кг в течение 10 недель) очень сильно уменьшали у иммунодефицитных мышей количество метастазов в лёгких *. В человеческом масштабе такая дозировка эквивалентна примерно 700 мг/сут. Комбинирование клотримазола с иматинибом in vitro синергично ингибировало у мышей рост раковых клеток молочной железы (T47D) *.
• Витамин C в очень высоких дозах ингибирует гликолитический фермент GAPDH (шестой этап гликолиза) и истощает клеточный глутатион, что приводит к энергетическому голоду и окислительному стрессу *. Внутрибрюшинные инъекции витамина C (4 г/кг) значительно снижают у мышей рост опухоли по сравнению с контролем *. Дозировка инъекций, эквивалентная человеческой, составит примерно 25 г/сут. Такие сверхдозы допустимы только в краткосрочной перспективе, например, в качестве дополнения к лучевой или химиотерапии.
• Стирипентол (stiripentol) – противо
• Ороксилин (oroxylin A) – флавоноид из корня Шлемника байкальского (Scutellaria baicalensis), ингибирует in vitro (150 мкМ) гликолиз в клетках карциномы молочной железы путём блокировки гексокиназы (hexokinase-II, HKII) * *. Вогонин (wogonin) – другой флавоноид из корня шлемника, ингибирует in vitro (2 мкМ), кроме гексокиназы, лактатдегидрогеназу, пируватдегидрогеназную киназу *, а также пируваткиназу (pyruvate kinase, PK) *.
• Метилглиоксаль (methylglyoxal) *, ализарин (alizarin) *, шиконин (shikonin) * ингибируют гликолиз in vitro (путём подавления других гликолитических ферментов.
Наиболее привлекательным выглядит использование ингибиторов именно гексокиназы, потому что это сразу же препятствует производству как энергии, так и строительного материала для создания дочерней клетки.
Проблема с ингибированием гликолиза состоит в том, принятая клеткой глюкоза, вместо того, чтобы расходоваться на производство энергии, будет накапливаться внутри клетки со всеми вытекающими негативными последствиями. Во избежание этого, такую терапию можно использовать лишь с одновременным снижением общей калорийности потребляемой пищи.
Подавление альтернативных метаболических путей производства энергии. Несмотря на существенную зависимость раковых клеток от гликолиза, его подавление проявляет недостаточное влияние на сдерживание роста опухоли. Ограничение потребления глюкозы имеет свои пределы, а кроме того, глюкоза является не единственным источником сырья для производства АТФ. При нехватке глюкозы клетки способны задействовать альтернативные, менее эффективные источники энергии, главным образом, аминокислоты и липиды. Клетки вообще демонстрируют необычайные способности извлекать энергию из имеющегося в наличии материала, в том числе из молочной кислоты *, кетонов * и неизвестных пока источников *.
Уменьшение производства АТФ из глютамина. Пролиферирующие/гликолитические клетки легко переключаются с глюкозного на аминокислотное сырьё, преимущественно на глютамин.
Глютамин может использоваться клетками для митохондриального производства энергии через окислительное фосфорилирование. Точно так же, как и другие источники энергии, глютамин поступает в митохондрии, где участвует в серии замкнутых ферментативных реакций, называемых цикл Кребса. Молекулы, образующиеся в ходе этого цикла, являются донорами электронов для процесса окислительного фосфорилирования (ОФ). В ходе ОФ энергия накапливается в фосфатных связях молекулы АТФ, а затем расходуется на нужды клетки.
В идеале, из 1 поступившей в клетку молекулы глюкозы (расщеплённой на 2 молекулы пирувата) можно получить энергию для 38 единиц АТФ; из них 8 заряжаются в процессе гликолиза (2 прямо и 6 косвенно), 6 – в процессе преобразования пирувата в ацетил-КоА, и ещё 24 – в процессе ОФ. В качестве конечного метаболита образуется 6 молекул воды и 6 молекул углекислого газа. Хотя раковые клетки обычно являются инвалидами ОФ из-за плохо работающей цепи переноса электронов, работоспособность ферментов цикла Кребса у них сохраняется. Поэтому глютамин получает шанс заряжать молекулы АТФ путём т.н. субстрактного фосфорилирования на отрезке превращений сукцинил-КоА → сукцинат (FTP). Эта реакция – ферментативная, поэтому она не требует кислорода.
Почему внимание обращено именно на глютамин, а не любую другую аминокислоту? Во-первых, это самая распространённая в организме аминокислота. А во-вторых, из-за особенностей метаболизма глютамина. Хотя другие аминокислоты тоже могут обеспечивать производство энергии, глютамин является единственной аминокислотой, которая не требует энергетических затрат на её метаболическое превращение в сукцинил-КоА *. Благодаря этому, по сравнению с другими аминокислотами, глютамин обеспечивает наибольшую эффективность производства энергии, а для раковой клетки экономия энергии критически важна.
Таким образом, раковые клетки могут получать путём ферментации глютамина достаточно большое количество энергии. И, как показали опыты с раковыми клетками глиобластомы, эту возможность они интенсивно используют *. Поэтому глюкозное голодание будет слабоэффективной терапией, если не заблокировать этот альтернативный источник клеточной энергии *.
Стратегия ограничения снабжения клеток глютамином может иметь различный успех в зависимости от подвида рака молочной железы. Клетки люминального типа являются глютамин-независимыми, тогда как клетки базального типа являются глютамин-зависимыми *. Таким образом, ингибиторы глютаминазы могут оказаться более эффективными против самых агрессивных подтипов – TNBC и базальноподобного HER2+-рака молочной железы, но не против люминального ER+-рака *.
К сожалению, снижение уровня глютамина с практической точки зрения более проблематично, чем снижение уровня глюкозы. Отказ от потребления животного белка и молочных продуктов, а также таких растений, как шпинат, бобы и капуста, могли бы в какой-то степени помочь в решении этой проблемы. Однако растительная пища содержит не только глютамин, но и многие другие полезные нутриенты, и её ограничение приведёт к неполноценности пищи.
Кроме того, белок и глютамин требуются и нормальным клеткам, а не только раковым. В частности, глютамин активно используют макрофаги, T- и B-клетки иммунной системы; а также клетки кишечника. Кроме того, глютамин требуется для передачи импульсов нейронами головного мозга. Поэтому речь может идти лишь об ограничении определённых продуктов и изменении структуры рациона в плане сокращения потребления белка до физиологического минимума. Поскольку глютамин может синтезироваться из других аминокислот, причём нераковыми клетками самой опухоли, возможно, на время терапии стоит ограничить потребление любого белка. И, возможно, даже всех этих усилий будет недостаточно, если мы не будем использовать ингибиторы глютаминолиза.
Поиск эффективных и безопасных ингибиторов глютаминолиза пока не очень успешный, но работы в этом перспективном направлении не прекращаются.
• Фенилбутират (phenylbutyrate) – ароматическая жирная кислота, которая прошла клинические испытания (300 мг/кг * *) и применяется для лечения врожденных нарушений цикла мочевины. Метаболиты фенилбутирата связываются с глютамином и выводят его с мочой, значительно снижая его уровень в плазме *.
• Урсоловая кислота, особенно в сочетании с куркумином или ресвератролом, ухудшает поступление глютамата внутрь клеток *.
• EGCG (эпигаллокатехин галлат) и другие полифенолы зелёного чая * * подавляют некоторые этапы процесса глютаминолиза и липогенеза, однако их эффективность была выявлена лишь в доклинических исследованиях, в том числе на мышах. Дозировка полифенолов, эквивалентная человеку, составляла здесь 8 мг на 1 кг массы тела, т.е. 500 мг при весе тела в 65 кг.
Производство АТФ из липидов. Жирные кислоты в качестве топлива для производства АТФ широко используются клетками печени, почек, мышц, а также клетками жировой ткани.
В условиях дефицита глюкозы клетки многих других органов и тканей также могут прибегать к метаболизму липидов. Например, при длительном голодании кетоновые тела, которые выделяются в кровь клетками печени в ходе метаболизма жирных кислот, могут использоваться в качестве топливных молекул. В конце концов, жир для того и откладывался, чтобы воспользоваться его энергией в «чёрный день».
Связь между потреблением жира и риском развития ракового процесса более подробно будет рассмотрена в разделе «Диетотерапия» †. Но надо понимать, что степень негативного влияния жира на рак зависит от калорийности рациона. В конце концов, клетке безразлично, откуда черпать энергию, и поэтому общее ограничение потребляемых калорий может иметь более важное значение, чем выбор источников этих самых калорий.
Несмотря на то, что метаболические пути производства энергии из глюкозы, аминокислот и жирных кислот начинаются по-разному, они в конечном итоге сходятся в общее место – цикл Кребса, и должны заканчиваться окислительным фосфорилированием. Из всех основных источников энергии (глюкоза, липиды и аминокислоты) лишь глюкоза является наиболее эффективно ферментируемым сырьём. Менее эффективным, но достаточно конкурентным, является глютамин. Остальные источники энергии имеют намного меньшую эффективность, так как требуют затрат энергии на свой метаболизм.
Чуть выше уже говорилось, что сокращение поступления энергии в виде глюкозы раковая клетка в какой-то мере может компенсировать поступлением энергии в виде глютамина. Потому что и глюкоза, и глютамин являются ферментируемым сырьём. В то же время кетоновые тела (ацетоацетат и β-гидроксибутират) не являются ферментируемым сырьём. Для выработки из них энергии требуется окислительное фосфорилирование. Кетоновые тела поступают в митохондрии и включаются в цикл Кребса уже в виде сукцината, минуя метаболический отрезок субстрактного фосфорилирования (сукцинил-КоА → сукцинат) *. Кроме того, можно ожидать, что включение кетоновых тел в цикл Кребса уменьшит использование клеткой глютамина, потому что они начнут конкурировать за ферменты последующих этапов цикла Кребса.
А что, если обрезать снабжение клеток и глюкозой, и глютамином, и вместо этих двух источников энергии снабжать их кетоновыми телами, причём в минимальном количестве? Тогда выработка энергии упадёт как в нормальных, так и в раковых клетках. Однако нормальные клетки сохраняют в достаточно функциональном состоянии механизм ОФ, который обеспечивает высокий выход АТФ. Поэтому они могут легче переносить энергетический кризис, генерируя энергию из кетоновых тел. Тогда как раковые, и другие клетки с деградировавшим механизмом ОФ, подвергнутся смертельно опасному метаболическому стрессу.
Причём в этом случае надеяться на помощь других клеток микроокружения опухоли раковым клеткам не придётся. Клетки-помощники сами будут находиться в состоянии энергетического кризиса. Поэтому раковые клетки будут в менее выгодном положении с точки зрения выживания, и будут вынуждены прекратить свой рост. Клетки с самыми нефукциональными митохондриями пострадают сильнее других, и могут закончить свою жизнь апоптозом.
Из таких соображений вытекает заманчивое предложение изменить структуру потребления пищи таким образом, чтобы радикально сократить поступление метаболируемых углеводов и белков, но увеличить поступление жирных кислот. Безусловно, одновременно с минимальным снижением общего потребления калорий. На этом теоретическом принципе основана т.н. кетогенная диета, которая будет далее рассмотрена более подробно †. В некоторых клиниках кетогенную диету ограниченно используют в качестве дополнительной терапии, а также для усиления терапевтического действия последующей за этой диетой химиотерапии.
На этом же подходе основана предложенная д-ром Томасом Сейфридом (Thomas Seyfried) * стратегия лечения, которую он назвал Press-Pulse. Здесь на раковую клетку сперва осуществляется энергетическое давление (Press). Для этого используется кетогенная диета, при которой общее потребление энергии максимально сокращается. Для блокировки гликолиза обрезается потребление углеводов, а для блокировки глютаминолиза кратковременно используются ингибиторы глютаминолиза, потому снизить уровень глютамина диетическим путём невозможно. В результате возможности ферментативного производства клеточной энергии резко падают, сильно обрезая энергоснабжение раковой клетки *.
Таким образом, рост раковой клетки подавляется. Тем не менее, энергии, получаемой от ОФ, может быть всё ещё достаточно для сохранения её жизнеспособности. Поэтому далее осуществляется удар химиотерапией (Pulse). В условиях жестокого энергетического кризиса у раковой клетки просто не хватает сил откачивать из клетки токсины, и она становится очень уязвимой для химиотерапии. Благодаря этому, дозировка токсинов может быть существенно снижена, вместе с негативными последствиями химиотерапии для всего организма. Правда, такой протокол требует очень тонкого регулирования, который достижим лишь в клинических условиях.
Уменьшение производства АТФ из альдегидов *. Кетоновые тела, вырабатываемые печенью из жирных кислот, могут метаболироваться в альдегиды, а альдегиды при помощи фермента альдегиддигидрогеназа (ALDH1) – в карбоновую кислоту. В ходе последней реакции производится NADH, который может быть ещё одним источником энергии для производства АТФ *.
Подавление ALDH с помощью госсипола в комбинации с подавлением митохондриального комплекса I с помощью фенформина приводило к истощению продукции АТФ в раковых клетках до 80 %, в то время как нормальные клетки не имели потери продукции АТФ
*.
Эта манипуляция сопровождалась сокращением роста привитой опухоли у животных. Госсипол, однако, нельзя назвать удачным выбором для человека.
Третиноин (ATRA) в экв. дозе 0,6 мг/сут
*
и сульфорафан (sulforaphane) в экв. дозе 320 мг/сут
*
в опытах на животных подавляют ALDH, снижая опухолевый рост, и выглядят более привлекательными натуральными ингибиторами ALDH.
Подавление производства топливного сырья внутри опухоли. Раковые клетки – не единственный тип клеток, образующих опухоль. Некоторые из клеток микроокружения опухоли могут преобразовывать выделяемый гликолизными клетками лактат обратно в пируват, который раковые клетки могут принимать и снова использовать в качестве топлива. К сожалению, до сих пор не предложено никакого способа избежать такого способа питания раковых клеток. Нейтрализация лактата во внеклеточном пространстве опухоли путём внутриопухолевых щелочных инъекций, например, пищевой соды, выглядит чересчур авантюрным методом. А снижение общей кислотности тканей, например, путём щелочных инфузий, выглядит малоэффективным из-за высокого внутриопухолевого давления, которое препятствует поступлению веществ внутрь опухоли.
Коррекция метаболизма пирувата. Нормализация клеточного дыхания предполагает усиление митохондриального производства АТФ, и одновременно с этим подавление ферментативного. Хотя ограничение топливного сырья будет ограничивать производство энергии и склонять клетку к более эффективному его использованию, этого косвенного принуждения будет, наверняка, недостаточно. Чтобы вынудить клетку вернуться к митохондриальному дыханию, придётся обратиться к методам прямого принуждения.
Подавление ферментации пирувата. Метаболирование пирувата в лактат происходит с участием фермента лактатдегидрогеназа. Нейтрализация этой биохимической реакции прерывает метаболический путь производства АТФ, характерный для раковых клеток, тем самым лишая их значительной части энергии.
• Диклофенак
*
– нестероидный противо
• Эпигаллокатехин-галлат (EGCG) * и стирипентол (stiripentol) * в определённой степени также могут подавлять лактадегидрогеназу.
Двойной удар по энергоснабжению раковых клеток (ферментация и слабые митохондрии) может поставить их на грань существования. Поэтому более эффективным выглядит комбинация всех перечисленных выше мероприятий.
Активизация перемещения пирувата в митохондрии. Если ферментация пирувата в лактат заблокирована, то полученный в результате гликолиза пируват может быть использован митохондриями для окислительного дыхания. Проблема, однако, не только в том, что митохондрии сами по себе плохо работают, но и в том, что могут существовать некоторые препятствия для проникновения пирувата в митохондрии. Например, присутствующий в клетке фермент пируватдегидрогеназная киназа (PDK) угнетает поступление пирувата внутрь митохондрий. Существует 4 изотипа PDK (PDK1-PDK4), и среди них PDK3 обладает самой высокой ферментативной активностью и является единственным ферментом, который не ингибируется высокими концентрациями пирувата.
• Дихлорацетат натрия (dichloroacetate, DCA) * * – это аналог уксусной кислоты, в которой два из трёх атомов водорода метильной группы заменены атомами хлора (CHCl2COOH). Соли DCA ингибируют PDK *, что способствует увеличению притока пирувата в митохондрии, обеспечивая их сырьём для окислительного дыхания. А активация окислительного метаболизма при раке груди, в свою очередь, ведёт к уменьшению метастазирования и снижению роста опухоли *. К сожалению, DCA ингибирует различные изотипы PDK с различной силой, и PDK3 оказался наиболее устойчивым из них *.
DCA прошёл клинические испытания для лечения молочного ацидоза *. У пациентов с плоскоклеточным раком головы и шеи показатели полного ответа в конце лечения были значительно выше в группе DCA по сравнению с плацебо (71 % против 38 %). Однако результаты выживаемости между группами существенно не различались *.
Терапия DCA осложнена его ограниченной способностью достигать митохондрий-мишеней *. Однако добавление кофермента Q10, ацетил-L-карнитина, комплекса витаминов группы В, магния и липоевой кислоты помогает усилить его терапевтическое действие *.
Дозировка дихлорацетата натрия: (1'000-3'500 мг/сут *), приём обычно начинают в расчёте 15 мг/кг массы тела. Соль дихлорацетата разводят в 100 мл воды, и принимают 2-4 раза в день. При ухудшении самочувствия приём прекращают. Поскольку DCA является миметиком пирувата, его можно применять долгое время без опасения вызвать привыкание. Хотя DCA – десятилетиями испытанное лекарство для лечения детей с врожденными нарушениями митохондриального метаболизма, его нельзя использовать в профилактических целях.
На представленном здесь рисунке отображены все предложенные выше усилия по коррекции метаболизма раковой клетки с целью поставить её перед выбором: переключиться на митохондриальное дыхание или умереть.
Если мутации митохондриальной ДНК не дают клетке возможность полноценно использовать ОФ, ей будет трудно выжить. Нельзя, однако, сказать, что этот метод будет достаточно успешен.
Во-первых, общее (вместо локального) воздействие на клетки будет угнетать энергетику всех остальных клеток организма, а не только раковых. Это, конечно, может оздоравливать организм в целом, отбраковывая клетки с плохо работающими митохондриями и удерживая перерождающиеся клетки от окончательного перехода на гликолиз. Однако в организме есть много нормальных клеток, использующих только гликолизное производство АТФ. Сильное ингибирование гликолиза будет сказываться на работе таких клеток, как эритроциты или клетки сетчатки глаза. А нам нужно воздействовать исключительно на раковые клетки.
Во-вторых, доставка терапевтических веществ внутрь опухоли естественным путём затруднена. А введение их непосредственно в опухоль не всегда возможно. Но даже в случае решения этой проблемы, мы возвращаемся к первому пункту: опухоль состоит не только из раковых клеток. Мы не можем избирательно доставлять действующие вещества к нашей цели – раковым клеткам, они будут также поступать и нормальным клеткам, образующих опухоли. Например, иммунным клеткам. И мы не можем предугадать, как от наших действий изменится их функциональность.
Таким образом, манипулирование метаболизмом опухолевых клеток имеет свой определённый предел. Тем не менее, оно может вносить существенный вклад в противоопухолевую борьбу, будучи включенным в состав комплексной терапии.
Все попытки усилить кислородное дыхание опухолевых клеток могут оказаться малоуспешными при недостатке основного участника этого процесса – кислорода.
Низкая концентрация кислорода является ключевым фактором высокой кислотности в опухоли и активности опухолевого процесса. Недостаток кислорода усиливает в клетках гликолиз и вызывает злокачественную трансформацию их фенотипа (эффект Варбурга). И наоборот, присутствие кислорода вызывает подавление гликолиза (эффект Пастера).
Увеличение концентрации кислорода в ткани. Опухолевая гипоксия создаёт серьёзное препятствие для эффективной терапии рака *. Например, основным механизмом лучевой терапии является создание высокой концентрации активных форм кислорода; поэтому дефицит кислорода придаёт гипоксическим опухолям значительно более высокую радиационную стойкость. Многие химиотерапевтические препараты также теряют терапевтическую эффективность в условиях гипоксии. Наконец, гипоксия снижает эффективность иммунотерапии. Таким образом, увеличение концентрации кислорода за счёт снижения кислотности в опухолевом микроокружении, и усиление доставки кислорода в опухоль являются крайне важными факторами противоопухолевой терапии.
Снижение кислотности в тканях будет рассмотрено отдельно в разделе «Кислотно-щелочной баланс» †.
А концентрацию кислорода в крови можно увеличить несколькими путями:
- При помощи естественных переносчиков (эритроцитов). Недостаток кислорода может быть вызван как низким уровнем эритроцитов, так и недостатком гемоглобина, что снижает способность эритроцитов переносить кислород. Последнее может быть вызвано дефицитом в рационе химических элементов (цинк, железо) и питательных веществ (витамин B12, фолат), плохим их усвоением, почечной недостаточностью, кровопотерями и другими причинами.
- При помощи синтетических переносчиков. Кроме эритроцитов, можно использовать альтернативные переносчики кислорода в крови, однако они пока остаются труднодоступными.
- При помощи усиления кровотока. Усиление циркуляции крови, например, за счёт расширения сосудов, позволяет улучшить её способность доставлять кислород
*,
минералы и питательные вещества, а также позволяет повысить эффективность как терапевтических средств, так и профилактику метастазирования. Для этого можно использовать как физиопроцедуры, так и некоторые добавки, например, вазодилататоры. Ухудшение циркуляции крови может вызываться высокой агрегацией эритроцитов и микротромбозом, что может потребовать дополнительных усилий.
- При помощи непосредственного растворения кислорода в крови. Увеличение концентрации кислорода в крови непосредственно, минуя переносчики, можно осуществить путём вдыхания газа с очень высоким содержанием кислорода – как при нормальном атмосферном давлении, так и при повышенном давлении (гипербарическая оксигенация). Последний вариант требует специального оборудования и услуг квалифицированного персонала. Длительное дыхание чистым кислородом может принести не только пользу, но и вред. Во-первых, кислород без добавок углекислого газа заставляет кровеносные сосуды сужаться. Таким образом, можно не только не усилить, а наоборот, ослабить доставку кислорода. Во-вторых, кислород склонен к образованию активных форм кислорода (АФК), обладающих разрушительным действием на любые белки нашего организма.
Стоит также помнить, что длительное воздействие сосудорасширяющих средств увеличивает поставку не только кислорода, но также источников энергии – глюкозы и глютамина. Если одновременного с усилением циркуляции крови не подавлять гликолиз и глютаминолиз, это может способствовать продвижению рака, что ещё раз подчёркивает необходимость комплексного подхода к лечению рака.
Местная гипертермия (41-42 °С) усиливает движение потока жидкости в опухоли и ослабляет сопротивление раковых клеток к лучевой терапии *. Гипертермия может улучшить оксигенацию гипоксичных опухолей молочной железы *. Эффект гипертермии может продолжаться в течение суток после проведенного сеанса *.
Сочетание гипертермии и стандартного лечения может усилить терапевтический эффект. Относительно же использования гипертермии вне курса стандартного лечения нет консенсуса ввиду слабой изученности этой темы. Есть опасение, что усиление циркуляции жидкости может поспособствовать распространению опухолевых клеток. Аналогичный риск касается массажа, инфракрасного и ультразвукового облучения опухолевой зоны. Таким образом, гипертермия может быть рассмотрена в качестве терапии лишь в сочетании с другими терапиями.
Протеолитические ферменты – это ферменты, способствующие расщеплению белка. Их активность регулируется таким образом, чтобы они разрушали чужеродные, мёртвые или нефункциональные белковые структуры, не затрагивая функциональные клетки организма.
Протеолитические ферменты улучшают течение крови за счёт очищения стенок сосудов и снижения уровня фибриногена *, благодаря чему снижается также артериальное давление *. Они очищают как саму кровь, так и содержащиеся в ней клетки от фибрина и слизи, и тем самым разоблачают для иммунной системы антигены на поверхности раковых клеток, снижая риски метастазирования. Из всего множества протеолитических ферментов достаточно изучены лишь несколько.
Трипсин и химотрипсин – наиболее эффективны
*,
однако они труднодоступны.
Бромелаин и папаин извлекаются, соответственно, из стебля ананаса и плодов папайи; и цена их более умеренная.
Серрапептаза (3×10 мг) – протеолитический фермент (металлопротеаза), вырабатываемый энтеробактериями Serratia marcescens в кишечнике тутового шелкопряда. Серрапептаза давно применяется в спортивной медицине для снижения воспалительных процессов при травмах и растяжениях
*.
Среди всех представленных на рынке протеолитических ферментов, серрапептаза выглядит наиболее дешёвым предложением.
Наттокиназа (2×1'000-1'440 фибринолитических единиц) – сериновая протеиназа, вырабатываемая бактериями Bacillus subtilis. В последние годы наттокиназа стала ещё одним популярным ферментом, снижающим тромбообразование
* *, однако её цена пока непривлекательна.
Люмброкиназа (lumbrokinase) содержит в себе группу протеолитических ферментов, включающих в себя активатор плазминогена и плазмин. Её получают из земляного червя Красноватый дождевик (Lumbricus rubellus). Предполагается, что по своим фибринолитическим свойствам люмброкиназа в 30 раз сильнее наттокиназы и в 300 раз сильнее серрапептазы, однако её цена чересчур высока.
Различные ферменты проявляют наибольшую активность при разных уровнях кислотности, и поэтому комплекс, содержащий трипсин, химотрипсин, бромелаин, папаин, серрапептазу, будет, видимо, более универсален, чем любой из этих ферментов в одиночку. Примером такого комплекса может служить Вобензим™. Дозировка: 600-1'000 мг/сут, но не более 4'000 мг/сут *. Допускается длительный приём без перерывов, однако следует проявлять осторожность. Сочетание протеолитических ферментов и их высокая дозировка усиливает действие других антикоагулянтов, что во многих случаях может оказаться очень опасным.
НПВП – нестероидные противо
• Ацетилсалициловая кислота противодействует мутированию ДНК, снижая риск появления любой формы рака. Кроме того, она препятствует агрегации – слипанию тромбоцитов, улучшая тем самым текучесть крови. Поскольку тромбоциты укрывают циркулирующие раковые клетки от обнаружения и уничтожения иммунными клетками, а также облегчают им закрепление на стенках эпителия в отдалённых местах, аспирин способен противодействовать метастазированию. Аспирин также ослабляет тромбообразующий эффект некоторых терапевтических средств, таких как тамоксифен. Комбинация экстракта гинкго (450 мг/сут) с аспирином (100 мг/сут) в клиническом испытании усиливала их антиагрегантный эффект у пациентов после инсульта *. Дозировка: 100 мг/сут.
Длительный приём аспирина хотя и возможен, но нежелателен из-за возможного повреждения эпителия желудочно-кишечного тракта и увеличения проницаемости кишечника. К счастью, салицилаты в достаточно высоких концентрациях встречаются не только в коре ивы, но также во многих пищевых продуктах *. Примерами могут служить мята, тмин, тимьян, паприка, куркума, калинджи, кардамон *. Широкое их использование в качестве приправы позволило бы снизить дозировку самого аспирина.
• Найзилат (амтолметин гуацил). Современный нестероидный противо
Другой аспект противо
Дибазол – известный вазодилататор. Дибазол расслабляет мускулатуру стенок кровеносных сосудов, улучшая циркуляцию крови. Кроме того, он действует как слабый стимулятор иммунной системы. В отличие от ацетилсалициловой кислоты, дибазол не вызывает закисления тканей организма. Дозировка: 3×20 мг за 2 часа до или 2 часа после еды.
Витамин В3 (витамин РР, ниацин, никотиновая кислота, никотинамид) расширяет мелкие кровеносные сосуды (в том числе, головного мозга), улучшая микроциркуляцию крови. Оказывает слабое антикоагулянтное действие, нормализует содержание холестерина в крови, а также обладает дезинтоксикационными свойствами. Дозировка для здоровых людей составляет 20 мг/сут. Передозировка до 100 мг/сут не приносит вреда.
Аргинин (3×700 мг) – незаменимая кислота, способная производить оксид азота (NO), который заставляет клетки гладких мышц расслабляться. Вследствие этого кровеносные сосуды расширяются, усиливая кровоток и улучшая доставку кислорода в ткани.
Лён. В опытах на мышах, потребление молотого льняного семени (10 % от всей пищи) во время терапии тамоксифеном приводило к снижению плотности микрососудов в опухоли и уменьшению высвобождения провоспалительного цитокина IL-1 *. Комбинация семян льна и тамоксифена ингибировала у мышей размер привитой опухоли более чем на 53 % по сравнению с одним лишь тамоксифеном *.
Гемоциркуляторные растения. Улучшают циркуляцию крови в мелких сосудах и капиллярах.
• Конский каштан (Aesculus hippocastanum) содержит эсцин (aescin), который снижает воспаление и уменьшает застой в венах и мелких сосудах * за счёт снижения проницаемости каппиляров. Кроме эсцина, в плодах каштана содержатся кумариновая кислота (p-coumaric acid), кофеиновая кислота (caffeic acid), кверцетин (quercetin), кемпферол (kaempferol) и апигенин (apigenin). Водно-спиртовой экстракт плодов: по 250-300 мг 2 раза в сутки *, или 100-150 мг эсцина в сутки * *.
• Гинкго билоба (Ginkgo biloba) содержит флавоноиды и терпеноиды, которые способствуют повышению тонуса артериальных и капиллярных сосудов, и благоприятствуют улучшению познавательной способности *. Кроме того, экстракт гинкго защищает митохондриальную ДНК от окислительных повреждений *, и улучшает митохондриальное дыхание *. Экстракт листьев: по 40-120 мг 2 раза в сутки *.
• Центелла (Centella asiatica), она же Готу кола. Снижает агрегацию тромбоцитов и улучшает циркуляцию крови, в том числе в головном мозге, способствует расслаблению, снятию симптомов беспокойства * и улучшению познавательной способности *. Экстракт сушёных листьев: по 60 мг 1-2 раза в сутки. Не рекомендуется приём растения более 6 недель подряд.
• Шалфей (Salvia miltiorrhiza) содержит полифенолы и таншиноны, которые in vivo препятствуют слипанию тромбоцитов, что способствует улучшению кровотока * *.
• Боярышник (Crataegus) содержит процианидины и флавоноиды, которые расширяют сосуды, препятствуют тромбообразованию и снижают проницаемость капилляров *. Экстракт боярышника: по 160-900 мг два-три раза в день, что соответствует 30-170 мг процианидинов и 3,5-20 мг флавоноидов.
Каждое из этих средств можно принимать по очереди, чередуя каждые 1,5-3 месяца.
Известные ингибиторы тромбоцитов – инозитол, женьшень, куркума, имбирь, льняное масло, рыбий жир, витамин Е. Следует, однако, проявлять осторожность при их применении, потому что чрезмерное ингибирование тромбоцитов может вызывать внутренние кровотечения, а также внутренние кровоизлияния, например, в глаз. Приём рассмотренных выше средств следует прекратить, начиная за 2 недели до операции, и возобновить не ранее, чем через 1 неделю после операции, по согласованию с врачом.
Учитывая то, что вышеперечисленные средства усиливают действие друг друга, при их совместном приёме дозировка должна быть значительно уменьшена.
Сокращение кислородного спроса. Альтернативное и, возможно, более эффективное решение проблемы гипоксии заключается не в удовлетворении клеточного спроса на кислород, а в сокращении этого спроса. Снижение потребления клетками кислорода уменьшает его истощение в ткани, тем самым увеличивая кислородное насыщение. Компьютерное моделирование показывает, что сокращение уровня потребления кислорода на 30 % столь же эффективно отменяет гипоксию, как и 4-кратное увеличения скорости кровяного потока *. Для этого могут быть использованы следующие средства:
• Атоваквон (atovaquone) – антималярийный препарат, ослабляет опухолевую гипоксию и усиливает эффект лучевой терапии in vitro *.
• Гидросульфид натрия (NaHS) – донор, высвобождающий сероводород (H2S). NaHS вмешивается в дыхательную цепь митохондрий опухолевых клеток, улучшает кислородонасыщение опухолей и повышает эффективность лучевой терапии. Опухоли, облучённые через 15 минут после однократного введения NaHS, оказались вдвое более чувствительными к лучевой терапии, чем опухоли, получавшие только лишь облучение *. В клинических условиях NaHS не применяется.
• НПВП (нестероидные противо
• Метформин – противо
Важно понимать, что помимо принудительного увеличения уровня кислорода в опухоли, на уровень кислорода в опухолевой ткани влияют также многие физиологические факторы. Гормоны щитовидной железы, например, играют ведущую роль в метаболической активности и потреблении кислорода клетками. Более высокие уровни гормона T4 ассоциируются с более высоким риском любого вида злокачественной опухоли, включая рак молочной железы
*.
Таким образом, здоровье щитовидной железы сильно влияет на кислородное насыщение ткани и результативность противо