Стратегия здоровья.
Стратегия борьбы против рака зависит от того, какая из теорий рака будет выбрана в качества рабочей. Если теория, на которой основано лечение, неверна, то, скорее всего, само лечение не будет успешым.
В настоящее время в онкологии существует несколько теорий канцерогенеза * * *. Господствующей теорией, несмотря на растущую критику, до сих пор остаётся Теория соматических мутаций (Somatic Mutation Theory) *.
В соответствии с представлениями этой теории,
- нормальным состоянием клеток человека является покой, а не экспансия;
- появление опухоли является случайностью;
- опухоль представляет собой ткань, образованную ненормальными (мутировавшими) клетками;
- опухоль появляется из отдельной клетки, имеющей одну или несколько мутаций в генах, которые контролируют рост и созревание клеток;
- мутации этих клеток являются необратимыми;
- результатом этих мутаций является неуправляемый рост клеток и проявление клетками других раковых характеристик.
Исходя из этих позиций, лечение рака должно представлять собой уничтожение раковых клеток любыми возможными путями, из которых традиционно применяются скальпель, яд и радиация. А успех лечения зависит от того, насколько полно уничтожены раковые клетки.
Однако для того, чтобы избирательно воздействовать на раковые клетки без существенного ущерба для нормальных клеток, нужно знать отличия раковых клеток от нормальных.
Принято выделять следующие основные признаки рака:
- воспаление и фиброз, связанные с опухолью;
- перепрограммирование энергетического метаболизма раковых клеток, что формирует закисленную гипоксическую межклеточную среду;
- преобладание клеточных сигналов роста над сигналами, подавляющих рост;
- преобладание сигналов выживания клетки над сигналами смерти;
- стимулирование устойчивого роста новых кровеносных сосудов (ангиогенез);
- геномная нестабильность раковых клеток, обеспечивающая им высокую приспособляемость и жизненную стойкость;
- функциональная неполноценность, вызванная незрелостью клеток;
- возможность деления раковой клетки неограниченное число раз;
- управление клеточным микроокружением, в том числе иммунными клетками;
- прорастание раковых клеток в соседние ткани (инвазия) и распространение их в отдалённые участки тела с дальнейшим образованием там опухолей (метастазирование)
*.
Клетки, которым присущи все эти признаки, далее будут называться «раковыми клетками».
Безудержное деление. Жизнь и поведение клетки многоклеточного существа отличается от жизни и поведения существа одноклеточного. Переход от одноклеточного существования к многоклеточному – это переход от вражды и конкуренции однотипных клеток к взаимовыгодной кооперации и сотрудничеству. Это переход от сложной и опасной жизни клетки-одиночки к более простой и безопасной жизни ценой частичной потери своей свободы и принятии бремени обязательств перед другими клетками. Переход от индивидуализма к коллективизму.
В многоклеточном организме каждая отдельная клетка следует не своим эгоистичным интересам, а интересам всего сообщества клеток. Каждая зрелая клетка выполняет свою конкретную функцию, и повинуется не только своим внутренним сигналам и сигналам окружающей среды, но также сигналам соседних и отдалённых клеток. Каждая отдельная клетка общается с другими клетками, посылая им свои сообщения, и принимая от них ответную информацию, которая склоняет их к определённым действиям, начиная от программы «делиться» и кончая программой «умереть».
Сигнальное окружение клетки наполнено множеством противоречивых указаний, однако какое из них будет исполнено, а какое – проигнорировано, зависит от их силы и баланса.
Клетка начинает делиться тогда, когда сигналы, сдерживающие её деление, уступают по силе сигналам, стимулирующие её деление. В нормальных условиях, когда нет никакой необходимости в росте органов или организма в целом, или в быстром восстановлении потерянных клеток ткани, усиливаются сигналы, сдерживающие деление. А в случае, например, травмы и сопровождающей её острого воспаления, происходит временное усиление сигналов деления. В результате происходит местное разрастание ткани (пролиферация).
По сути, раковые клетки – это клетки, потерявшие свою социальную функцию. Клетки, вновь обратившиеся к одноклеточному образу жизни с его бессмертием, анархией и эгоизмом.
Уклонение от апоптоза. Если существование какой-то клетки не соответствует общественным интересам вследствие её ущербности или ненужности, она получает, соответственно, внутренние и/или внешние команды на прекращение своей жизнедеятельности. Если команды на выживание оказываются при этом слабее, то запускается процесс апоптоза – запрограммированного «самоубийства» клетки. Тем не менее, раковым клеткам удаётся вырабатывать механизмы, позволяющие им либо игнорировать команды на самоубийство, либо усиливать команды оставаться в живых.
Высокая генетическая пластичность. Стрессовые условия существования клетки усиливают геномную неустойчивость, а геномная неустойчивость повышает генетическую гибкость, т.е. способствует множественным мутациям в ДНК, в том числе таким, которые позволяют клетке приспосабливаться к выживанию в неблагоприятной среде.
«Бессмертие». Стабильность концевых участков молекул ДНК обеспечивается особыми белками – теломерами. Число теломер, фиксирующих стабильность ДНК, исчерпывается с каждым делением зрелой клетки, поэтому она может делиться ограниченное число раз. Полное истощение теломер приводит к нарушению нормального процесса деления, и как следствие – к апоптозу клетки. Лишь стволовые клетки обладают способностью делиться неограниченное число раз благодаря своей способности восстанавливать теломеры.
Раковые клетки, подобно стволовым клеткам, могут стабилизировать молекулу ДНК за счёт повышения активности фермента под названием теломераза, который восстанавливает теломеры, и благодаря этому делиться бесконечно.
Модификация метаболизма. Клеточный метаболизм – это совокупность всех протекающих в клетках химических реакций. Нормальные клетки получают почти всю необходимую им энергию через окисление пирувата, предварительно получаемого в результате гликолиза глюкозы (аэробное дыхание). Раковые клетки чаще всего получают значительную часть энергии, производя из пирувата молочную кислоту, что не требует присутствия кислорода (анаэробное дыхание). Они делают это независимо от того, достаточно кислорода для аэробного дыхания, или нет.
Воспаление, связанное с опухолью. Несмотря на многообразие канцерогенных факторов, большинство из них сводится к хроническому слабоинтенсивному воспалению, которое провоцирует и стимулирует рак. Воспаление, и связанное с ним местное уплотнение ткани, в настоящее время признаны центральным местом всего онкогенного процесса. Клеточные процессы, связанные с воспалительной сигнализацией, играют основную роль на всех этапах канцерогенеза, включая появление (инициация), развитие (прогрессирование), вторжение (инвазия), приобретение новых кровеносных сосудов (ангиогенез) и дальнее распространение (метастазирование) опухоли *.
Тканевая инвазия и метастазирование. Доброкачественные опухоли имеют чёткую границу, и растут, раздвигая окружающие ткани, но не повреждая их. В отличие от доброкачественных опухолей, злокачественные опухоли не только растут в размере. Раковые клетки могут разъедать окружающую опухоль белковую плёнку, состоящую, в основном из коллагена, и вторгаться в соседние ткани. По этой причине у них нет чётко выраженной границы.
Отделившиеся от опухоли раковые клетки могут переноситься внутренним потоком жидкости (лимфой или кровью) в удалённые части тела, образуя там новые опухоли. И хотя почти все они гибнут в этом трудном пути, некоторым из них всё-таки удаётся уцелеть, создавая риск появления новых очагов опухолей.
Образование квази-организма. Любая клетка, отличная от нормальной клетки хозяина, попавшая в поле зрения нормально функционирующих иммунных клеток, рано или поздно будет выявлена и уничтожена. Этот рутинный естественный процесс происходит бессчётное количество раз в различных частях тела.
Чтобы избежать смерти, у раковых клеток существует множество различных уловок – маскировка; мимикрия; укрывание в защищённой тканевой нише; дезориентация иммунных клеток и создание для них неблагоприятных условий; образование микросфер из подобных себе клеток, что увеличивает их сопротивляемость. И наконец – формирование такого окружения из нормальных клеток, которое будет не работать на организм, а обеспечивать раковые клетки защитой, сырьём и энергией.
В определённом смысле, опухоль – это не просто скопление взбунтовавшихся клеток. Это сложный живой организм, состоящий из различных типов клеток, которые совместно работают, чтобы добывать питание, защищаться и уклоняться от агрессивной для них среды, которая пытается их уничтожить. И конечно, опухоль преследует цели, абсолютно несовместимые с целями организма-хозяина. В этом плане она сродни бандитскому сообществу, которое ставит своё существование и свой корпоративный успех выше общественного, паразитируя при этом на самом обществе.
Момент, когда организм теряет контроль над процессами в микроокружении группировки аномальных клеток, можно считать моментом зарождения раковой опухоли. Однако к нему ведёт целая цепь долгих и взаимосвязанных событий.
Наиболее наглядно наблюдаемые структурные, метаболические, функциональные и другие различия между нормальной и раковой клеткой/тканью сведены в таблицу выше. Эти различия позволяют наносить целенаправленный удар на раковые клетки, щадя при этом клетки нормальные.
Выводы. Несмотря на наличие этих отличительных признаков, ни один из них не является присущим исключительно злокачественным клеткам, и не присущим в тех или иных обстоятельствах не-злокачественным клеткам *.
- Усиленный рост клеток наблюдается и в нормальной ткани при массовой гибели клеток организма вследствие каких-то местных катастроф. При этом скорость деления раковых клеток не выше, чем замещающих клеток при физической травме ткани или нормальных быстроделящихся клеток, например, в кишечнике или костном мозге. Проблема не в усиленном удвоении клеток, а в том, что строительство/восстановление ткани происходит неестественно.
- Способность уклоняться от сигналов, склоняющих к апоптозу, как и способность защищать ДНК за счёт теломеразы, у раковых клеток не выше, чем у нормальных стволовых клеток. Однако «бессмертие» – не исключительное свойство раковых клеток; нормальные стволовые клетки тоже «бессмертны».
- Увеличение производства энергии за счёт гликолиза тоже не является уникальным явлением в раковой клетке. Процент использования гликолиза раковыми клетками не выше, чем клетками раннего эмбриона. Кроме того, некоторые нормальные клетки могут либо постоянно использовать гликолиз для производства энергии (например, нейроны), либо временно переключаться в этот режим (например, мышечные клетки, некоторые иммунные клетки и т.д.).
- Генетические модификации тоже являются естественными, и накапливаются с возрастом. Разница между нормальными и раковыми клетками лишь в том, что последние генетически более неустойчивы, поскольку этому способствует ряд внутренних и внешних стрессовых условий.
- Неполная дифференцировка (функциональная незрелость) также не является уникальным свойством раковых клеток. Нормальные стволовые клетки также не дифференцированы. После деления стволовой клетки, этап неполной дифференцировки дочерние клетки проходят с разной скоростью. Быстрее всех дифференцируются эпителиальные клетки; причём клетки молочной железы полностью и окончательно дифференцируются лишь во время последнего триместра беременности женщины. Проблема раковых клеток в том, что они так и остаются «несовершенновзрослыми», порождая себе подобных «детей».
- Вторжение в соседние ткани не присуще нормальным клеткам, образующим различные органы. Однако оно наблюдается при некоторых незлокачественных явлениях, например, при доброкачественном разрастании матки за пределы своего естественного месторасположения. Кроме того, событием, похожим на «вторжение», можно назвать проникновение иммунных клеток в место заражения в той или иной ткани, что является рутинным естественным процессом. Во всех трёх случаях активизируются одни и те же сигнальные пути.
- Распространение в удалённые места тоже не является для клеток тела штатным явлением. Но теоретически оно возможно, если нормальная недифференцированная клетка попадает в циркулирующие жидкости тела. В нормальных условиях это приведёт к гибели «потерявшейся» клетки.
Из всего этого можно заключить, что характерным для рака является не наличие какой-то одной из этих специфических особенностей клетки, а то, что одновременно проявляется сразу несколько из них. Раковая клетка не является какой-то принципиально особенной клеткой. В этом плане она так же не отличается от нормальных клеток, как не отличается преступник от законопослушного гражданина. Разница между ними не столько в структуре, сколько в поведении.
Вывод, к которому приведут нас дальнейшие рассуждения, следующий. Раковая клетка – это клетка, которая вынуждена проявлять обычно не свойственный нормальной клетке образ действий ради выживания в экстремальных условиях. Образ действий, становящийся характером. Игнорирующий общественное предназначение клетки в организме.
Иными словами, рак – это механизм выживания клеток во враждебной внешней среде, которую они сами же, в основном, и создают. В этом плане внешнее проявление рака можно рассматривать не только как проблему изначальной или приобретённой физической дефектности, но как проблему дезорганизации клеток, которая порождает новый клеточный фенотип *. Как неестественный ход нормальных процессов.
Однако перечисленные выше особенности опухолевых клеток пока ещё остаются набором пазлов, а не цельной картиной. Нам нужно знать не статику, а динамику процесса, причинно-следственные отношения его элементов. Потому что только понимание того, каким образом нормальные клетки приобретают поведение раковых, может дать ответ на вопрос, как этот процесс можно предупредить, затормозить и, по возможности, обратить вспять.
Рак – не огнестрельное ранение, он не появляется внезапно. Процесс развития рака многоступенчатый, и имеет многофакторную причинность. Ему предшествует ряд постепенных разноплановых изменений в тканях того или иного органа, которые могут длиться нескольких лет, и которые не всегда заканчиваются злокачественной опухолью. Эти предраковые изменения провоцируются разнообразными факторами, которые называются канцерогенными *, и которые будут рассмотрены далее †.
В сложной цепи взаимосвязанных внутри- и вне-клеточных факторов риска, каждое из них может быть как начальной причиной, так и следствием других причин. Например, недостаток кислорода в ткани может быть как первичным фактором (вследствие ухудшения кровоснабжения), так и вторичным (вследствие её закисления – из-за метаболитов гликолиза), и петля этих взаимосвязанных процессов способна, в конце концов, зафиксировать данную патологию.
Другие контуры положительной обратной связи могут иметь более запутанный характер. Непродолжительные нарушения привычного течения клеточных процессов вызывают включение компенсаторных механизмов, которые позволяют обойти образовавшиеся проблемы. Однако они требуют дополнительных метаболических реакций, а значит, дополнительного расхода энергии.
Когда проблемы исчезают, клеточный метаболизм возвращается в привычное русло. Но в случаях, когда они становятся хроническими, клетке приходится приспосабливаться к новым условиям и перестраивать свой фенотип так, чтобы более успешно отвечать на стрессовые вызовы, и выживать во всё более ухудшающихся внешних и внутренних условиях.
Инициация опухоли. Попробуем предположить один из возможных, схематически упрощённых описаний развития ракового процесса. В действительности, они намного глубже, сложнее, и могут иметь бесчисленное множество других вариантов и акцентов. Сценарий, описанный ниже, служит лишь для того, чтобы показать сложные переплетения хода развития рака.
Хронический стресс. Клетки, ткани и органы тела постоянно подвергаются бесчисленному множеству острых травмирующих событий. Однако живой организм рано или поздно восстанавливает возникающие повреждения.
Травмирование вызывает ряд местных ответных реакций, способствующих делению клеток и замещению погибших клеток новыми. Воспаление формирует в очаге травмы особую, отгороженную зону, в которой создаются условия, неблагоприятные для жизни чужеродных микроорганизмов. По мере того, как рана заживляется, и в ткани восстанавливается статус-кво, эти временные реакции гаснут. Хроническое травмирование возмущающими факторами создаёт картину незаживающей раны, что формирует условия для непрекращающегося деления и накопления клеток.
Временный рост количества клеток в том или ином органе может наблюдаться и при нормальных, «переходных» условиях. Например, рост чувствительных к половым гормонам клеток груди в период взросления женского организма. В этих случаях кратковременный рост уровня гормонов, стимулирующий деление клеток протоков или долек молочной железы, регулируется генетически, и сопровождается соответствующим уровнем гормонов-спутников и гормонов-антагонистов. Поэтому процессы формирования и созревания груди и детородных органов протекают у женщин естественно и гармонично, не вызывая негативных последствий.
Другой пример – управление рождением и смертью клеток матки в процессе цикла овуляции при помощи колебаний уровня двух антагонистических гормонов – соответственно, эстрадиола и прогестерона. Соблюдение баланса между ними обеспечивает нормальный месячный цикл и здоровье репродуктивных органов. В то же время, возникший по какой-то причине хронически высокий, не сдерживаемый противовесами уровень эстрадиола, его канцерогенных метаболитов или других эстрогеноподобных веществ затрагивает только один аспект клеток – их деление.
В качестве примера негормонального хронического травмирования можно назвать повышенную кислотность ткани молочной железы. Низкоуровневый ацидоз – одно из наиболее распространённых состояний, которое является причиной основных дегенеративных заболеваний человека, в том числе рака груди.
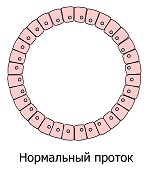
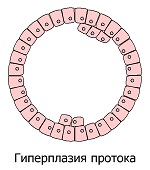
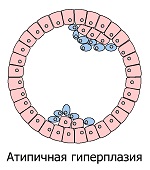
Хроническое возмущение/раздражение/травмирование приводит к ряду фенотипических трансформаций клеток, подвергающихся хроническому стрессу. Внешне это выглядит как последовательное развитие местных аномальных состояний: гиперплазия (избыточное деление нормальных клеток) → метаплазия (замещение клеток одного вида ткани другим) → дисплазия (бесконтрольный рост и потеря дифференцировки клеток) → неоплазия (полная потеря контроля ткани над растущим новообразованием). Рассмотрим подробнее цепочку этих преобразований, которые являются наглядными симптомами невидимых глазу опухолевых процессов.
Пролиферация. В нормальных тканях взрослого организма поддерживается равновесие между количеством гибнущих клеток и количеством появляющимися вместо них новых клеток. Иначе говоря, соблюдается баланс между апоптозом (смертью) и пролиферацией (разрастанием) клеток. Но при опухолевом процессе этот баланс хронически нарушен в сторону пролиферации.
По причине неоднородности структуры органа/ткани и неравномерности снабжения клеток, а также по причине неоднородности распространения в нём возмущающих факторов (внутрипротоковая папиллома, местные тромбозы, кальцификаты, алкоголь, вирусы, бактерии, травма, гормоны), критическое совпадение некоторых из них в отдельных точках молочной железы оказывает значительно более сильное местное стрессовое воздействие *. Такие точки могут в дальнейшем стать центром опухолевых преобразований.
Стресс/травмирование нарушает функции митохондрий, что вызывает экспрессию генов клеточного роста и восстановления ткани (GR-гены). В результате этого происходит увеличение производства факторов роста и репарации с целью заживления травмы. Кроме того, эти гены не только стимулируют производство клеток, но и подавляют апоптоз *. Таким образом, баланс апоптоз:пролиферация сдвигается в сторону пролиферации.
Выглядит так, что продолжительная невозможность перенести высокую стрессовую нагрузку вынуждает чувствительные к нему клетки увеличить своё количество, чтобы распределить фактор стресса на бо́льшее число клеток. Подобные явления происходят при систематической интенсивной физической нагрузке, которая стимулирует увеличение числа мышечных клеток и наращивание мышечной массы. Таким образом, в некоторых точках чувствительных к раздражителям ткани будет наблюдаться значительное увеличение числа нормальных клеток (гиперплазия), что является естественной тканевой реакцией в ответ на внешние раздражители.
Гиперплазия молочной железы очень распространена, и к 70-летнему возрасту число женщин с гиперплазией достигает 69 % *. Широкая распространённость гиперплазии, однако, не говорит о том, что это нормально. Точно так же, как не говорит об их нормальности распространённость атеросклероза, гипертензии, ожирения, остеопороза и диабета.
Если возмущение ткани не ослабевает, а возможности пролиферации ограничены или исчерпаны, ответной реакцией может быть замена в ткани более чувствительных к данному раздражителю типов клеток менее чувствительными типами нормальных клеток того же самого органа (метаплазия). В этом случае клетки, типичные для данного вида ткани, замещаются клетками атипичными. Яркий тому пример – замена в лёгких у заядлых курильщиков клеток реснитчатого эпителия плоскими клетками. Аналогично происходит замена плоскими клетками чувствительных к эстрадиолу клеток эпителия протоков и долек молочной железы, происходящая на более продвинутой стадии опухолеобразования.
Микроскопические очаги гиперплазии, строго говоря, не опасны, и при устранении провоцирующих их условий могут со временем исчезать. Однако они временно изменяют структуру ткани в месте своего появления, увеличивая риск развития опухоли. При определённых условиях гиперплазия может запустить ряд перекрёстных и параллельно протекающих событий, продвигающих опухолевый процесс *. Разрастающиеся клетки могут терять свойства нормальных специализированных клеток, и образовывать атипичную гиперплазию. Которая с течением времени, в зависимости от обстоятельств, может либо нормализоваться, либо стать предшественником опухоли – доброкачественной или злокачественной *.
Пролиферация, в конечном итоге порождающая опухоль, является, таким образом, естественной реакцией на травмирующий фактор. Она стимулируется теми же сигналами, которые возникают при травме и воспалении, и направлена на восстановление повреждённой ткани. Проблемой здесь является хронический характер пролиферации в попытке залечить не существующую на самом деле незаживающую рану.
Чрезмерная пролиферация клеток создаёт неблагоприятные условия для существования клеток. Концентрация питательных веществ снижается, гипоксия и кислотность среды повышаются, это повышает риск повреждения ДНК и снижает её способность к восстановлению *. Однако неуправляемой пролиферации недостаточно, чтобы ткань стала злокачественной; простым примером незлокачественной пролиферации, вызываемая канцерогенным агентом – папилломавирусом, может служить бородавка. Для злокачественной опухоли требуется нарушение многих других функций и процессов, качественное перерождение клеток.
Таким образом, канцерогенное влияние хронического стресса на ткань можно представить следующим образом. Реагируя на травматические (канцерогенные) сигналы, клетки запускают серию естественных реакций, связанных с заживлением травмы. Эти реакции включает в себя активацию генов роста и репарации (онкогенов), выделение цитокинов, производство различных факторов роста, деление и дифференцировку местных и привлечённых стволовых клеток и перестройку тканей для обеспечения их жизнедеятельности.
И при травмах, и при опухолях мы имеем дело со схожими процессами деления клеток с целью восстановления ткани. Только в первом случае оно действительно необходимо, а во втором оно является ложной необходимостью. Другими словами, в первом случае временное и контролируемое подобие рака приводит к исцелению травмы, а во втором постоянная и неконтролируемая травма приводит к настоящему раку.
Действительно, в случае острой травмы процесс восстановления повреждённой ткани, в конце концов, завершается успехом. В месте травмы/заживления недифференцированные клетки подвергаются окончательной дифференцировке * или апоптозу *, а все нефункциональные клетки и молекулы удаляются. В случае же хронической травматической сигнализации, усилия по восстановлению ткани не прекращаются. Если сигналы об успехах долгое время не приходят, то клетки понимают это так, что для разрешения проблемы имеющихся у них фенотипических возможностей не хватает.
Исчерпание возможности преодолеть существующие вызовы более простыми, количественными путями, склоняет клетки решать их путём качественных изменений. Эти изменения сопровождаются геномными и метаболическими модификациями внутри самих клеток, а также реорганизацией окружающей их ткани и перепрограммированием поведения окружающих их клеток *.
Усиление гликолиза. Стрессовая нагрузка, вызываемая патогенами, непосредственно подавляет работу митохондрий – клеточных органелл. Кроме того, она увеличивает местный воспалительный потенциал, а воспаление снижает уровень кислорода и увеличивает уровень свободных радикалов.
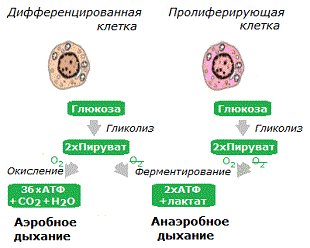
Кислород используется митохондриями клеток для производства энергии из пирувата (пировиноградной кислоты) путём электрохимического процесса, который называется окислительное фосфорилирование (аэробное дыхание). При дефиците кислорода клетки не могут получать достаточного количества энергии из митохондрий. Поэтому в дополнение к окислительному фосфорилированию им приходится задействовать альтернативный механизм выработки энергии – ферментирование пирувата вне митохондрий, что не требует наличия кислорода (анаэробное дыхание).
Анаэробный способ производства энергии в несколько раз менее эффективный, чем аэробный, поэтому для получения сопоставимого количества энергии он требует многократного увеличения поступления в клетки глюкозы и усиления внутриклеточного гликолиза. С другой стороны, анаэробное дыхание требует для извлечения энергии из пирувата всего лишь одной химической реакции, в то время как аэробное дыхание – нескольких (цикл Кребса). Т.о., хотя гликолитические клетки производят в несколько раз меньше молекул АТФ из одной молекулы глюкозы, они могут производить АТФ почти в сто раз быстрее и проще всего лишь за счёт увеличения потребления глюкозы *.
Хроническое усиление гликолиза и смещение производства энергии от митохондриального к ферментативному влечёт за собой драматические последствия. Митохондриальное производство энергии требуется для дифференцировки клеток, поэтому его падение вызывает потерю дифференцировки новых клеток и неограниченную пролиферацию *. С другой стороны, ферментативное производство энергии требуется для деления клеток, поэтому его рост также способствует пролиферации.
Некоторые ферменты, участвующие в гликолизе, такие как гексокиназа, являются важными регуляторами апоптоза и транскрипции генов *. Активация гексокиназы приводит к тому, что она перемещается из цитоплазмы в митохондриальные мембраны, где взаимодействует с несколькими ключевыми компонентами митохондриально-зависимого апоптоза и подавляет их *. Таким образом, гликолитические (в том числе раковые) клетки могут приобрести преимущество в выживании над негликолитическими.
Усиление гликолиза увеличивает концентрацию пирувата внутри клетки. В здоровой клетке этот пируват поступает внутрь митохондрий для производства энергии, метаболируясь до воды и углекислого газа. Но если митохондрии не могут этого делать, например, из-за недостатка кислорода, или по другим причинам, то избыточный пируват накапливается внутри клетки. Это увеличивает активность фермента под названием лактатдегидрогеназа, который метаболирует пируват в лактат (молочную кислоту), который затем выводится из клетки во внеклеточное пространство.
Закисление внеклеточной среды. Метаболитами аэробного дыхания являются вода и углекислый газ, которые при соединении образуют угольную кислоту, имеющую слабый кислотный показатель (pH 3,68). А метаболитом анаэробного дыхания является молочная кислота, которая имеет на порядок более сильный кислотный показатель (pH 2,44). Кроме того, при одном и том же уровне производства энергии, молочной кислоты при анаэробном дыхании производится во много раз больше, чем угольной кислоты при аэробном дыхании. И чтобы сохранить адекватную внутриклеточную кислотность, требуется их эффективное выведение из клетки. Удаление молочной кислоты из клетки обычно не представляет сложности, чего нельзя сказать об её удалении из межклеточного пространства. При накоплении молочной кислоты повышается кислотность в тканях.
Повышение уровня кислотности в растворе приводит к падению уровня в нём кислорода, по причине того, что щелочная среда способствует насыщению раствора кислородом, тогда как кислотная среда вытесняет кислород. Когда клетки усиливают ферментативное дыхание, то появляется избыток токсичных метаболитов, в том числе молочной кислоты. Это повышает межклеточную кислотность, которая не позволяет поднять уровень кислорода в клеточном окружении до достаточного уровня. А хронический недостаток кислорода делает снижает функциональность митохондрий и склоняет клетки и далее широко использовать гликолиз.
Кроме того, закисление внеклеточной среды склоняет клетки к защелачиванию внутриклеточной среды. А это, в свою очередь, благоприятствует делению клеток. Например, снижение внутриклеточной кислотности наблюдается при митозе *, потому что более щелочная среда внутри клетки активирует гены, связанные с производством белков для создания новой клетки *.
Т.о., усиление бескислородного дыхания способствует закислению и дестабилизации микроокружения ткани, облегчая путь к образованию опухоли * *. Хронического кислородного дефицита может оказаться достаточно, чтобы нормальная клетка необратимо переключила свой механизм производства энергии, и трансформировалась в раковую клетку. Впервые это продемонстрировал Отто Варбург (Otto Warburg) около ста лет тому назад, что дало ему основание заключить: "рак возникает всякий раз, когда любая клетка лишена 60 % своих потребностей в кислороде... основной причиной рака является замена дыхания кислородом нормальными клетками ферментацией сахара" *.
Нарушение функций ферментов. В каждом организме, и в каждой его клетке, образующей собственную систему, одновременно протекает огромное количество биохимических реакций, называемых обменом веществ, или метаболизмом. Степень интенсивности каждой из этих реакций требует индивидуального управления, потому что все они сложным образом взаимосвязаны.
Чтобы обеспечить разумную управляемость метаболизмом, живые организмы используют сложные белковые структуры, которые называются ферменты (энзимы). Ферменты в сотни раз ускоряют те или иные химические реакции в клетке, а некоторые из них этих реакций лишь благодаря ферментам становятся принципиально возможными. Белковые ферменты отличаются от других химических катализаторов своей необычайной эффективностью и крайне высокой специфичностью к какой-то определённой реакции. Такое решение позволяет поставлять энергию и сырьё для протекания каждого специфического процесса лишь реагирующей молекуле *. А не поставлять их всей системе, как это происходило бы в пробирке. Такое принципиальное различие между течением химических реакций и отличает живую природу от неживой.
Именно ферменты определяют, каким метаболическим путём будут происходить биохимические реакции. Нарушение тонкой и сбалансированной функции ферментов приводит к биохимической анархии и, как следствие, к самым разнообразным заболеваниям.
Усиление гликолиза и наводнение ткани конечными продуктами его метаболизма не только увеличивают воспаление, но и изменяют состав и кислотность химической среды. Ввиду того, что каждый фермент проявляет активность в довольно узком диапазоне температуры и кислотности, работа ферментной системы дезорганизуется, что способствует выходу из-под контроля биохимических процессов в ткани.
Нарушение функций митохондрий. Увеличивающееся с каждым годом число фактов склоняет к выводу, что рак является больше метаболическим, чем генетическим заболеванием. Что на самом деле геномные мутации не являются первопричиной рака. Они не обязуют злокачественное перерождение клеток, а лишь способствуют ему и сопровождают его.
Убедительные доказательства тому предоставляют многие лабораторные эксперименты, которые противоречат господствующей теории канцерогенеза. Например, существуют негенотоксичные канцерогены, способные вызывать рак без изменений ДНК (такие как хлороформ и дихлорбензол) *. Злокачественную опухоль без каких либо мутаций ДНК можно также спровоцировать путём введения в ткани организма немутагенных чужеродных материалов, которые нарушают клеточное взаимодействие *.
Замена ядра нормальной зародышевой клетки ядром раковой клетки (с мутировавшими генами) не делает её раковой; из такой клетки впоследствии рождаются нормальные организмы *. И наоборот, замена ядра раковой клетки ядром здоровой клетки (без мутаций) по-прежнему оставляет её раковой. Из ядер раковых клеток опухолей головного мозга получались здоровые клоны мышиных эмбрионов *. Из раковых клеток, введённых в ранние эмбрионы, формируются здоровые ткани и органы *. Органеллы клетки, а не её ядро, определяет злокачественное состояние клетки * * *.
С другой стороны, внедрение функциональных митохондрий в раковую клетку может обратить вспять её различные злокачественные характеристики, включая пролиферацию клеток, жизнеспособность в условиях гипоксии, антиапоптотические свойства, устойчивость к противораковым препаратам, инвазии и колониеобразование, а также рост опухоли *.
Многие другие подобные эксперименты не оставляют камня на камне от утверждения, что рак начинается с повреждений ядерной ДНК клетки. Злокачественной делает клетку не само по себе наличие мутаций или экспрессия онкогенов. Решающую роль играет состояние здоровья её внутренней среды, включая функциональность митохондрий. Даже генетические мутации, связанные со злокачественностью, не могут сделать клетку злокачественной до тех пор, пока митохондрии и другие органеллы клеток функционируют адекватно.
И действительно, многочисленные данные указывают на то, что при некоторых формах рака отсутствуют хромосомные и генные мутации * * *, а в других случаях были обнаружены изменения в характере метилирования ДНК, но не в её последовательности *. В то же время появление злокачественных новообразований и аэробного гликолиза следует за потерей митохондриальной функции *. Кроме того, все относящиеся к клетке признаки рака могут быть связаны с нарушением функций митохондрий и энергетического обмена *.
Вызванная различными причинами хроническая гипоксия может привести к повреждению и разрушению белков, необходимых для нормального функционирования митохондрий. Гипоксия увеличивает производство свободных радикалов (оксидантов), но это не единственная причина окислительного стресса. Много свободных радикалов образуется в процессе митохондриального дыхания, и существует много факторов его деградации. Хотя свободные радикалы являются важными сигнальными молекулами, их чрезмерная концентрация разрушает любые белковые структуры.
Внутри митохондрий свободные радикалы не только повреждают митохондриальную ДНК (мтДНК), увеличивая риск мутаций; они также вызывают повреждение внутренней митохондриальной мембраны и утечку кальция из митохондрий в цитозоль *. Когда удаление сильно повреждённых митохондрий адекватно не осуществляется, происходит утечка их содержимого в цитозоль и далее – во внеклеточную среду. Поскольку мДНК не соответствует яДНК, белки митохондрий распознаются как чужеродные, что порождает и усиливает воспалительный процесс *. Хроническое воспаление уже само по себе увеличивает генетическую нестабильность ядерной ДНК * и нарушение митохондриальной функции *. В результате оба эти процесса (производство свободных радикалов и митохондриальная дисфункция) взаимно подпитывают друг друга, создавая порочный замкнутый круг.
Митохондриальные ДНК более чувствительны к окислительному стрессу, чем ядерные ДНК. Из-за этого в раковых клетках наблюдается высокий уровень мутаций мтДНК *. Геном митохондрий кодирует множество важных компонентов белков дыхательной цепи, поэтому мутации в мтДНК могут негативно повлиять на адекватность клеточного дыхания, стимулируя ферментирование пирувата *. Количество копий мтДНК также снижается, и может упасть ниже критического уровня, что способствует росту и метастазированию опухолей *, в том числе молочной железы *.
Нарушение работы михондрий может вызываться не только окислительным стрессом и гипоксией, и вызванных ними мутациями митохондриальной ДНК, но и многими другими причинами. Например, естественным старением митохондрий, химикатами, радиацией, вирусами, другими канцерогенами.
Наконец, последнее, но самое важное. Митохондриальная дисфункция в значительной мере вызывается большим количеством глюкозы в крови по причине чрезмерного питания. Чтобы избавить кровь от лишних сахаров, инсулин принуждает клетки принимать глюкозу, даже если она им фактически не нужна. Сахар по своей природе липкий, и та часть сахара, которая не участвует в гликолизе, приклеивается к белкам, которые присутствуют в клетке. Например, к ферментам, что ухудшает все метаболические процессы. Прикрепление глюкозы к другим белкам также вызывает нарушение их функции. Кроме того, такие (гликированные) белки могут рассматриваться иммунной системой как чужеродный агент, повышая уровень системного воспаления.
Пока интенсивность процесса гликирования невысокая, извращённые белки успевают выводиться из организма. Но если этого не происходит, модифицированные белки накапливаются внутри клеток и в тканях организма, что влечёт за собой серьёзные последствия. Клетки пытаются избавиться от избыточной глюкозы путём её метаболирования в жирные кислоты, которые затем откладываются в запас непосредственно внутри клетки. Однако внутриклеточное накопление триглицеридов напрямую связано с повреждением митохондрий или дисфункцией окислительного фосфорилирования *.
В результате хронического стресса, митохондрии претерпевают морфологические изменения, в результате которых происходит атрофия участков, задействованных в окислительном фосфорилировании. Поскольку структура органа определяет его функцию, производство АТФ падает. Из-за нехватки энергии все процессы, требующие АТФ, замедляются. Синтез ферментов и работа мембранных транспортёров ослабляются; клетки теряют свою естественную форму, организованность и адекватную межклеточную коммуникацию.
Митохондрии посылают химические сигналы о том, что они не способны обеспечить достаточный уровень энергии, и требуется использование альтернативных путей производства энергии. В ответ на них в ядерной ДНК активируются т.н. онкогены, которые увеличивают гликолиз, способствуя тем самым злокачественному перерождению клеток *.
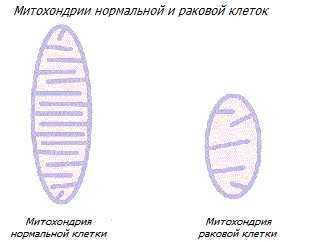
В целом, от функциональности митохондрий зависит экспрессия множества генов ядерной ДНК, которые контролируют энергетический метаболизм, супрессоры опухоли, уровни внутриклеточного кальция, лекарственную стойкость, производство свободных радикалов и многие другие гены, способные принципиально изменить поведение клетки * *.
Митохондрии также являются важным местом управления процессами аутофагии и апоптоза *. Аутофагия позволяет избавляться от плохо функционирующих клеток; они просто поедаются иммунными клетками. Апоптоз (процесс самоубийства клетки) происходит, среди прочего, в случае дефекта ядерной ДНК. Однако ухудшение функций митохондрий может привести к тому, что аномальные клетки с мутировавшей ДНК будут оставаться в живых. И порождать такое же аномальное потомство * с таким же высоким уровнем свободных радикалов *, которые будут вызывать новые злокачественные мутации, и так далее по замкнутому кругу.
Ослабление митохондриального дыхания и усиление гликолиза снижает дифференцировку клетки и стимулирует её деление. Кроме того, гены и сигнальные пути, участвующие в усилении гликолиза, сами по себе являются антиапоптотическими *, и будут усиливать подавление апоптоза в гликолитических клетках. Интересно, что общее количество митохондрий в трансформировавшихся клетках может даже увеличиваться, однако их функциональность при этом всё равно остаётся низкой.
Недостаток энергии приводит к снижению производства ферментов, которые восстанавливают и ремонтируют повреждённые молекулы ДНК, тем самым накапливая мутации. Кроме того, ослабление функций митохондрий вызывает миграцию теломеразы из митохондрий в ядро, где она усиливает теломеры ядерной ДНК, которые ограничивают число делений клетки *. Благодаря этому, гликолитическая клетка, в отличие от нормальной клетки, получает возможность делиться неограниченное число раз. Или, как часто говорят, клетка приобретает «бессмертие».
Итак, дисфункция митохондрий приводит к серьёзным нарушениям клеточного здоровья. Она является ключевым фактором злокачественной трансформации клетки, поскольку обращает её к ферментативному производству энергии. Не все канцерогенные факторы вызывают мутирование генов, однако почти все они так или иначе ухудшают работу митохондрий. Похоже, что именно нарушение работы митохондрий является общей биологической основой всего разнообразия раковых опухолей.
Падение трансмембранного потенциала. Нехватка клеточной энергии ухудшает работу ионных насосов, которые поддерживают необходимую концентрацию тех или иных веществ внутри клетки. Из-за этого нарушается соотношение внеклеточных и внутриклеточных ионов. Количество отрицательно заряженных ионов внутри клетки падает, приводя к снижению электрического потенциала на клеточной мембране, который называется трансмембранный потенциал (Em).
Клетки являются не только химической, но и электрической машиной. Биохимию процессов в живой клетке нельзя рассматривать в отрыве от биоэлектрических сигналов. Потоки ионов, градиенты напряжения (трансмембранные или трансэпителиальные) и электрические поля являются важными регуляторами поведения клетки и организации ткани, контролируя количество клеток (пролиферация и апоптоз), положение клеток (миграция и ориентация) и идентичность клеток (траектория дифференцировки) *.
Трансмембранный потенциал считается ключевым параметром, опосредующим контроль пролиферации, состояние дифференцировки и злокачественное перерождение клеток * *. В состоянии покоя зрелые, дифференцированные клетки имеют более высокие показатели Em по сравнению с их же показателем Em в состоянии деления, а также по сравнению с недифференцированными клетками, такими как эмбриональные, стволовые или раковые. Падение Em (деполяризация) запускает ряд изменений, связанных с транскрипцией генов, важных для фенотипических перерождений нормальной клетки в раковую *.
С этой точки зрения рак можно рассматривать как нарушение регуляции информационного поля, которое управляет активностью отдельных клеток в направлении нормальной функции *.
Потеря межклеточной коммуникации. Увеличение концентрации продуктов метаболизма гликолитических клеток (молочная и янтарная кислоты) за счёт повышения кислотности ткани поддерживает хроническое местное воспаление.
Воспаление увеличивает количество белков и полисахаридов, составляющих внеклеточный матрикс (ВКМ, ECM) – таких, как коллаген и гиалуроновая кислота. ВКМ служит микрокаркасом, позволяющим клеткам крепится к нему и формировать упругий объём ткани, а не растекаться, как кисель. Однако избыточное накопление внеклеточного матрикса затрудняет транспорт сигнальных молекул соседних и отдалённых клеток. Усиление адгезии эпителиальных клеток к матриксу снижает их чувствительность к межклеточным сигналам и позволяет обойти многие из нормальных путей подавления роста *. Это хорошо при остром воспалении, когда клеткам нужно срочно делиться, чтобы восстанавливать погибшие клетки. Но плохо при хроническом воспалении, которое может способствовать развитию опухоли.
Эпителиальные клетки покрыты т.н. гликокаликсом. Это похожий на мех тонкий слой внедрённых в клетку олигосахаридов, полисахаридов, гликолипидов и гликопротеинов, а также молекул клеточной адгезии – иммуноглобулинов, интегринов, кадгеринов, селектинов. Гликокаликс соединяет клетку с внеклеточным матриксом и влияет на способность клеток образовывать между собой каналы химической или электрической сигнализации. Таким образом, гликокаликс сам по себе влияет на то, как информация фильтруется и пересылается от одной клетки к другой.
Избыточная гликопротеиновая слизь может разъедаться протеолитическими ферментами или слабыми щелочами. В нормальных тканях, имеющих слегка щелочной показатель, а тем более при достаточном уровне ферментов, слой гликопротеина тонкий, и обеспечивает прямую клеточную коммуникацию при помощи молекул клеточной адгезии и т.н. «щелевых контактов». Стремлением клетки по умолчанию является деление, а не покой *, как это принято считать до сих пор. Однако нормальная разделившаяся клетка многоклеточного организма, получая сигналы тесного контакта с соседними дифференцированными клетками, понимает, что расти ей дальше некуда, и останавливает своё дальнейшее деление.
В очагах гиперплазии может наблюдаться иная картина. Агрессивная внеклеточная среда заставляет клетки защищаться от неё, в том числе, за счёт наращивания своего гликокаликса. Этому способствует повышенная кислотность межклеточного пространства, который ухудшает работу протеолитических ферментов, способных растворять избыток гликокаликса. Накопление гликопротеина и белков внеклеточного матрикса в межклеточном пространстве ухудшает непосредственную передачу химических сигналов между клетками через специальные связывающие их каналы. Тесные контактные сигналы, сдерживавшие деление клеток, ослабляются. Таким образом, клетки получают дополнительный стимул для своего роста.
Увеличение количества иммунных и других привлечённых клеток в месте воспаления также может негативно сказываться на сигнальном взаимодействии эпителиальных клеток молочной железы.
Длительное ухудшение межклеточной сигнализации влияет на генетические механизмы клеток в очаге гиперплазии *. Благодаря генетическому и эпигенетическому влиянию её микросреды, онкогены получают возможность преобразовывать фенотип клеток в злокачественный, при котором теряются контроль роста, дифференцировки и апоптоза.
Всё это выглядит так, будто трансформирующаяся клетка возвращается в своё до-коллективное прошлое. С потерей взаимодействия с другими клетками теряется выгода жизни в клеточном коллективе, тогда как эгоизм может обеспечить клетке более выгодные условия для выживания.
Фактически, в условиях высокой кислотности и недостатка кислорода клетки примитивизируются и возвращаются к своему первобытному фенотипу, который существовал в до-кислородные, до-многоклеточные времена эволюции.
Потеря дифференцировки. Дифференцировка подразумевает приобретение незрелой клеткой определённых структурных и функциональных характеристик, которые позволяют ей выполнять свою специализированную задачу в многоклеточном сообществе *.
Этот процесс можно сравнить с человеческим этапом «взросления». Так же, как и люди, новорожденная, незрелая клетка приобретает фенотипическую специализацию для своей службы в определённом органе и ткани. Эмбриональные клетки изначально примитивны, недифференцированы, в значительной степени анаэробны и быстро размножаются без ограничений, то время как полностью дифференцированные, специализированные клетки в нормальных тканях являются аэробными, а их деление и рост строго ограничены *.
По мере роста эмбриона, эмбриональные клетки претерпевают морфологические изменения, всё более отличаясь одна от другой, чтобы формировать определённые органы нового тела. Очень малая часть из них так и остаются в слабодифференцированном состоянии – это так называемые стволовые клетки того или иного органа. Находясь в укромным уголках, в т.н. нишах, под защитой плотной сети внеклеточного матрикса, стволовая клетка выполняет роль пчелиной матки в улье, по необходимости производя на свет свои новые клоны. В нише есть место только для одной клетки, и после деления одна из дочерних клеток покидает нишу и мигрирует в то место, откуда поступил заказ. Там она фиксируется, приобретает свою функциональность и приступает к своим обязанностям.
Формирование специфических навыков клетки происходит путём изменения экспрессии её генов под влиянием общих и местных сигналов. На рисунке ниже можно видеть, как из одной стволовой клетки путем последовательной дифференцировки появляются специализированные иммунные клетки.
Уплотнение внеклеточного матрикса затрудняет общение между клетками и вызывает пробуксовывание механизма их взаимного контроля *. Ситуация усугубляется накоплением токсинов внутри клеток. Всё это нарушает механизм последовательной экспрессии генов, обеспечивающих полноценное созревание клеток. В очагах гипер- и метаплазии растёт количество клеток со сниженной (в различной степени) дифференцировкой, и степень клеточной дифференцировки можно использовать для оценки прогрессирования рака.
Из-за незавершённости созревания эпителиальной клетки, она недостаточно хорошо выполняет свою функциональную роль в предназначенном для неё органе. Это может стимулировать деление клеток, чтобы попытаться компенсировать низкую эффективность работников увеличением их количества.
Неполноценность развития структур клетки ухудшает работу и всех остальных её функций, в том числе и обеспечивающих местный тканевый контроль над её размножением. Эпителиальные клетки очень быстро обновляются – в течение нескольких дней, максимум – недель, и неполноценные клетки могут очень быстро увеличивать своё количество.
Дальнейшая примитивизация, игнорирование командных требований и, в конце концов, неуправляемость отдельных клеток приводит к тому, что они начинают уподобляться одноклеточным паразитам. Иначе говоря, клетки, потерявшие дифференцировку (примитивизированные клетки), несмотря на многоклеточный генотип, приобретают одноклеточный фенотип. Такие клетки или очень плохо, или вовсе не выполняют свою общественную функцию, однако активно потребляют ресурсы, отравляют окружение и усиленно размножаются.
До определённого предела окружение нормальных клеток всё ещё способно обеспечивать примитизированным клеткам достаточный уровень сигналов, удерживающих их от брутально асоциального поведения. И заставляющих их подчиняться командам апоптоза, управления делением и дифференцировкой. Однако постепенное увеличение размеров узлов гиперплазии в молочной железе, или слияние близкорасположенных узлов гиперплазии, всё более ослабляет эти сдерживающие сигналы.
Если нормальная стволовая эпителиальная клетка молочной железы после своего деления, подчиняясь внешним сигналам, мигрирует на место замещения погибшей клетки, то примитизированная клетка, глухая к внешним командам, может переноситься туда, где в ней нет необходимости. Или оставаться на месте, формируя местные скопления себе подобных (маммосферы). При высоком уровне эстрогена в ткани или других условиях, свёртываемость крови повышается, и фибрин, обволакивая такие скопления, делает распознавание и уничтожение нефункциональных клеток иммунными клетками-киллерами всё более затруднительным.
Хроническое уплотнение и неорганизованность внеклеточного матрикса порождает множество опухолеобразующих событий * *. Клетки, взаимодействующие с более жёстким внеклеточным матриксом, сильнее пролиферируют в ответ на факторы роста *. Связывание клеток с внеклеточным матриксом может подавлять активность многих опухолевых супрессоров, удерживающих клетку в состоянии клеточного покоя, снимая с неё ограничения на клеточное деление *. Кроме того, усиление адгезии к внеклеточному матриксу прямо или косвенно ухудшает функцию некоторых опухолевых супрессоров, надзирающих за контрольными точками клеточного цикла *. По этой причине нарушается механизм апоптоза при ошибках во время деления клетки, и дефектные клетки получают больше шансов производить дефектное потомство.
Постепенно разгоняется и усугубляется цикл всех рассмотренных выше взаимосвязанных явлений: воспаление; фиброз; дефицит кислорода; рост доли гликолиза в клеточной энергетике и закисление клеточного окружения; дезорганизация работы ферментов; потеря взаимной клеточной регулировки; неуправляемое деление; недостаточная дифференцировка клеток; снижение функций митохондрий, влекущее генетические мутации и негативный эволюционный отбор. Этот процесс не является однократным, а движется разветвлёнными замкнутыми петлями, раз за разом усиливаясь и углубляясь, а временами наоборот – ослабляясь.
Когда компенсаторные механизмы не справляются с растущими вызовами, биологические процессы в ткани начинают выходят из-под контроля.
Хроническое воспаление. Любая рана, как острая, так и хроническая, запускает естественную реакцию регенерации повреждённой ткани *. При механическом повреждении ткани самой первой фазой ремонта является гемостаз. При этом кровеносные сосуды сужаются, а тромбоциты, контактируя с повреждёнными клетками кровеносных сосудов, формируют сгустки крови (тромбы). При помощи тромбов предотвращается потеря крови и образуется временный физический барьер между местом повреждения и неповреждённой тканью.
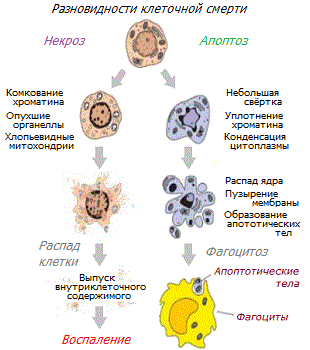
Повреждения или стресс могут быть вызваны другими причинами, кроме грубой физической травмы, например, инфекцией. В этом случае гибель клеток организма может происходить без кровопотери.
Практически сразу же после гемостаза наступает следующая фаза ремонта – воспаление. Повреждение клеток сопровождается их механическим разрушением или гибелью путём некроза. При некрозе содержимое мёртвых клеток изливается в межклеточное пространство, вызывая воспаление. Воспалительная реакция сопровождается такими местными признаками, как отёк, покраснение, тепло и боль.
Кровеносные сосуды в месте травмы расширяются, а их эндотелиальные клетки активируются. Расстояние между ними увеличивается, а скорость потока крови замедляется. Благодаря этому сквозь эндотелиальный слой в ткани просачиваются сигнальные молекулы и иммунные клетки.
Иммунные клетки первой линии обороны – лейкоциты (белые кровяные тельца) поглощают и удаляют чужеродные микроорганизмы, а натуральные киллеры – мёртвые и повреждённые клетки и их фрагменты *. Повреждённые эпителиальные и эндотелиальные клетки и фибробласты выпускают провоспалительные молекулы (цитокины и хемокины), которые призывают в место воспаления и активируют здесь лейкоциты (нейтрофилы, макрофаги, и эозинофилы), лимфоциты (Т-клетки, В-клетки) и клетки кровеносных сосудов *.
Химические сигналы травмированной ткани усиливают экспрессию генов, связанных с ростом клеток. Накапливающиеся в месте травмы тучные клетки, Т-клетки, макрофаги и фибробласты выделяют факторы роста и репарации, способствующие делению клеток и восстановлению травмированной ткани. Это, например, трансформирующий фактор роста (TGF-β), тромбоцитарный фактор роста (PDGF), фактор роста фибробластов (FGF) и эпидермальный фактор роста (EGF). Примечательно, что те же самые гены и факторы роста способствуют появлению и продвижению рака.
Тромбы, появившиеся вследствие кровоизлияния, ухудшают движение жидкости и доставку кислорода. Это увеличивает концентрацию вызванного гипоксией фактора роста (HIF-1α), что дополнительно стимулирует клетки к делению. При этом временный недостаток кислорода не затрудняет процесс деления клеток, которые используют гликолизное производство энергии.
После наспех сделанного ограждения ремонтной зоны и воспаления наступает следующая фаза ремонта – пролиферация.
Внутри слоя раны макрофаги стимулируют синтез фибробластами молекул внеклеточного матрикса (ECM) – коллагена и глюкозамина, которые создают более надёжную и продолжительную изоляцию места восстановления повреждённой ткани. Вследствие этого место травмы уплотняется, а давление внутри него увеличивается.
Избыточное накопление привлечённых клеток и соединительной ткани (фиброз) ухудшает перемещение специальных сигнальных белков – кейлонов, которые вырабатываются зрелыми клетками. Кейлоны блокируют участок ДНК, запускающий процесс деления (митоз), поэтому их истощение дополнительно ослабляет блокировку процесса деления клеток ткани. Гормоны также могут влиять на скорость роста клеток: эстроген стимулирует пролиферацию ткани молочной железы, тогда как андроген подавляет её *.
Стимулируемые факторами роста, эпителиальные клетки активно делятся и реставрируют повреждённые слизистые оболочки. Разрастаясь, они двигаются по поверхности повреждения от края к центру, и встретившись, останавливают своё деление из-за действия контактных сигналов. Активированные фибробласты (миофибробласты) стимулируют стягивание краёв раны; повреждённая ткань замещается соединительной, образуя рубцы. А эндотелиальные клетки формируют новые кровеносные и лимфатические сосуды, которые обеспечивают приток кислорода и оборот веществ, необходимых для этих процессов. Всё вместе, это способствует быстрой реставрации ткани травмированного места.
Если источника травмы больше нет, то по завершению фазы пролиферации экспрессия онкогенов (генов роста и репарации) прекращается, и начинается экспрессия генов-супрессоров опухоли. Наступает последняя фаза ремонта – ремоделирование и созревание, в ходе которой в месте травмы воспалительные клетки отзываются, новосозданные клетки окончательно дифференцируются, процессы растворения внеклеточного матрикса начинают превалировать над процессами его синтеза, излишки коллагена и кровеносных сосудов рассасываются, а рубцовая ткань наращивает прочность.
В ранее повреждённых тканях восстанавливаются нормальная организация волокон, кровеносное обеспечение и отток лимфы, нормализуется плотность ткани. Эта фаза ремонта наступает примерно через 3-4 недели после острого травмирования, и обычно длится до 2 лет. Тем не менее, до первозданного вида ткань обычно так и не восстанавливается, и оставшиеся шрамы могут не рассосаться до конца жизни.
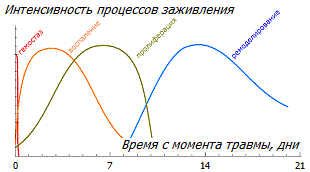
Заживление характеризуется строгой последовательностью точно запрограммированных биологических процессов. Все четыре фазы и их физиологические функции должны происходить в определённое время и в течение определённого периода с оптимальной интенсивностью. Если этот процесс протекает без сбоев, как описано выше, то в этом случае период воспаления и производства факторов роста длится ограниченное время, после чего наступает непродолжительный противо
Однако если заживление не произошло должным образом, или источник травмы не исчезает, или травмирование ткани происходит чаще, чем завершается процесс её восстановления, то очерёдность физиологических процессов репарации сбивается *. И если при естественном течении процесса, по окончании регенерации для участвующих в ней клеток звучит команда «отбой», и они прекращают свою активность, то при спутанности этапов процесса наступает сигнальный хаос.
В этом случае сигналы воспалительного и пролиферативного этапов заживления могут налагаться один на другой. Процесс восстановления ткани не может понять, когда именно ему следует прекратиться. Он будет затягиваться, создавая избыточное накопление клеток. И если этап ремоделирования так и не наступает, процесс может надолго зависнуть в этой неопределённости.
Если заживление не происходит, то воспаление и фиброз приобретают непреходящий характер, а производство факторов роста продолжается, стимулируя постоянное деление склонных к гликолизу клеток, и создавая условия для образования опухоли. Масса клеток увеличивается быстрее, чем их снабжение, и некоторые из них гибнут путём некроза, поддерживая и усиливая воспаление *. Этот замкнутый цикл будет поддерживаться либо до полного заживления ткани *, либо до полного истощения организма.
Аналогичные, хотя и менее наглядные процессы будут протекать при долговременном воздействии любых других рассмотренных ранее канцерогенных факторов, которые способны создавать фиброз.
Неадекватность аутофагии. Аутофагия (в переводе с греческого – «самопоедание») – это естественный процесс очищения клеток от внутренних запасов, от избыточных или нежелательных элементов внутри клеток; а также процесс избавления от слабых, повреждённых или нефункциональных клеток. Это своего рода каннибализм, направленный на самого себя. Нефункциональные белки организма утилизируются и используются повторно внутри того же самого организма.
Аутофагия запускается и адекватно работает лишь тогда, когда клетка испытывает временный недостаток энергии, и ей приходится обращаться к внутренним источникам. Таким образом, длительные перерывы в питании (суточные посты, 12-часовое ночное воздержание и т.п.) или ограничение поступления калорий (низкокалорийное питание, миметики калорий и т.п.) способствуют внутреннему очищению клеток, а также удалению раковых клеток.
И наоборот, высококалорийное питание и высокий уровень циркулирующих питательных веществ (глюкозы, аминокислот, жирных кислот) способствуют злокачественному перерождению клеток и продвижению рака. Когда организм получает достаточно пищи извне, то ему незачем прибегать к изысканию внутренних возможностей.
С другой стороны, чрезмерная интенсификация аутофагии может привести к тому, что вполне функциональные клетки будут уничтожаться, а их место занимать соединительная ткань.
Расстройство аутофагии не обязательно сопровождает раковый процесс, но оказывает на него достаточно существенное негативное влияние.
Формирование предраковой ниши. При хроническом воспалении происходит местное изменение структуры ткани. Как уже говорилось, хроническая рана характеризуется большим количеством грануляционной ткани, которая состоит из сети капилляров и внеклеточного матрикса, и которая обогащена фибробластами, воспалительными клетками, эндотелиальными клетками, перицитами и миофибробластами. Привлечённые в место воспаления воспалительные клетки, такие как макрофаги, производят большое количество факторов роста, цитокинов и свободных радикалов.
Хотя свободные радикалы – это эффективный способ уничтожения острых инфекций, непрерывное активирование макрофагов создаёт угрозу повреждения тканей * и генетических мутаций *. Некоторые цитокины могут также защищать трансформирующиеся клетки от апоптоза путём подавления гена р53 *. Кроме того, воспалительные клетки могут помогать трансформирующимся клеткам уклоняться от иммунной реакции * *.
Агрессивный конечный продукт анаэробного дыхания – молочная кислота (лактат), вместе с вызванным гипоксией фактором роста стимулируют выработку внеклеточного матрикса. Хроническое чрезмерное производство коллагена, протеогликанов и фибронектина с одной стороны, и ослабление процесса разрушения внеклеточного матрикса – с другой стороны, приводит к его накоплению. Избыток внеклеточного матрикса, в свою очередь, способствует росту клеток.
Когда процессы деления клеток обгоняют процессы их дифференцировки, происходит местное накопление недифференцированных клеток. Недифференцированные клетки увеличивают производство факторов роста, что могло бы помочь заживлению травмы, но при хронической травме/воспалении это способствует образованию опухоли. С другой стороны, сигналы прекращения деления сильнее исходят из зрелых клеток, поэтому обогащение предраковой ниши незрелыми клетками усиливает канцерогенную тенденцию. Благодаря этому возникает самоподдерживающийся цикл неуправляемого размножения незрелых (трансформирующихся, опухолеобразующих, а далее – раковых) клеток.
Неисчерпаемым источником обновления клеток нормальной ткани являются стволовые клетки, которые укрываются в густой сети внеклеточного матрикса подобно тому, как мальки рыб укрываются в гуще водорослей. Внеклеточный матрикс создаёт не только надёжную ограду для ниши нормальной стволовой клетки. Он обеспечивает ей протекание биохимических процессов, способствующих защите, выживанию и дальнейшему пребыванию в недифференцированном состоянии.
Аналогично, хронический, аномально высокий фиброз, связанный с воспалением, увеличивает объём и плотность матрикса, который формирует такую же тихую гавань, укрывающую недифференцированные и мутировавшие клетки *.
Таким образом, благодаря двум этим процессам – воспалению и вызванному ним фиброзу, образуется специфическая местная микросреда – предраковая ниша, склоняющая клетки усиливать гликолиз и деление, и снижать степень своей дифференцировки.
Нарушение морфологии. В результате описанных процессов, в очагах опухолевой трансформации клетки постепенно теряют свой нормальный вид и структуру, что можно увидеть под микроскопом. Увеличивается количество соединительной ткани, начинают наглядно проявляться структурные аномалии всего тканевого комплекса (дисплазия).
Тем не менее, лёгкая дисплазия всё ещё является обратимым состоянием. Она может не только прогрессировать, но стабилизироваться, и даже регрессировать со временем. Тяжёлая же дисплазия уже имеет мало различий с начавшейся доброкачественной или злокачественной неагрессивной опухолью.
Предопухолевые состояния встречаются очень часто. Посмертное исследование молочной железы датчанок среднего возраста, проведенное в 1987 году, показало широкое распространение у них таких заболеваний, как доброкачественная гиперплазия (55 %), атипичная гиперплазия (9 %), метаплазия (85 %), фиброаденома (23 %) *. Основная часть поражений пришлась на женщин старше 40 лет, и они, видимо, формировались в течение многих предшествовавших лет. Большинство опухолей не превышало размеры 5 мм, и основное число этих поражений не было выявлено вплоть до смерти этих женщин. За последние 33 лет после публикации этого исследования ситуация с распространённостью предопухолевых состояний, судя по статистике заболеваемости раком, только ухудшилась.
В США в те же самые годы у 50 % женщин при жизни, и у 90 % женщин посмертно, обнаруживались различные фиброзно-кистозные состояния *. Проблема разрослась до того, что из-за бурного всплеска заболеваемости прозвучали даже предложения не рассматривать фиброзно-кистозные состояния как болезнь при отсутствии атипии *. Другими словами, предлагалось снизить статус заболевания из-за невозможности справиться с его эпидемией.
Попутно заметим, что старение организма сопровождается теми же событиями – окислением тканей, снижением митохондриальных функций, скрытым хроническим общим воспалением * и фиброзом ткани во многих органах *. Поэтому любые меры, направленные на омоложение митохондрий, снижение уровня свободных радикалов, противодействие фиброзу и ослабление воспалительных сигналов в организме, потенциально могут тормозить также и процесс старения.
Генетические модификации могут сопровождать весь процесс канцерогенеза, начиная задолго до появления самой опухоли. Они являются следствием геномной неустойчивости клеток, вызванной их неблагоприятными внешними условиями, и попыткой клеток адаптироваться к этим условиям через генетические и эпигенетические изменения.
Генетические модификации могут играть важную роль в образовании и устойчивости опухоли, однако мутации на самом деле являются лишь частью проблемы, а не её центром. Во многих случаях, в опухолевых клетках не удаётся обнаружить соматические мутации, что явно не соответствует общепринятой теории. Тем не менее, в большинстве случаев злокачественный процесс заходит настолько далеко, что приводит к мутациям, в том числе в генах, которые способствуют появлению, выживанию и размножению раковых клеток (т.н. онкогенах).
Несмотря на своё название, онкогены и прото-онкогены экспрессируются не только при раке * и, как рассмотрено ранее, на начальном этапе заживления травм *, но также при беременности и эмбриональном развитии * *. А белки, экспрессируемые при помощи этих генов, временно участвуют в естественных, незлокачественных процессах.
Проблема онкогенов, таким образом, состоит не в том, что эти нужные организму гены экспрессируются в принципе. А в том, что они могут экспрессироваться бесконтрольно – в ненужное время и в ненужном месте. Адаптация к внешним условиям за счёт генетической корректировки с дальнейшим выживанием наиболее удачных вариантов – это тот самый механизм, благодаря которому происходит эволюция живой природы. Но в таких случаях, как рак, этот чудесный механизм действует губительно. Онкогены в раковых клетках экспрессируются чрезмерно, что обычно является следствием соматических мутаций.
Несмотря на то, что развитие опухоли сопровождается всё бо́льшим числом геномных изменений, нельзя утверждать, что именно они являются причиной рака. Скорее наоборот, они являются следствием этого процесса. Любая больная или аномальная клетка организма, включая раковую, будет немедленно распознана и уничтожена здоровыми иммунными клетками. Развитие опухоли возможно лишь при определённом стечении нескольких неблагоприятных факторов; одного лишь генетического фактора для этого явно недостаточно.
Подчинение микроокружения. Преодоление сдерживающего эффекта микроокружения предопухолевой ниши и подчинение его своим интересам является важным этапом развития рака. Влияние микроокружения может оказывать более сильное влияние на формирование фенотипа клетки, чем инструкции генома
*.
Даже множественные мутации единственной клетки, при её адекватном микроокружении, не приводят к образованию опухоли. Экспрессия онкогенов формирует злокачественный фенотип только в определённом контексте микросреды
*.
Например, при хроническом воспалении нарушается метилирование участков ДНК, что может либо активировать экспрессию про-опухолевых генов, либо заглушать экспрессию противо
Гликолитические клетки погружают в токсичное окружение не только себя, но другие окружающие их нормальные клетки. Гликолизное производство энергии увеличивает внеклеточную кислотность, а высокая кислотность ведёт к дефициту кислорода. Гипоксия и воспаление в предраковой нише подавляют функцию иммунного контроля, благодаря чему неполноценные клетки ускользают от своего обнаружения и уничтожения. Высокая местная плотность ткани способствует этому, потому что в этих условиях ухудшается функция иммунных Т-клеток и клеток натуральных киллеров.
В то время как в предопухолевой нише падает сигнальная связь между клетками через непосредственный контакт, увеличивается связь через экзосомы – внеклеточные везикулы (EV, extracellular vesicles). Вырабатываемые опухолеобразующими клетками экзосомы переносят некоторые типы иммунорегуляторных молекул в иммунные клетки, позволяя им уклоняться от иммунного надзора. Экзосомы также формируют злокачественные фенотипы у других эпителиальных клетках путём переноса онкогенных белков и микроРНК. Таким образом, опухолеобразующие клетки при помощи экзосом модифицируют окружающие клетки предраковой ниши, и создают удобную микросреду, которая способствует развитию опухоли *.
Часть клеток микроокружения может вырабатывать пируват из лактата, вырабатываемого гликолитическими клетками, снабжая их дефицитным сырьём *. В результате взаимодействий опухоль-хозяин, в микроокружении трансформирующейся ткани молочной железы, а в дальнейшем – в микроокружении опухоли, складывается своеобразный симбиоз органообразующих клеток различной степени дифференцировки и нормальных клеток, включая макрофаги, фибробласты, нейтрофилы, тучные клетки *… В этой сложной местной экосистеме, её клеточные и молекулярные элементы влияют на развитие и характер рака не менее, чем сами раковые клетки *.
В конечном итоге, микроокружение опухоли превращается в уникальную среду, которая управляет всеми молекулярными и клеточными событиями в вовлечённых в эту среду окружающей ткани. На этом этапе клеточных и тканевых преобразований все ранее скрытые процессы, наконец, порождают опухоль, которую мы можем так или иначе обнаружить.
Ослабление иммунного контроля. Формирующаяся опухоль под прикрытием воспаления подчиняет себе также местные иммунные клетки *.
Иммунной системе непросто распознать в неполноценных клетках свою естественную цель. Во-первых, они для неё – это всего лишь не повзрослевшие клетки собственного организма. Во-вторых, идентификация тех антигенов мутировавших клеток, которые отображаются на клеточной поверхности, затруднено из-за накопления на ней гликопротеина. Дополнительно к этому, экзосомы, выделяемые гипоксическими клетками, способны менять экспрессию поверхностных рецепторов, активирующих иммунные клетки-убийцы, и препятствовать распознанию антигена дендридными клетками. Но это лишь часть проблемы.
Повышенная плотность внеклеточного матрикса и повышенное давление внутри зоны воспаления препятствуют притоку кислорода и оттоку лактата – кислотного отхода быстро делящихся (гликолитических) клеток. Густой внеклеточный матрикс уже сам по себе затрудняет перемещение и активность, и усложняет проникновение таких противо
Повышенная кислотность микросреды опухоли может несколькими путями ослаблять иммунный надзор за опухолью. Она, например, ослабляет активность большинства ферментов, снижает насыщенность ткани кислородом и склоняет клетки к анаэробному производству энергии. Кроме того, противо
Вследствие гипоксии в воспалительной зоне происходит накопление внеклеточного аденозина, подавляющего активность Т-клеток *. Кроме того, плотный матрикс ухудшает отток конечного продукта анаэробного дыхания – лактата, который является сильным нарушителем нормальных функций Т-лимфоцитов и натуральных киллеров – клеток с высоким гликолитическим метаболизмом *.
Длительная высокая концентрация лактата переключает поведение местных макрофагов от противо
Они также способствуют привлечению и дифференцировке миелоидных клеток-супрессоров *. В свою очередь, миелоидные клетки-супрессоры сдерживают высокую активность цитотоксичных Т-клеток и клеток натуральных киллеров, способствуют ангиогенезу, а также привлекают другие подавляющие иммунитет клетки, такие как регуляторные Т-клетки *. Рассматривая очаг трансформации как место травмы и воспаления, они способствуют восстановлению повреждённой ткани путём пролиферации и ангиогенеза, т.е. фактически работают на развитие опухоли, а не против неё.
Можно сказать, что из-за неадекватного понимания ситуации и своей роли в ней, в очаге трансформации иммунные клетки могут осуществлять опеку дефектных клеток вместо их поражения. Всё это делает проблематичным уничтожение мутировавших и дефектных клеток путём стимуляции иммунной системы. Простое подстёгивание иммунных клеток даст мало пользы. В результате можно получить лишь бурную непродуктивную активность тупого исполнителя.
Иммунная функция тесно связана с материальным и энергообеспечением клеток. Эпителиальные клетки организма постоянно и очень быстро обновляются, для чего требуется достаточное количество липидов и аминокислот. Когда этот строительный материал в дефиците, активируются такие процессы, как аутофагия. При этом дефектные и плохо функционирующие клетки организма поедаются макрофагами и клетками-киллерами, и после их разборки появляются сборочные элементы для построения новых клеток. Когда же строительный материал поступает из пищи в избытке, то иммунные клетки не стимулируются на удаление дефектных клеток, включая раковые.
Злокачественная трансформация. Итак, в предраковой нише наблюдаются воспаление и отложение коллагена и других белков внеклеточного матрикса. Высокая плотность коллагена и вызванные этим высокая кислотность и недостаточное обеспечение кислородом и питательными веществами * благоприятствуют метаболическому перепрограммированию части клеток молочной железы в сторону увеличения глюколиза и глютаминолиза *. Избыток сигналов внеклеточного матрикса способствует потере дифференцировки, т.е. примитивизации клеток *; их самообновлению *; усилению гликолиза *; уклонению от апоптоза *; геномной неустойчивости * и «бессмертию» *.
Другими словами, хроническое воспаление с последующим фиброзом способствует реорганизации ткани в предраковой нише и приобретению незрелыми эпителиальными клетками всех признаков злокачественных клеток * *. Местная злокачественная трансформация клеток позволяет увеличить производство факторов роста и репарации ткани как последний шанс залечить никак не заживающую рану *. Однако результат получается совсем другим, поскольку рана не заживает, а наоборот, благодаря предпринимаемым восстановительным усилиям, только растёт.
Трансформирующиеся клетки делятся, формируя скопление клеток со специфической местной средой. Эта среда характеризуется повышенной кислотностью; гипоксией; нарушенной клеточной коммуникацией; высоким окислительным стрессом; высокой концентрацией токсинов, пролиферативных и воспалительных молекул… То есть, такими условиями, при которых злокачественный фенотип находится в более выгодных условиях, и по этой причине окончательно фиксируется. В дальнейшем, даже при благоприятных условиях (например, при достатке кислорода), трансформировавшиеся клетки и их потомки уже не возвращаются к прежнему фенотипу добровольно (эффект Варбурга) *.
Образуется петля положительной обратной связи: некоторые клетки внутри некоторого защищённого и ограниченного матриксом пространства, пытаясь адаптироваться и выжить во враждебных для них условиях, и дальше поддерживают и усугубляют эти враждебные условия. Причём, не только для себя, но и для других клеток этой ограниченной микросреды, в том числе для иммунных клеток. Выделяя различные молекулярные сигналы, они заставляют и окружающие их клетки приспосабливаться, менять свой фенотип и заботиться о выживании, а не о выполнении своих функций. В данном месте начинает появляться нефункциональное скопление клеток, с удалением которого имеются проблемы.
Когда скорость деления трансформировавшихся клеток опережает скорость их гибели или уничтожения, они накапливаются, образуя своеобразные скопления (маммосферы) – точки роста будущей опухоли. Окружение, состоящее из нормальных эпителиальных клеток, способно сдерживать злокачественную трансформацию склонных к ней клеток *. Однако появление скопления трансформирующихся клеток меняет микроокружение, и снимает этот тормоз. Концентрация трансформировавшихся (гликолитических ) клеток ещё больше увеличивает местную кислотность, гипоксию, воспаление и фиброз. Контроль тканевых процессов в разрастающихся маммосферах извращается или теряется.
В конце концов, возникает то, что называют опухолью (неоплазия) – новообразование, имеющее такую тканевую архитектуру и окружение, которые не обеспечивают нормальное снабжение и функционирование/развитие входящих в него клеток, создают серьёзные проблемы для их выживания, и представляют жизненную угрозу для всего организма.
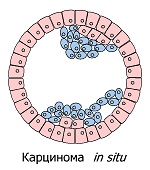
Ранний рак (0 стадия) ограничивается пределами слизистой оболочки. Для молочной железы ранней опухолью является карцинома in situ, дословно – рак на месте. Это пока не злокачественная, однако уже настоящая опухоль, способная получить опасное продолжение. В большинстве случаев такие опухоли не обнаруживаются вплоть до посмертного вскрытия или до разрастания, обеспечивающего безошибочную диагностику. Исследование 1997 года обнаружило, что ~ 9 % всех женщин носят опухоли in situ в груди, в то время как лишь у 1,3 % женщин того же возраста рак груди диагностируется *.
Инвазия. Недифференцированные, например, новорожденные клетки, проявляют несвязанность и, как следствие, определённую мобильность. Это позволяет мигрировать в ткани, например, нормальной эпителиальной клетке к месту замещения погибшей/умершей клетки, где она далее дифференцируется, и теряет способность к миграции. Дифференцированные клетки фиксируются на месте путём обрастания молекулярными связями с соседними клетками и с белковым каркасом ткани – внеклеточным матриксом. Внеклеточный матрикс принимает непосредственное участие как залечивании травмы, так и в опухолеобразовании.
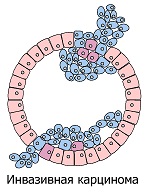
Плотно окружающий опухоль белковый слой, состоящий из коллагенов, протеогликанов и гиалуроновой кислоты, называется базальная мембрана. С одной стороны, базальная мембрана вокруг опухоли создаёт физический барьер, препятствующий проникновению кислорода, многих растворённых в крови веществ, в том числе и химиотерапевтических препаратов, а также циркулирующих клеток. С другой стороны, это ограждение не только обеспечивает внешнюю защиту опухоли, но и сдерживает её распространение.
Трансформированные клетки, в определённой мере сохранившие дифференцировку, будут формировать доброкачественную опухоль. Клетки доброкачественной опухоли, разрастаясь, находятся в окружении базальной мембраны, которая ограничивает их миграцию. Трансформированные клетки, значительно потерявшие дифференцировку, будут формировать злокачественную опухоль, для клеток которой характерна инвазия.
Макрофаги, присутствующие в опухоли (TAM), могут выделять различные протеолитические ферменты для разрушения базальной мембраны, тем самым предоставляя опухолевым клеткам возможность бежать из окружения и вторгаться в соседние ткани и органы (инвазировать).
Чем сильнее процесс размножения клеток обгоняет процесс их дифференцировки, чем более они примитивны, тем более они гликолитические, тем более инвазивный характер проявляет опухоль, и тем хуже прогноз болезни. Хотя проявление такого агрессивного поведения может занять несколько лет, оно свидетельствует о том, что опухоль стала злокачественной.
Самообеспеченность пролиферации. Удвоение клеток требует достаточного количества строительного материала для построения дочерних клеток. При дефиците необходимого материала деление нормальных клеток может замедляться. Однако гликолитические клетки способны обходиться без внешних поставок. Большинство необходимого сырья они получают из метаболических продуктов промежуточных реакций гликолиза в цитозоле клетки *. Кроме того, некоторые требуемые им молекулы предоставляются митохондриями из побочных продуктов глютаминолиза и окислительного фосфорилирования.
Благодаря этому, в опухолевом окружении гликолитические (раковые) клетки получают конкурентные преимущества для своего размножения перед нормальными клетками. Для своей жизни и размножения им достаточно получать лишь глюкозу, в то время как для жизни и размножения нормальных клеток требуются кислород и другие вещества, доставка которых в зону опухоли затруднена.
Стойкость опухоли. Среди всего разнообразия злокачественных клеток иногда выделяют недифференцированные клетки, инициирующие опухоль (Tumor-Initiating Cells, TIC). Поскольку эти клетки проявляют многие функциональные характеристики нормальных стволовых клеток, они также получили название стволовых раковых клеток (Cancer Stem Cells, CSC). CSC представляют собой опухолевые клетки с характеристиками стволовых клеток, которые инициируют образование рака.
Определение «стволовые раковые клетки» основано на трёх функциональных характеристиках этих клеток, а именно:
1) способность инициировать опухоли при потере сдерживающего потенциала ткани и организма;
2) способность к самообновлению, измеренную по образованию опухолей при их пересадке в другой организм;
3) способность дифференцироваться в несамообновляющиеся клетки, которые составляют основной объём опухоли.
Согласно этой теории, только подмножество CSC ответственны за возникновение, поддержание и рецидив опухоли, тогда как другие клетки поражённого органа, составляющие основную часть опухоли, не могут самообновляться или инициировать образование опухоли * *. И хотя CSC составляют мизерную часть всего количества злокачественных клеток, именно они являются важным фактором стойкости и прогрессирования рака * *.
Стволовые раковые клетки надёжно укрыты в своих нишах; они находятся большинство времени в состоянии покоя; они не нуждаются в кислороде; они обладают высокой интенсивностью работы мембранных насосов множественной лекарственной устойчивости; они имеют низкую степень дифференцировки. Благодаря своим особенностям, CSC проявляют чудеса выживаемости. Они могут обновляться посредством эпигенетических изменений, приобретать новые мутации и быстро адаптироваться к окружающей среде, тем самым образуя новую опухолевую структуру с молекулярными характеристиками, сильно отличающимися от характеристик исходной опухоли. Они дают возможность опухоли сопротивляться лучевой и химиотерапии, создавать новые клоны устойчивых к лечению клеток и, в конечном итоге, вызывать рецидивы в большинстве типов рака *.
Теория о наличии CSC, возможно, и неправа, однако она позволяет простым и удобным способом объяснить результаты наблюдений протекающих в опухоли процессов.
Естественный отбор
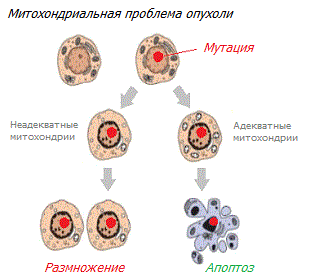
При низком уровне кислорода клеточный механизм восстановления повреждений ДНК работает плохо. Ухудшение условий внешней среды также способствует усилению геномной неустойчивости клеток, а неустойчивость генома производит мутации. В нормальных клетках генетические сбои во время деления клетки приводят к запуску митохондриями процесса апоптоза, и мутация гибнет вместе с клеткой.
Но в раковых клетках функции митохондрий подавлены, а механизм надзора за контрольными точками митоза нарушен, отчего раковые клетки более устойчивы к внутренним сигналам апоптоза. Внешние сигналы смерти раковыми клетками, как уже рассмотрено выше, в опухолевой зоне успешно блокируются, а иммунный путь ликвидации мутировавших клеток ослабляется.
Пользуясь такими благоприятными для себя условиями, мутации получают шанс своего продолжения в дочерних клетках. Большинство видов рака у человека демонстрируют от двух до восьми последовательных генетических изменений, которые развиваются в течение 10-30 лет *. Каждое из этих изменений прямо или косвенно увеличивает дисбаланс между рождением и гибелью клеток в сторону неуклонного роста.
Процесс мутирования имеет ветвящийся характер. Каждая мутировавшая клетка в следующем поколении не только наследует родительскую мутацию, но может приобретать новые оригинальные мутации *. Поэтому в опухолевой зоне множится число различных генетически модифицированных популяций (боковых субклонов). Увеличение множества таких популяций раковых клеток увеличивает вероятность того, что какие-то из клонов смогут выжить при самых невыносимых условиях, в том числе, созданных лучевой и химиотерапией.
Более того, химиотерапия способна усилить злокачественность опухоли. В то время как рост нормальных клеток в токсичной среде тормозится, незрелые клетки, которые более приспособлены к таким неблагоприятным условиям, продолжают своё деление. Химиопрепараты, нацеленные на быстрорастущие клетки, уничтожают большинство раковых клеток, составляющих массив опухоли. Однако гибнут не все клетки, а лишь самые слабые. Естественный отбор оставляет самые успешные, по факту – самые злокачественные из них, которые способны рецидивировать, лучше противостоять химиотерапии и существенно ухудшать прогноз исхода болезни.
Тем не менее, генетические изменения ядерной ДНК не являются фатальными. При нормальном функционировании внутри- и межклеточной сигнальной связи одних только мутаций в ядерной ДНК недостаточно для того, чтобы вызвать рак. Похоже, что при адекватной функциональности клеток онкогенные мутации не имеют шанса реализоваться, и что структура ткани доминирует над геномом. Если они не будут критически испорчены, то злокачественная опухоль не получит развития даже при наличии множественных хромосомных мутаций *.
Увеличивающееся с каждым годом число фактов склоняет к выводу, что рак является больше метаболическим, чем генетическим заболеванием. Что на самом деле геномные мутации не являются первопричиной рака. Они не обязуют злокачественное перерождение клеток, а лишь способствуют ему и сопровождают его.
И действительно, многочисленные данные указывают на то, что при некоторых формах рака отсутствуют хромосомные и генные мутации * * *, а в других случаях были обнаружены изменения в характере метилирования ДНК, но не в её последовательности *. В то же время появление злокачественных новообразований и аэробного гликолиза следует за потерей митохондриальной функции *. Кроме того, все относящиеся к клетке признаки рака могут быть связаны с нарушением функций митохондрий и энергетического обмена *.
Даже пересадка ядра злокачественной клетки в нормально функционирующую клеточную цитоплазму, содержащую здоровые митохондрии, не делает последнюю злокачественной клеткой – из неё впоследствии формируются нормальные ткани * * *. Замена ядра нормальной зародышевой клетки ядром раковой клетки (с мутировавшими генами) не делает её раковой; из такой клетки впоследствии рождаются нормальные организмы *. Из ядер раковых клеток опухолей головного мозга получались здоровые клоны мышиных эмбрионов *. Из раковых клеток, введённых в ранние эмбрионы, формируются здоровые ткани и органы *. И наоборот, замена ядра раковой клетки ядром здоровой клетки (без мутаций) оставляет её раковой. Т.е., ядра нормальных клеток в нездоровой клеточной цитоплазме не могут отменить злокачественность клетки.
С другой стороны, внедрение функциональных митохондрий в раковую клетку может обратить вспять её различные злокачественные характеристики, включая пролиферацию клеток, жизнеспособность в условиях гипоксии, антиапоптотические свойства, устойчивость к противораковым препаратам, инвазии и колониеобразование, а также рост опухоли *. Таким образом, злокачественное состояние клетки зависит не от ядра клетки, а от её органелл * * *.
Наконец, рак может быть вызван без изменений ДНК, например, за счёт воздействия негенотоксичных канцерогенов (таких как хлороформ и дихлорбензол) *. Злокачественную опухоль без каких либо мутаций ДНК можно также спровоцировать путём введения в ткани организма немутагенных чужеродных материалов, которые нарушают клеточное взаимодействие *.
Всё это склоняет к выводу, что, вопреки господствующей теории, не генетические мутации ядерной или митохондриальной ДНК являются первопричиной того, что клетка стала раковой *. Злокачественной делает клетку не само по себе наличие мутаций или экспрессия онкогенов. Скорее, цитоплазма, а не ядро клетки определяет злокачественное состояние клетки * *, и для образования опухоли требуется наличие в клетках неэффективных митохондрий.
Таким образом, генетические мутации являются не центром проблемы, а лишь частью общего процесса. А опухолевый фенотип принципиально может быть обращён назад к нормальному фенотипу * * *.
Ангиогенез. Увеличение производства гликолитическими клетками молочной кислоты, и как следствие, закисление межклеточного пространства, снижает концентрацию в нём кислорода.
Реагируя на хронический дефицит кислорода и избыток токсинов, клетки посылают сигналы, требуя развить к ним кровеносные и лимфатические сосуды, и эти сосуды начинают своё формирование (ангиогенез). Помимо гипоксии, существуют и другие сигналы, способствующие ангиогенезу. Например, эстроген, или хроническое воспаление, сопровождающее опухолевый процесс.
Ангиогенные явления типичны для травм, и они могут появиться в ткани уже на самых первых этапах образования опухоли *. Кровеносная система начинает прокладку новых сосудов, реагируя на настойчивые запросы уже 100-200 клеток. Хотя сосуды в опухоль и прорастают, а местное кровоснабжение несколько улучшается, поступающая с кровью глюкоза снова расходуется на гликолиз и рост числа гликолитических клеток.
Таким образом, кислотность ткани по-прежнему остаётся повышенной, и проблема недостатка кислорода не решается, если не усугубляется. Увеличившееся количество гликолитических клеток требуют для себя сосудистого обеспечения ещё громче.
Кроме того, из-за извращения сигнализации между клетками, новообразованные сосуды в зоне поражения отличаются незрелостью и незавершённостью. Высокий процент протечек жидкости из неполноценных кровеносных сосудов и плохой дренаж лимфатических сосудов создают зону местного повышенного давления. А оно, в свою очередь, ухудшает снабжение клеток, а также препятствует поступлению лекарственных средств и некоторых молекул, обеспечивающих удалённую межклеточную коммуникацию.
Клетки, находящиеся далеко от кровеносных сосудов, получают необходимое им химическое питание путем диффузии. Это несколько ограничивает высокие потребности раковых клеток в глюкозе. Считается, что при диффузном методе получения питания опухоли не могут вырасти в размерах более, чем 1 мм, а затем они вынуждены остановить свой рост из-за недостатка ресурсов. Когда же к раковым клеткам прокладываются пути снабжения в виде кровеносных капилляров, они получают легкий доступ к глюкозе и, таким образом, могут значительно увеличить свой пролиферативный потенциал.
Многие пищевые компоненты обладают антиангиогенными свойствами †, поэтому модификация диеты в виде увеличения доли растительной и цельнозерновой пищи может снизить темпы роста опухоли. Кроме того, жировая ткань очень насыщена кровеносными сосудами. Жировые клетки выделяют большие количества ангиогенных факторов и, таким образом, рост жировых отложений увеличивает риск развития рака.
Метастазирование – это процесс распространения раковых клеток за пределы первичной опухоли и образование вторичных опухолей на новых местах, далеко за пределами первичной опухоли. Именно метастазирование является причиной около 90 % всех смертей от рака *. В то же время, этот процесс всё ещё остаётся не вполне ясным.
Дифференцированные клетки прочно привязаны к матриксу в месте своего расположения. Для того, чтобы взрослые клетки могли мигрировать, им потребуется пройти некоторые фенотипические трансформации, которые позволят им приобрести подвижность. Такие трансформации называются эпителиально-мезенхимальный переход (ЕМП). Но чем более клетки примитивизированы, тем менее они связаны с внеклеточным матриксом, и тем более они склонны переноситься с лимфой или кровью на ближние и дальние участки организма, и образовывать там новые колонии (метастазирование). Раковые клетки как раз обладают такой способностью, и чем агрессивнее раковая клетка, тем более она склонна к экспансии.
Итак, в нормальных тканях возможности миграции клеток крайне ограничены. Клетки одного органа добровольно не мигрируют в другой орган, а если каким-то образом такое и случится, там они будут идентифицированы как чужеродные, и уничтожены иммунными клетками. То же самое происходит и с циркулирующими раковыми клетками. Однако в этом случае возникает несколько сложностей.
Покидая первичную опухоль, мигрирующие в другие органы трансформированные клетки могут нести на себе толстое белковое покрытие, которое играет роль маскировки и брони (e). Такой камуфляж скрывает молекулярные метки на внешней поверхности раковой клетки, которые могли бы распознаваться иммунными клетками как их законная добыча. А утолщение защитной оболочки усложняет задачу распознания, поражения и поглощения метастазирующей клетки иммунными клетками – натуральными киллерами и фагоцитами.
Тем не менее, при нормально функционирующей иммунной системе, одиночная метастазирующая клетка вне опухоли будет распознана (d), атакована и, в конце концов, ликвидирована. Вырвавшись за пределы своего микроокружения (b), она попадает в неблагоприятные внешние условия. Здесь она не прикрыта дебрями внеклеточного матрикса и воспалительными сигналами, подавляющими иммунную активность, и потому имеет очень мало шансов на выживание. Для успешного метастазирования требуется миграция не единичной раковой клетки, а микроскопической части опухоли целиком.
Во-первых, в этом случае раковые клетки, плотно сопровождаемые другими клетками микроокружения опухоли, лучше укрыты от агрессивных внешних факторов. Во-вторых, так им легче избежать избежать аноксии – формы апоптоза, которая вызывается потерей привязанности к другим клеткам *. А в-третьих, прибытие в новую нишу вместе со своим микроокружением помогает им уклоняться от сигналов, исходящих от соседних клеток неопухолевой ткани, которые могли бы склонить их к сдерживанию своего размножения, к апоптозу или к потере злокачественности (дифференцировке). Толстый слой липкого гликопротеина на поверхности раковых клеток способствует формированию такого многоклеточного кластера, а липопротеины дополнительно заделывают щели между ними.
Связанные с опухолью макрофаги (ТАМ) могут составлять до половины всего объёма опухоли. Опухолевое микроокружение способно менять фенотип макрофагов таким образом, что они теряют способность поглощать и усваивать незрелые (в т.ч. раковые) клетки. Бездействуя, они продолжают плотно окружать раковые клетки, укрывая их от всё ещё функциональных клеток-убийц. Отделяясь от массива опухоли вместе с раковыми клетками, макрофаги могут обеспечивать такую же их защиту в процессе путешествия.
Если проникновение раковых клеток в кровоток (c) сопровождается повреждением стенки кровеносного сосуда, то фибрин, появляющийся в месте травмы, будет формировать вокруг мигрирующего ракового кластера тромбоцитарные сгустки, скрепляющие это микрообразование. Дополнительно для прикрытия может привлекаться особый белок – релин, встречающийся только в головном мозге. Это позволяет циркулирующей раковой клетке пересекать границу между кровью и мозгом, вызывая в последнем метастазы.
Уцелев после своего опасного пути, и застряв в мелком кровяном капилляре, мигрирующий микросгусток с раковыми клетками теряет часть своей внешней защиты. Обнажение своей поверхности облегчает раковой клетке фиксацию к местному матриксу, если она не окончательно утратила такую способность. Если микросгусток, в котором она путешествует, достаточно большой, он может ухудшить местное кровоснабжение, а значит, и поступление кислорода, создавая благоприятную среду для развития опухоли. Если раковые клетки прибывают на новое место в сопровождении иммунных клеток, которые являются преимущественно гликолитическими, те могут дополнительно повышать местную кислотность и гипоксию.
Поскольку проникновение клетки-пришельца из кровеносного сосуда внутрь ткани и сохранение её злокачественных черт требует сочетания определённых условий, очаги микрометастазов не обязательно немедленно получают рост. Они могут долгое время пребывать в замороженном, неактивном состоянии, ожидая своего звёздного часа. Но чаще всего они исчезают из-за неблагоприятных для них условий и вследствие работы функциональных иммунных клеток.
Метастазирование легче всего происходит через лимфатические сосуды. Но дальние маршруты метастазирования проходят всё же через кровеносные сосуды, несмотря на более неблагоприятные внешние условия.
В удалённом от первичной опухоли месте раковым клеткам требуется пройти обратный путь из кровеносного сосуда, чтобы внедриться в местную ткань (f). Однако здесь среда отличается от опухолевой. В опухоли кровеносные сосуды плохо сформированы, разъедаются агрессивными метаболитами раковых клеток, и имеют высокую проницаемость. Потому они легко допускают проникновение раковых клеток в кровь. В здоровой же ткани стенки кровеносных сосудов не благоприятствуют вторжению раковых клеток, если они предварительно не подготовлены к этому.
Согласно альтернативной теории, перенос раковых клеток в отдалённые места происходит при помощи макрофагов. Поглощение враждебных агентов с дальнейшим их разложением и усвоением является рутинной работой макрофагов. Однако когда в воспалённой микросреде опухоли функциональность макрофагов нарушается, этот процесс может не выполняться в должном объёме. Например, при сохранении способности поглощать пагенный объект (фагоцитоз), макрофаги могут потеряют способность к его растворению (лизис).
По этой причине макрофаги могут растворять оболочку эпителиальной раковой клетки, но сохранять её ядро. В результате такого слияния образуется многоядерный гибрид *, который обладает свойствами как эпителиальной клетки, так и макрофага *. При ещё бо́льшей дисфункции, не имея возможности усвоить поглощённую клетку, макрофаг может сохранять её целиком. Таким образом, макрофаги могут служить транспортом для переноса раковых клеток внутри себя.
Нечто похожее происходит при некоторых паразитарных заболеваниях, когда паразиты надёжно укрываются от своего обнаружения и смерти внутри здоровых клеток организма, например, в эритроцитах. Таким образом, метастазирование как явление может происходить с первых же моментов появления опухоли. И виной тому могут быть те самые иммунные клетки, которые призваны нас защищать.
Наконец, согласно самой радикальной версии *, метастатические клетки сами происходят из макрофагов или других подобных клеток миелоидного происхождения (дендритных клеток или лимфоцитов). Злокачественные преобразования происходят в них из-за дыхательной недостаточности и агрессивной микросреды опухоли, в которой они пребывают.
Макрофаги являются клетками, которые не привязываются к матриксу. Они генетически запрограммированы на то, чтобы существовать в кровотоке и естественным образом легко проникать сквозь ткань. Под их оболочкой раковые клетки могут ускользать из опухоли и транспортироваться лимфотоком в лимфоузлы. А кровотоком – безопасно разноситься далеко за пределы первичной опухоли, потому что кровяная среда является для них естественной.
Риск метастазирования растёт вместе с ростом примитивизации клеток, и это процесс, видимо, начинается уже при зарождении опухоли. Даже самая маленькая опухоль способна извергать недифференцированные, достаточно мобильные опухолеинициирующие клетки, которые могут распространяться далеко за её пределы.
По мере роста размера первичной опухоли растёт количество и размеры мигрирующих опухолеинициирующих обломков. И хотя их шансы создать колонию раковых клеток в удалённом месте мизерны (по разным оценкам, лишь одна из десятков или даже сотен тысяч таких попыток достигает успеха), из-за огромного числа попыток это, рано или поздно, происходит.
На момент диагностики первичной опухоли, примерно 50 % пациентов уже имеют невыявленные микрометастатические опухолевые колонии, которые в конечном итоге могут увеличиться и привести к возвращению болезни после её лечения. Чем больше размер обнаруженной первичной опухоли, тем выше вероятность наличия таких колоний *.
Если метастазирование – это рост раковых клеток первичной опухоли на новом месте, то любая опухоль, например, в лёгких, возникшая вслед за опухолью молочной железы, будет считаться метастазировавшей опухолью молочной железы, а не новой опухолью лёгких. Но существует и альтернативные взгляды. Согласно одному из них, метастазы возникают вследствие активации соответствующих онкогенов в отдалённых местах посредством постоянно циркулирующих сигнальных молекул, которые исходят из первичной опухоли *.
В пользу этой версии приводят слишком короткое время развития метастазов по сравнению со временем развития первичной опухоли. А также тот факт, что плазма, полученная от мышей с опухолями, содержит высокую концентрацию факторов роста, и заживляет раны быстрее, чем плазма от здоровых мышей *. Тем не менее, такая точка зрения не противоречит господствующей. Возможно, пока ещё не выясненным способом, удаление первичной опухоли текущими протоколами лечения способно снять ограничения на развитие уже распространившихся метастазов, которые находились ранее в «спящем» состоянии.
В зависимости от степени инвазии и метастазирования, различают несколько стадий рака, что будет рассмотрено дальше. Между тем, первичная опухоль не представляет собой смертельную опасность, в отличие от метастазов, которые и являются главной причиной смерти раковых пациентов. Это значит, что при своевременной диагностике у нас есть время принять меры, чтобы затормозить опухолевый процесс, и отдалить тот час, когда метастазы разовьются и убьют больного. Оттянуть вплоть до того момента, пока смерть от рака не опередят другие причины смерти.
Степень опасности. При том обилии рисков и негативных факторов, который мы можем видеть, кажется удивительным то, что рак проявляется не у каждого из нас. На счастье, организм снабжён большим количеством компенсирующих механизмов, чтобы не допустить этого. Поэтому описанная выше драма с трагическим концом являет собой крайний случай, а не правило. Хотя изложенные выше процессы происходят почти у каждой взрослой женщины, чаще всего организм успешно преодолевает возникающие проблемы. Если бы это было не так, опухолям не пришлось бы вызревать несколько лет * *, пока их не обнаружат. Борьба может идти с переменным успехом, и её исход во многом зависит от поведения самого пациента.
Злокачественные черты характера не овладевают клетками абсолютно; раковые клетки всё ещё остаются в какой-то мере чувствительными к внешним сигналам апоптоза, сдерживания роста, дифференцировки и «оседлости». Они могут переходить в состояние относительного покоя и оставаться в нём в течение многих лет *. И даже могут самостоятельно бесследно исчезать – такое редкое явление называется спонтанная ремиссия. Можно допустить, что на микроуровне переходы от доброкачественных состояний в злокачественные и обратно могут происходить неоднократно, и незаметно как для самого человека, так и для диагностики.
Для проявления тканевых преобразований, порождающих и поддерживающих рак, недостаточно временного местного нарушения тканевого/клеточного равновесия. Пролиферация может проявляться в виде мозолей, бородавок или паппилом, но сама по себе она не является причиной опухоли. Местное воспаление может продолжаться многие годы, не вызывая при этом опухолей. Фиброз может сопровождать процессы воспаления и старения, вызывая заметную трансформацию тканей, но не проявляя опухолевых признаков. Генетических модификаций также недостаточно, чтобы вызвать рак.
Требуется одновременное сочетание нескольких внутри- и внеклеточных условий, которые в длительной перспективе способны образовать самоподдерживающиеся канцерогенные петли. Устранение даже одной из них на самой ранней стадии может замедлить нарастание злокачественности. Устранение нескольких – перевести движение на рельсы незлокачественных состояний, а то и обратить вспять процесс зарождения опухоли. Который на самом деле является лишь результатом нарушения нормального функционирования клеток и ткани.
Иная ситуация складывается, когда опухоль уже образовалась. Многоконтурность и многофакторность ракового процесса не оставляют надежды найти единственную лекарственную формулу, единственную терапию, или единственную цель, которая могла бы сломать весь его механизм. Разрыв одной или двух причинно-следственных связей даст мало пользы, поскольку благодаря своей гибкости и приспособляемости, раковые клетки найдут механизмы их обхода. Для победы над раком придётся обрывать все возможные онкогенные цепочки, чтобы не дать ему ни единого шанса. И даже создание самых благоприятных условий не обязательно означает добровольного возвращения раковых клеток в нормальный фенотип, что подразумевает необходимость их уничтожения.
Образование и развитие опухоли не являются неизбежностью. Из нескольких тысяч очагов гиперплазии только единицы образуют опухоли. При этом основная часть из них не являются инвазивными, и сопровождают большинство женщин всю их долгую и счастливую жизнь. И даже позволяют не задумываться о бессимптомных болезненных процессах, протекающих в груди. Но именно это и придаёт раку коварство и оставляет ему шанс на победу.
"Рак является генетическим заболеванием. Он происходит из единственной мутировавшей клетки и проходит этапы зарождения, роста и метастазирования". Так до сих пор учат медицинские учебники. Но как мы видим из всего рассмотренного выше, это не совсем так. Канцерогенез представляет собой не линейную цепь, а запутанную сеть взаимосвязанных событий. Мутации вовлекаются в процесс, и являются лишь одним их фрагментов развития злокачественной опухоли. Рак можно охарактеризовать не как аномальный процесс в организме, а как аномальное сочетанием естественных клеточных процессов.
Возвращаясь к принципиальным позициям теории соматических мутаций, изложенных в самом начале этого раздела †, можно заметить, что предложенная здесь картина развития рака во многих моментах контраверсийна ей:
- нормальным состоянием клеток человека является экспансия (деление и миграция), а не покой;
- появление опухоли является не случайностью, а результатом нарушения порядка естественных процессов;
- опухоль появляется не из единичной клетки с одной или несколькими мутациями, а из группы близкорасположенных клеток ткани, подвергающихся травматическим сигналам, которые они не в силах снизить обычными механизмами;
- мутации опухолевых клеток вызваны обстоятельствами текущего процесса, а не являются его исходной причиной;
- негативные последствия мутаций могут сдерживаться нормальным внутриклеточным состоянием и нормальным внеклеточным окружением.
А теперь вернёмся к положению, что от выбора рабочей теории происхождения рака непосредственно вытекает стратегия его лечения. Если рак является результатом безнадёжных ошибок в генах, как это до сих пор утверждает догма, то устранение всех раковых клеток является единственным, и не вселяющим оптимизма подходом к лечению. Это путь современной медицины.
Если же изменение экспрессии генов – лишь сопуствующий элемент этого процесса, а сам рак – результат дисфункции межклеточных взаимодействий, то теоретически он может быть обращён вспять. Опухоль можно склонить к тому, чтобы умереть, остановить или значительно затормозить своё развитие, дифференцировать примитивизировавшиеся клетки и сформировать полностью нормальные ткани путём нормализации клеточных сигналов.
В частности, если рассматривать опухоль как результат неадекватного функционирования, то такое видение проблемы предполагает для её решения комбинацию следующих местных терапевтических манипуляций:
- оперативное удаление основной части опухоли;
- снижение уровня травматических сигналов, включая гормональные;
- снижение уровня воспалительных сигналов;
- восстановление митохондриального дыхания;
- снижение сопротивляемости раковых клеток;
- стимулирование окончательной дифференцировки клеток;
- обеспечение ткани кислородом и строительным материалом, необходимым для процесса восстановления ткани;
- формирование здоровой микрофлоры в эпителии;
- адекватная настройка иммунных клеток.
Завершая эту главу, никак не удаётся избавиться от ощущения недосказанности. Мы можем бесконечно долго рассматривать механизмы ракового процесса, но мы не можем точно сказать, что именно является его действительной причиной, а не следствием. И есть ли она вообще.
Есть много вопросов, на которые нет ответа. Почему при вроде бы одинаковых условиях одни люди становятся его жертвами, а другие – нет? Почему у одних рак возникает на пустом месте, а у других его нет даже при массе канцерогенных факторов? Рак всё еще остаётся тайной и, несмотря на всё растущее знание о нём, от нашего взгляда ускользает что-то непостижимое. Мы видим процесс, но не видим движущей силы. Так же, как не видим за суетой строителей замысел архитектора в его голове. Так же, как в природных явлениях не видим присутствие Святого Духа.