Gezondheidsstrategie.
Somatische mutaties van DNA-genen worden nog steeds beschouwd als de belangrijkste factor in de ontwikkeling van kanker. Modificatie van nucleair DNA is echter slechts een deel van het totaalbeeld van het tumorproces, en niet de hoofdoorzaak ervan. Zelfs meerdere mutaties in nucleair DNA zorgen er niet onvermijdelijk voor dat de cellen kankerachtige eigenschappen vertonen.
Speciale onderzoeken hebben aangetoond dat wanneer de kern van een kankercel wordt gecombineerd met de inhoud van een normale cel, er geen tekenen van maligniteit verschijnen * * * * *. Zelfs in de aanwezigheid van tumor-geassocieerde mutaties werd de carcinogeniteit van veel tumortypen onderdrukt wanneer de kern van een tumorcel in het cytoplasma van een normale cel werd geïntroduceerd * * * *. Omgekeerd nam de carcinogeniteit toe wanneer de intracellulaire inhoud van een kankercel werd gecombineerd met de kern van een normale cel * *.
Maar dit betrof de fusie van materiaal, maar wat als we zouden proberen de kernen van normale en kankercellen te kruisen? Dergelijke experimenten zijn ook uitgevoerd. Wanneer de kern van een kankercel werd vervangen door de kern van een gezonde cel, bleef deze kwaadaardigheid vertonen. En toen de kern van een gezonde cel werd vervangen door de kern van een kankercel, bleef deze een niet-kwaadaardige cel vertonen * *.
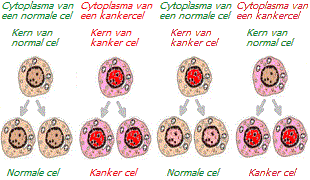
De kernen van kankercellen vormden, nadat ze in het gezonde cytoplasma van de cel waren getransplanteerd, normale weefsels *. Kankercellen die in vroege embryo’s werden geïntroduceerd, vormden gezonde weefsels en organen *. Nadat de kern van een kankercel van een kikker in een eicel was gebracht waarvan de gezonde kern er eerder uit was gehaald, ontwikkelde dit eicel zich tot een gezond kikkervisje *. Als, zoals koppig wordt beweerd, genmutaties in nucleair DNA inderdaad de enige of zelfs de belangrijkste oorzaak van kanker zouden zijn, zouden dergelijke wonderen onmogelijk zijn. De kwaadaardige kenmerken zouden met de kern van de kwaadaardige cel moeten worden meegevoerd.
Geïntrigeerd door deze bevindingen voerden de onderzoekers soortgelijke experimenten uit met mitochondriale overdracht. Door mitochondria uit een normale cel in een tumorcel toe te voegen, werd het oncogene fenotype van de cel onderdrukt * * * en werd de gevoeligheid voor chemotherapie verergerd *. Tegelijkertijd, toen mitochondriën van tumorcellen werden toegevoegd aan een normale cel, nam het oncogene fenotype van de cel toe * *. De mate van kwaadaardigheid van een cel wordt dus niet bepaald door de toestand van de kern, maar van de mitochondriën en mogelijk ook van andere celorganellen.
Intracellulaire factoren kunnen het tumorfenotype * onderdrukken of juist stimuleren. Mutaties in het mitochondriaal DNA (mtDNA) of andere factoren kunnen het proces van oxidatieve fosforylatie verstoren *, waardoor de cel zich zal moeten richten op de productie van glycolytische energie. Bovendien kunnen persistente pathogene mutaties in mtDNA ook leiden tot epigenetische veranderingen die genomische instabiliteit in het nucleaire genoom veroorzaken.
De meest redelijke verklaring voor de resultaten van de hierboven genoemde experimenten is dat genetische veranderingen in nucleair DNA onvoldoende zijn voor kwaadaardige transformatie van cellen. Of misschien zijn ze helemaal niet nodig. Het lijkt erop dat kwaadaardige transformatie van cellen het gevolg is van defecten in het cytoplasma en niet van defecten in de kern *. Wanneer de mitochondriën normaal functioneren, hebben carcinogene mutaties in nucleair DNA weinig kans. Gezonde mitochondriën kunnen het kankergedrag van cellen omkeren, zelfs met gemuteerd nucleair DNA. En vice versa: mitochondriale dysfunctie zal cellen dwingen de glycolyse en fermentatie te verhogen, waardoor cellen met normaal DNA vatbaar worden voor kwaadaardige transformatie.
Het tumorfenotype kan niet alleen op cellulair niveau worden teruggebracht naar een normaal fenotype. De toestand van het weefsel en, in grote lijnen, de toestand van het hele organisme is doorslaggevend bij de vraag of er zich al dan niet een tumor zal vormen en wat zijn lot zal zijn. Weefsel met volledig gedifferentieerde cellen kan met succes het gedrag van opkomende kwaadaardige cellen in de richting van hun correctie beïnvloeden.
Transplantatie van kankercellen in gezond weefsel kan leiden tot verlies van kwaadaardige eigenschappen, ondanks de aanwezigheid van mutaties * *. Niet alleen een enkele kankercel, maar zelfs een vrij grote groep kankercellen heeft geen kans een tumor te vormen als het weefsel waarin ze worden geïmplanteerd gezond is. Om een mens een tumor te laten vormen, is een gelijktijdige injectie van minstens 10 miljoen kankercellen nodig *. Wanneer er te weinig kankercellen vanuit een tumor in gezond weefsel worden geïntroduceerd, verliezen ze hun kwaadaardigheid volledig en veranderen ze in normale cellen * *, hoewel dit bij onomkeerbare genoomdefecten in principe niet zou mogen gebeuren.
Kankercellen zijn niet alleen in staat hun groei te stoppen, maar ook terug te keren naar een normaal fenotype, ondanks mogelijke genetische mutaties * *. Dergelijke gevallen worden spontane remissie genoemd. Al deze feiten passen op de een of andere manier niet goed in de heersende theorie dat kanker voortkomt uit een enkele gemuteerde cel die de controle heeft verloren, en dat de ontwikkeling ervan onomkeerbaar is.
Een steeds groter wordende hoeveelheid bewijs levert overtuigende redenen om te geloven dat de huidige kijk op de oorsprong en aard van kanker herzien moet worden. Dat de tumor meer een stofwisselingsziekte is dan een genetische ziekte *. En dat de mitochondriale metabolische theorie (MMT) de kenmerken van kanker beter kan verklaren dan de somatische mutatietheorie (SMT) *.
Vanuit metabolisch oogpunt is het de pathologische verstoring van de cellulaire ademhaling die voorafgaat aan en de oorzaak is van de instabiliteit van het genoom die gepaard gaat met het proces van tumorontwikkeling *. Hoewel genomische instabiliteit op de korte termijn misschien niet voldoende is om genetische mutaties te veroorzaken, verhoogt instabiliteit op de lange termijn dit risico. Onder de nucleaire DNA-mutaties die ontstaan, kunnen er mutaties zijn die bijdragen aan verdere stofwisselingsstoornissen, kwaadaardige transformaties en progressie van de ziekte.
Het heeft geen praktische zin om een anti-kankerstrategie te richten op een genetisch probleem, dat de moderne geneeskunde stuurt. Tientallen jaren van onderzoek hebben voor de overgrote meerderheid van de kankersoorten geen enkel specifiek oorzakelijk gen of een reeks genen geïdentificeerd. Mutaties in kankercellen komen op miljoenen onvoorspelbare plaatsen in het DNA voor, waardoor elk geval zijn eigen unieke kenmerken krijgt. En vanuit genetisch oogpunt kan elk van hen een individuele behandeling nodig hebben, terwijl tumorcellen steeds meer nieuwe mutaties zullen verwerven. Bovendien kunnen kankercellen bestaan zonder enige mutatie.
Tegelijkertijd komt een mitochondriaal probleem bij vrijwel elk geval van kanker voor. Dit is een algemene pathologie van cellen met een kankerfenotype, ongeacht welke mutaties erin hebben plaatsgevonden. Cellen met slecht functionerende mitochondriën zijn mogelijk niet kankerachtig. Het is echter onwaarschijnlijk dat er kankercellen zullen zijn met volledig functionele mitochondriën. Vanuit dit oogpunt kan de behandeling van de meeste vormen van kanker worden teruggebracht tot een algemeen protocol.
Als het defect in de tumorcellen werkelijk in de mitochondriën ligt, en niet in de celkern, verandert dit de aanpak van de kankerbehandeling compleet. In plaats van te focussen op de vernietiging van cellen met onomkeerbaar gemuteerde genen, zou men zich moeten concentreren op het herstellen van de normale werking van de mitochondriën in alle cellen van het lichaam.
Levende mechanismen hebben een inherent verlangen naar organisatie, ordelijkheid en ontwikkeling, terwijl niet-levende mechanismen een inherent verlangen hebben naar chaos, wanorde en vernietiging. De chemie van de levende natuur verschilt van de chemie van de levenloze natuur doordat de processen daarin op een gecontroleerde manier plaatsvinden, met behulp van geschikte enzymen en de gecoördineerde werking van elektrochemische mechanismen. Biochemische reacties vereisen echter energieverbruik, dus geen enkel levend organisme kan bestaan zonder energievoorziening.
Het grootste deel van de energie die door menselijke cellen wordt geproduceerd, wordt gewonnen uit glucosemoleculen. Glucose wordt eerst de cel in getransporteerd en neemt deel aan een proces dat glycolyse wordt genoemd. Dit is een meerfasig biochemisch proces dat plaatsvindt in het cytosol van de cel. Elk van de tien metabolische reacties van glycolyse vereist specifieke enzymen en vereist geen zuurstof. Glycolyse breekt het glucosemolecuul niet volledig af en laat daarom niet alle energie vrij die het bevat.
Als gevolg van glycolyse worden uit elk glucosemolecuul 2 moleculen pyruvaat (pyrodruivenzuur) gevormd en worden 2 moleculen adenosinetrifosfaat (ATP) geladen met energie, die door alle cellen van het lichaam als energiemiddel wordt gebruikt. Pyruvaat geproduceerd door glycolyse kan vervolgens worden gemetaboliseerd tot lactaat en als metabolisch afval uit de cel worden uitgescheiden. De meeste primitieve levensvormen produceren op deze manier energie, en dat deden ze al lang voordat zuurstof in de atmosfeer van de planeet verscheen (ongeveer 2,5 miljard jaar geleden). Deze eencellige organismen hebben ook de kenmerken van kankercellen, zoals ongecontroleerde deling en onsterfelijkheid.
Cellen van goed georganiseerde organismen hebben het vermogen om pyruvaat verder af te breken, waarbij alleen water en kooldioxide als metabolisch afval worden geproduceerd. Dit gebeurt in cellulaire organellen die mitochondriën worden genoemd, eerst via een cyclisch biochemisch proces dat de Krebs-cyclus (KC) wordt genoemd, en vervolgens via een elektrochemisch proces dat oxidatieve fosforylatie (OF) wordt genoemd. In dergelijke cellen kunnen uit elk glucosemolecuul, zoals voorheen, 2 ATP-moleculen worden geproduceerd met behulp van glycolyse, en tot 36 extra ATP-moleculen met behulp van OF. Dit laatste proces vereist het verbruik van zuurstof, die hier dient als elektronenacceptor in de laatste fase van de energieproductie – de zogenaamde «elektronentransportketens».
In menselijke cellen wordt meer dan 90% van het intracellulaire ATP geproduceerd door OF *. Ondanks dat OF zuurstoftoevoer nodig heeft, is deze manier van energieproductie vele malen effectiever dan glycolyse. Verrassend genoeg blijven sommige cellen in het menselijk lichaam glycolyse gebruiken als hun belangrijkste energiebron (bijvoorbeeld rode bloedcellen, netvliescellen, testiscellen). Dit zijn normale glycolytische cellen. Alle andere normale cellen, inclusief epitheelcellen, gebruiken OF echter als de belangrijkste energiegenerator.
Een verminderd cellulair energiemetabolisme is een bepalend kenmerk in bijna alle gevallen van kanker. Terwijl in normale epitheelcellen de overgrote meerderheid van alle energie wordt geproduceerd door mitochondriën, verliezen mitochondriën in kankercellen grotendeels hun functie. Dit verandert niet alleen het beeld van het energiemetabolisme radicaal. Tijdens de verschillende stadia van de glycolyse worden chemische grondstoffen gevormd als metabolisch afval, waardoor uit deze grondstoffen dochterkankercellen kunnen worden opgebouwd. Hoe intenser de glycolyse, hoe meer van dit bouwmateriaal, hoe sneller de kankercel zich kan delen.
In de meeste gevallen worden kankercellen dus gekenmerkt door verhoogde glycolyse, dat wil zeggen de omzetting van glucose in pyruvaat en de verdere metabolisatie van het resulterende pyruvaat in lactaat. Veel normale cellen onder hypoxie kunnen ook tijdelijk de enzymatische energieproductie verhogen, maar wanneer het adequate zuurstofniveau is hersteld, keren ze altijd terug naar de mitochondriale energieproductie. Bij kankercellen gebeurt dit echter niet. Ze maken gebruik van glycolyse, zelfs als er voldoende zuurstof is (een fenomeen dat aerobe glycolyse wordt genoemd).
De uitbreiding van de energieproductie door fermentatie is niet alleen een gevolg van de voorgaande stadia van de ontwikkeling van het tumorproces, maar ook de oorzaak van de daaropvolgende stadia. De langdurige afhankelijkheid van cellen van enzymatische energieproductie vertoont kenmerken van kankercellen zoals genomische instabiliteit, verstoring van het intracellulaire metabolisme*, zuur-base-omkering *, verlies van differentiatie en ongecontroleerde groei *. Het verbeteren van de mitochondriale ademhaling van cellen heeft dus belangrijke therapeutische implicaties * *.
Het herstellen van het natuurlijke cellulaire metabolisme omvat twee complementaire acties: het verminderen van de anaerobe ademhaling en het verhogen van de aerobe ademhaling.
Mitochondriale ondersteuning. Mitochondria zijn actieve organen van de cel (cellulaire organellen), waarvan het aantal in elke cel kan variëren van 200 tot 2'000. Ze hebben hun eigen DNA, dat ze gebruiken voor hun voortplanting, en zijn een soort samenwonende intracellulaire symbiont. Vermoedelijk zijn de mitochondriën afkomstig van vrijlevende bacteriën die het OF-mechanisme gebruikten om hun energie te produceren.
Er wordt aangenomen dat ze enkele honderden miljoenen jaren geleden werden opgenomen door een oude glycolytische gastheercel, maar niet werden afgebroken, maar in plaats daarvan werden opgenomen in de intracellulaire processen, waardoor de cel aanzienlijke evolutionaire voordelen kreeg. Verder werd deze symbiontcel de voorloper van alle levende organismen waarvan de cellen OF gebruiken.
De belangrijkste cellulaire functie van mitochondriën is de productie van energie die nodig is voor de metabolische processen van de cel. De energiebron voor de cellen van het menselijk lichaam kunnen verschillende voedingsstoffen zijn, maar uiteindelijk wordt deze energie alleen opgeslagen in een molecuul dat adenosinetrifosfaat (ATP) wordt genoemd. ATP wordt door alle cellen, zowel gezonde als kankercellen, gebruikt voor energie.
Mitochondria produceren niet alleen energie, maar nemen ook deel aan een aantal andere uiterst belangrijke cellulaire functies. Dit zijn de regulatie van membraanpotentiaal en celdifferentiatie; cellulaire signalering via reactieve zuurstofsoorten (ROS); calciumsignalering, controle van apoptose en autofagie; regulering van het cellulaire metabolisme; regulering van het ijzermetabolisme en de heemsynthese; regulering van de steroïdesynthese *. De gezondheid van de cel en de gezondheid van het hele organisme zijn dus afhankelijk van de gezondheid van de mitochondriën.
Mitochondria ondergaan specifieke structurele en functionele veranderingen bij kanker en zijn actief betrokken bij metabolische herprogrammering. Een afname van het aantal mitochondriën en/of hun functionaliteit wordt beschouwd als een karakteristiek kenmerk van kankercellen. Uiteraard gaat verlies van de mitochondriale functie niet altijd gepaard met kwaadaardige transformatie; hiervoor zijn ook andere voorwaarden nodig. Kwaadaardige transformaties gaan echter bijna altijd gepaard met verlies van mitochondriale functies.
Tijdens de productie van ATP produceren mitochondriën grote hoeveelheden vrije radicalen (oxidanten), zoals reactieve zuurstofsoorten (ROS) en reactieve stikstofsoorten (RNS). Hoe meer grondstoffen voor energie de mitochondriën binnenkomen en hoe actiever deze worden geproduceerd, hoe meer vrije radicalen worden gevormd, hoe sterker hun destructieve effect. En het is niet zo belangrijk of energie wordt geproduceerd uit glucose, lipiden of aminozuren; wat belangrijk is, is hun totale hoeveelheid.
De resulterende vrije radicalen beschadigen alle eiwitten, inclusief de eiwitten van de mitochondriën zelf, wat leidt tot afbraak van de binnenste laag van het membraan en verstoring van het proces van oxidatieve fosforylatie. Daarom kan de energieproductie door OF zelfs met een grote hoeveelheid binnenkomende grondstoffen dalen. Onverwerkte overtollige grondstoffen hopen zich op in de interne ruimte van de cel, waardoor de werking ervan wordt verstoord. Oxidatieve stress in de mitochondriën veroorzaakt ook instabiliteit van het mitochondriale en zelfs nucleaire genoom, en verhoogt de expressie van oncogenen. Bovendien veroorzaken hoge concentraties oxidanten een cascade van gebeurtenissen die de proteasoomactiviteit en de telomeerlengte verminderen en de immuunfunctie aantasten.
Omdat de vorming van vrije radicalen een net zo natuurlijk fenomeen is in het energieproductieproces als de productie van rook door het verbranden van hout, beschikt de cel over natuurlijke afweermechanismen om deze te neutraliseren. Dit is in de eerste plaats glutathion, de krachtigste intracellulaire antioxidant. Onvoldoende productie van glutathion, of de uitputting ervan als gevolg van een groot aantal oxidanten, of beide, zal leiden tot verslechtering van OF.
Naast oxidatieve schade kunnen mitochondriën andere aanvallen ondergaan die leiden tot een verzwakking van het OF-proces en tot een verdere toename van het niveau van vrije radicalen en andere mitochondriale toxines, zoals cyanide. Dit verergert de situatie nog verder en versnelt een destructieve vicieuze cirkel *. Tegelijkertijd worden de mitochondriale functies, waaronder de ATP-productie, op natuurlijke wijze onderdrukt, wat de ernstigste gevolgen met zich meebrengt.
Mitochondriale toxiciteit kan door bepaalde geneesmiddelen worden veroorzaakt, via verschillende mechanismen, zoals uitputting van mitochondriaal DNA (bijv. nucleoside reverse transcriptaseremmers), remming van bèta-oxidatie van vetzuren (bijv. valproïnezuur), opening van overgangsporiën voor de permeabiliteit van de mitochondriën (bijv. antracyclines), creatie van oxidatieve stress en uitputting van mitochondriaal glutathion (bijv. paracetamol), ontkoppeling van elektronentransport van ATP-synthese (bijv. tamoxifen) en remming van mitochondriale elektronentransportketencomplexen (bijv. statines) *.
Een aanzienlijk deel van de energie die door de mitochondriën wordt geproduceerd, wordt besteed aan de werking van ionenpompen die in het celmembraan * zijn ingebouwd en die een evenwicht handhaven tussen intracellulaire ionen (kalium en magnesium) en extracellulaire (calcium en natrium). Het kwantitatieve verschil in natrium- en kaliumionen aan beide zijden van het celmembraan creëert een bepaald elektrisch potentieel, dat veel cellulaire functies ondersteunt.
Door gebrek aan energie neemt het rendement van de membraannatrium-kaliumpompen af. Het intracellulaire niveau van natriumionen ten opzichte van kaliumionen neemt toe, wat de functie van celmembranen negatief beïnvloedt. Door de onbalans van natrium- en kaliumionen neemt de elektrische potentiaal op het membraan van de transformerende cel af, waardoor er een steeds negatiever veld omheen ontstaat. Dit verslechtert de functionele toestand van de cel. Bovendien verkrijgt zo'n cel het vermogen om negatief geladen medicijnen en cellen zoals rode bloedcellen en lymfocyten af te weren, waardoor wordt voorkomen dat zuurstof en het immuunsysteem de tumor aanvallen.
Een ander deel van de energie van de cel wordt besteed aan de synthese van enzymen, waardoor chemische reacties in de cel beheersbaar worden. Het ontbreken van bepaalde enzymen desorganiseert de KC en OF verder. Wanneer de toevoer van glucose en andere energiebronnen naar de cel voldoende is, maar de mitochondriën niet in staat zijn om het vereiste energieniveau te leveren, wordt de cel gedwongen zich te wenden tot een ouder en minder winstgevend principe van energieproductie. Dat wil zeggen, het verhoogt de glycolyse en fermentatie *. En dit is een van de eerste stappen in de kwaadaardige degeneratie van een cel.
Een groot energietekort dwingt de productie af van alleen die enzymen die alleen nodig zijn voor het voortbestaan van de cel. Met een afname van de energietoevoer verslechteren cellulaire functies van mitochondriën zoals differentiatie, remming van celgroei en apoptose. Door apoptose worden abnormale cellen afgestoten, waardoor het kankerproces wordt voorkomen. Maar als apoptose niet goed werkt, kunnen dergelijke cellen in leven blijven en nakomelingen reproduceren met dezelfde defecte mitochondriën.
Bovendien moet de cel van een meercellig organisme zijn gedrag coördineren met andere cellen. Dit doet ze door de kleinste nuances in de concentratie van chemische signalen en elektrische velden vast te leggen. De werking van dergelijke sensorische mechanismen vereist ook energieverbruik. Hoe sterker het energietekort in de cel, hoe slechter de communicatie van de cel, hoe minder hij reageert op sociale eisen, hoe zwakker hij reageert op signalen die de ongebreidelde groei tegenhouden, hoe dieper hij vervalt in het egoïstische gedrag van zijn eencellige voorouder, en hoe meer kankerachtige tekenen die het verkrijgt.
Zowel slecht functionerende mitochondriën als een klein aantal daarvan dragen bij aan de omschakeling van het celfenotype naar een kwaadaardig fenotype. In kankercellen kan er sprake zijn van een daadwerkelijke toename van het aantal mitochondriën om het verlies aan mitochondriale functie te compenseren *. Dergelijke inspanningen kunnen het energieprobleem echter niet fundamenteel oplossen totdat de fundamentele oorzaken zijn geëlimineerd. Zonder dit zullen de mitochondriën, zelfs als er een groot aantal zijn, defect blijven.
Aldus kan een langdurige disfunctie van de mitochondriën, die zich manifesteert in de vorm van een tekort aan oxidatieve fosforylering, in combinatie met verhoogde glycolyse en glutaminolyse, ertoe leiden dat de cel in een stabiele staat van ongecontroleerde proliferatie terechtkomt – met verder verlies van differentiatie, met weerstand tegen apoptose, en met andere karakteristieke tekenen van een kankercel. Bovendien wijst steeds meer bewijs erop dat veranderingen in de mitochondriën niet alleen bijdragen aan de kwaadaardige transformatie van cellen, maar ook aan het angiogenetische, invasieve en metastatische gedrag van kankercellen *.
Mitochondriale disfunctie is een significant signaal van veroudering en een kenmerk van vrijwel alle degeneratieve ziekten *, niet alleen kanker * *. De verslechtering van de mitochondriale functie naarmate de jaren verstrijken, wordt niet alleen bij mensen waargenomen, maar ook bij andere dieren. We kunnen de mitochondriale gezondheid echter tot op zekere hoogte verbeteren. Mitochondriale ademhaling kan op verschillende manieren worden verbeterd, zoals het verminderen van oxidatieve stress; een toename van het aantal mitochondriën; normalisatie van hun metabolisme; mogelijkheid om defecte componenten te vervangen; mitofagie en apoptose *.
Sommige supplementen kunnen de mitochondriale functie helpen verbeteren * *. Ze kunnen de oxidatieve belasting verminderen, extra mogelijkheden bieden voor oxidatieve fosforylering, lekkende mitochondriale membranen versterken en disfunctionele mitochondriën verwijderen.
Cofactoren en antioxidanten:
• Co-enzym Q10 (CoQ10) is betrokken bij de productie van mitochondriaal ATP, namelijk in het OF-stadium. CoQ10-suppletie verhoogt de productie van mitochondriale cellulaire energie, evenals het aantal en de activiteit van macrofagen en T-cellen*, en de niveaus van immunoglobuline G (GIg)-antilichamen * * *.
Het beste is CoQ10 van het Japanse bedrijf Kaneka, dat wordt gewonnen uit paddenstoelen. Voedingsmiddelen die rijk zijn aan CoQ10 zijn onder meer zalm, orgaanvlees, volle granen, pinda's, pistachenoten, walnoten, hazelnoten, sesamzaad, sojabonen, olijfolie, avocado, broccoli en spinazie.
In combinatie met creatine (2×3'000 mg) en liponzuur (2×300 mg) verhoogt CoQ10 (2×120 mg) de mitochondriale ATP-productie bij patiënten en verlaagt het de plasmalactaatconcentraties *. In deze combinatie verbetert CoQ10 de functie van de elektronentransportketen, werkt liponzuur als een antioxidant en werkt creatine als een energiebuffer.
Een andere CoQ10-booster kan mumijo zijn (200 mg/dag), waardoor het co-enzym zijn antioxiderende eigenschappen langer behoudt *.
De endogene CoQ10-niveaus nemen af met de leeftijd, dus exogene CoQ10-suppletie zou de mitochondriale functie kunnen verbeteren en de activiteit van het mitochondriale complex I in de elektronentransportketen kunnen verhogen. Dosering van mumijo: 3×100 mg ter preventie en 3×200 mg tijdens de behandeling *.
• Nicotinamide-riboside is een vorm van vitamine B3, een metabolische voorloper van NAD+, die een cofactor is in meer dan 200 cellulaire redoxreacties, waaronder de productie van mitochondriale ATP. Door de mitochondriale functie te verbeteren, worden verouderende stamcellen van verschillende weefsels jeugdiger wanneer het niveau van NAD+ in de cellen toeneemt * *.
Hogere niveaus van NAD+ in cellen correleren met betere gezondheidsresultaten *, en omgekeerd dragen lagere niveaus van NAD+ bij aan de ontwikkeling van veel degeneratieve ziekten *. Met de leeftijd neemt de NAD+-concentratie geleidelijk af: op de leeftijd van 80 jaar daalt deze met 90-95% vergeleken met de leeftijd van 21 *. Suppletie met nicotinamide-riboside (2×500 mg/dag) herstelt echter snel de NAD+-waarden in het bloed naar waarden op jongere leeftijd. Vergeleken met de placebogroep verhoogde nicotinamide-riboside 300 mg/dag de cellulaire NAD+-waarden bij oudere volwassenen met 51% en verhoogde ook de glutathion-waarden en verlaagde de vermoeidheidsscores *.
Omdat NAD+ een endogene stof is, brengt suppletie op oudere leeftijd de NAD+-niveaus effectief terug naar het niveau van de jeugd. Terwijl CoQ10, door het toevoegen van energie, tegelijkertijd het aantal vrije radicalen in de mitochondriën kan verhogen, vermindert nicotinamide daarentegen hun aantal *. Aangenomen kan worden dat een combinatie van beide een beter effect zal hebben dan CoQ10 alleen.
• N-acetylcysteïne (NAC) is een voorloper van glutathion. Het verhoogt de activiteit van de mitochondriale complexen I, IV en V; versterkt het mitochondriale membraan en verbetert de mitochondriale homeostase *. Dosering: 250-1'800 mg/dag * * (meestal 600 mg/dag). N-acetylcysteïne wordt slecht geabsorbeerd, dus het wordt aanbevolen om de liposomale vorm (2×250 mg) of S-acetylglutathion (2×100 mg) in te nemen.
Het gebruik van glutathionvoorlopers is beter dan het gebruik van glutathion zelf (geïnhaleerd of intraveneus). In het eerste geval produceert het lichaam precies zoveel glutathion als het nodig heeft. In het tweede geval kan glutathion te weinig of te veel zijn.
Door de combinatie van NAC met glycine kun je de concentratie glutathion in de mitochondriën verhogen en de cellen vullen met jongere en efficiëntere mitochondriën. Tegelijkertijd worden oxidatieve stress en ontstekingsindicatoren verminderd en wordt het vetmetabolisme in de cel verbeterd. Dit werd overtuigend bewezen in een klassiek dubbelblind, gerandomiseerd klinisch onderzoek dat 16 weken duurde *. Hier bedroeg de dagelijkse dosering NAC en glycine elk 100 mg per kilogram patiëntgewicht; dat wil zeggen 6 gram voor een gewicht van 60 kg, wat tweemaal de dagelijkse behoefte aan glycine is. Interessant genoeg werden de positieve effecten van de supplementen alleen bij oudere mensen gezien, maar niet bij jongere mensen.
• Alfaliponzuur (ALA) is een sterke antioxidant en tevens een chelator van metaalionen zoals koper en ijzer. Het fungeert als een kritische cofactor voor mitochondriale processen en verhoogt de concentratie van mitochondriale antioxidanten glutathion en vitamine C.
Het consumeren van alfaliponzuur (2×500 mg) verhoogt het mitochondriale membraanpotentieel en beschermt ook DNA en celmembranen tegen door inspanning veroorzaakte oxidatieve stress *.
• Melatonine (3 mg voor het slapengaan, maar niet meer dan 15 mg) is een breedspectrum niet-steroïde hormoon dat de mitochondriale functie effectief beschermt *.
Melatonine bevordert de omschakeling van glycolytische naar mitochondriale cellulaire energieproductie. In één klinische studie ging melatonine effectief oxidatieve stress en mitochondriale disfunctie tegen die werden veroorzaakt door sepsis *.
Melatonine kan echter het beste alleen worden ingenomen bij slaapproblemen.
Vitamines en mineralen:
• Pyrrolochinolinechinon (PQQ), ook bekend als methoxanthine, beschermt de mitochondriën tegen oxidatieve schade *,
verhoogt de efficiëntie van de mitochondriën dankzij hun verjonging en verhoogde activiteit * * *.
Bovendien verhoogt methoxanthine het hemoglobinegehalte en verlaagt het de plasmaconcentraties van IL-6 en CRP *.
Het toevoegen van methoxanthine aan het dieet van dieren verhoogt het aantal mitochondriën in hun cellen * *.
Het innemen van 20 mg methoxanthine per dag gedurende 12 weken helpt de achteruitgang van de hersenfunctie bij oudere volwassenen te voorkomen, vooral met betrekking tot de aandacht en het werkgeheugen *,
en vermindert ook de lipoproteïnewaarden met lage dichtheid in het bloed vergeleken met controles *.
Dosering: 15-25 mg/dag *.
PQQ veroorzaakt geen acute toxiciteit bij doseringen tot 60 mg/dag.
• Vitamine C (3×300 mg) *;
vitamine E; B-vitamines *:
thiamine (100 mg/dag) * *,
riboflavine (100 mg/dag) *,
niacine (50 mg/dag), pantotheenzuur (50 mg/dag), biotine (30 μg/dag); magnesiumcitraat (3×500 mg) *;
gemengde fosfolipiden (2×1'000 mg) * *;
barnsteenzuur (125 mg/dag); ginkgo biloba (40 mg/dag); succinaat (125 mg/dag) kan ook de mitochondriale functie op verschillende manieren verbeteren *.
Dit geldt echter blijkbaar voor die gevallen waarin de inname van deze stoffen uit voedsel onvoldoende is.
Mengsels van verschillende van deze antioxidanten zijn waarschijnlijk effectiever dan elk afzonderlijk *.
Er zijn echter nog steeds te weinig klinische onderzoeken waarin de combinaties ervan worden geëvalueerd * * *.
Hoewel vitamine- en mineralensupplementen doorgaans alleen helpen bij een tekort, is dit een aandoening die vaker voorkomt bij kankerpatiënten.
• Calcium en magnesium zijn belangrijk voor de productie van energie door de mitochondriën, dus je moet ervoor zorgen dat ze via de voeding voldoende aan het lichaam worden geleverd.
• Lithium verbeterde de mitochondriale functie in preklinische onderzoeken * *. Er is echter nog geen bewijs geleverd voor de voordelen ervan bij kanker.
Lipiden en transporters:
• Ω-3-vetzuren (3×1'000 mg) helpen de integriteit van het mitochondriale membraan te behouden en te herstellen van oxidatieve schade.
• Middellange keten vetzuren (MCFA's) zorgen, vergeleken met lange keten vetzuren, voor een betere mitochondriale ademhalingscapaciteit zonder de oxidatieve stress te verhogen *.
• L-carnitine helpt de doorgang van vetzuren door het binnenste mitochondriale membraan. Het helpt de energieproductie uit vetzuren te verhogen, beschermt de mitochondriën tegen oxidatieve stress en verhoogt ook de snelheid van oxidatieve fosforylatie in de mitochondriën *.
Klinische onderzoeken tonen een toename van de mitochondriale functionaliteit aan als gevolg van de inname van 1-2 g/dag L-carnitine * * *
(meestal 3×500 mg).
• Acetyl-L-carnitine is een effectievere versie van L-carnitine. Het werkt synergetisch met alfaliponzuur en verjongt de afgeleefde mitochondriën. Dosering: 300-3'000 mg/dag (meestal 3×250 mg).
Mitochondriale modulatoren:
• Metformine is eigenlijk een mitochondriaal toxine. Het maakt het moeilijk om oxidatieve fosforylering te laten werken, wat het tegenovergestelde lijkt te zijn van wat we nodig hebben. Metformine elimineert echter de zwakste mitochondriën. Er wordt aangenomen dat vernietigde mitochondriën vervolgens worden vervangen door jongere en betere. Hierdoor neemt de energieproductie via OF toe en neemt de negatieve impact van niet-functionele mitochondriën af.
Bij de maximaal toegestane dosis voor diabetes (36 mg/kg) helpt metformine dus de kwaliteit van de mitochondriën in de cel te verbeteren *. Stoffen met vergelijkbare eigenschappen die de werking van de mitochondriën van kankercellen helpen verbeteren, worden mitokana genoemd (een afkorting voor de woorden mitochondriën en kanker).
Een andere verklaring voor de paradox waarom mitochondriale toxines het tegenovergestelde effect hebben, is de theorie van hormese. Volgens dit concept induceren lage toxische doses gunstige compenserende reacties die verder gaan dan het herstel van de onderliggende verwonding en feitelijk resulteren in een verbeterde cellulaire fitheid in vergelijking met de uitgangssituatie.
Vergeleken met de controlegroep ervoeren premenopauzale patiënten die langdurig metformine gebruikten (1'500 mg/dag gedurende 16 weken) een toename van het mitochondriale zuurstofverbruik, een toename van het membraanpotentieel, een toename van de mitochondriale massa en een afname van de concentratie van vrije radicalen *.
Bovendien bootst metformine via andere mechanismen enkele van de biologische voordelen na die worden bereikt door caloriebeperking (betere fysieke prestaties, verhoogde insulinegevoeligheid, verlaagd lipoproteïne met lage dichtheid en cholesterol) zonder de calorie-inname daadwerkelijk te verminderen.
Zoals we kunnen zien, werkt metformine in een richting die tegengesteld is aan die van andere mitochondriale modulatoren. CoQ10 is bijvoorbeeld een actieve speler in de elektronentransportketen en metformine blokkeert de elektronentransportketen. Er rijst een terechte vraag: is het mogelijk om bijvoorbeeld metformine te combineren met het CoQ10? Sommige dierstudies suggereren dat CoQ10 en metformine elkaar niet beïnvloeden * *. Het lijkt erop dat terwijl metformine cellen met zwakke mitochondriën verwijdert, CoQ10 cellen met min of meer functionele mitochondriën versterkt. Deze vraag blijft echter nog steeds open.
• Urolithine A bevordert, net als metformine, de dood van disfunctionele mitochondriën. De werking van beide stoffen kan worden vergeleken met de werking van roofdieren in wilde dieren, die doorgaans bijdragen aan het voortbestaan van de biologische soort van hun prooi door de zwakste individuen te vernietigen.
Een gecontroleerde klinische studie van 4 maanden toonde aan dat suppletie met urolithine A (Mitopure™) van 500-1'000 mg/dag bij oudere volwassenen (40-64 jaar) de mitochondriale functie licht verbeterde. Dit kwam tot uiting in verhoogde spierkracht, prestaties en piekzuurstofverbruik. Bovendien verlaagde urolithine A de niveaus van ontstekingsmarkers zoals C-reactief proteïne *. Een ander 4 maanden durend gecontroleerd klinisch onderzoek bij oudere volwassenen (65-90 jaar oud) liet vergelijkbare resultaten zien. Het innemen van 1'000 mg/dag urolithine A in vergelijking met placebo verhoogde het spieruithoudingsvermogen en verlaagde de C-reactieve proteïnespiegels, hoewel deze veranderingen niet significant waren *.
In het menselijk lichaam wordt urolithine A op natuurlijke wijze geproduceerd uit ellaginezuur en zijn derivaten met behulp van darmbacteriën. Rijke bronnen van voorlopers van urolithine A zijn onder meer voedingsmiddelen zoals granaatappel, aardbeien, walnoten, frambozen en amandelen. Niet alle darmbacteriën dragen echter bij aan de productie van urolithine. Uit één onderzoek bleek dat mensen met een hogere Firmicutes:Bacteroidetes-ratio en meer Clostridiales, Ruminococcaceae en Akkermansia muciniphilia betere producenten van urolithine A zijn *.
Een groot deel van de bevolking ervaart een verslechtering van de verhouding Firmicutes:Bacteroidetes-bacteriën ten gunste van de laatste. Het normaliseren van het evenwicht tussen deze twee groepen bacteriën zou ongetwijfeld aanzienlijke voordelen opleveren. Vanuit praktisch oogpunt is het echter moeilijk om de darmmicroflora te corrigeren, net zoals het moeilijk is om de resultaten van deze correctie te controleren. Supplementen met urolithine A lijken dus een betrouwbaardere en effectievere manier om de concentratie ervan in het lichaam te verhogen.
• Betaïne, ook bekend als trimethylglycine, waar rode bieten rijk aan zijn, stimuleert in vitro een toename van het aantal en de activiteit van de mitochondriën *, en leidt tot een verhoogde mitochondriale ademhaling *.
Combinaties van enkele van de bovengenoemde middelen hebben klinische onderzoeken ondergaan. In een onderzoek van twee maanden verbeterden patiënten met hardnekkige chronische vermoeidheid hun vermoeidheidsscores met een derde bij het innemen van een complex bestaande uit membraanfosfolipiden (2'000 mg/dag), CoQ10 (35 mg/dag), micro-ingekapseld NADH (35 mg/dag) , L-carnitine (160 mg/dag), α-ketoglutaarzuur (180 mg/dag), evenals lipiden en andere additieven * *.
Fysieke activiteit. De functionaliteit van de mitochondriën kan worden verbeterd en behouden door autofagie te stimuleren, maar ook door de calorie-inname en matige lichamelijke activiteit te verminderen * *. Een toename van lichamelijke activiteit leidt inderdaad tot meer autofagie * * en een toename van de energievraag, wat een efficiëntere werking van de mitochondriën betekent. Dit stimuleert cellen om het aantal en de kwaliteit van de mitochondriën te verhogen.Hoe ongelooflijk het ook mag klinken, één onderzoek rapporteerde een verband tussen positieve emoties en het vermogen van de mitochondriën om energie te produceren*. Een verhoogde positieve stemming verhoogde de enzymatische activiteit van de mitochondriale ademhalingsketen, evenals het aantal kopieën van mitochondriaal DNA. De psychologische toestand van mensen in de drie dagen voordat bloed werd afgenomen voorspelde hun mitochondriale gezondheidsindex, maar niet andersom, wat duidt op een oorzaak-en-gevolg-relatie.
Bovendien kunnen stressverminderende praktijken zoals meditatie of yoga en voldoende slaap nuttig zijn. Een gezond dieet, ontgifting en het verminderen van ontstekingen en de daarmee samenhangende oxidatieve stress beschermen ook de mitochondriën tegen chemische schade die het aantal mitochondriale DNA-kopieën en de ATP-productie vermindert. Methoden voor het verminderen van ontstekingen zullen worden besproken in de sectie «Verminderde ontstekingen» †.
Emotionele achtergrond. Hoe ongelooflijk het ook mag klinken, één onderzoek rapporteerde een verband tussen positieve emoties en het vermogen van de mitochondriën om energie te produceren *. Een verhoogde positieve stemming verhoogde de enzymatische activiteit van de mitochondriale ademhalingsketen, evenals het aantal kopieën van mitochondriaal DNA. De psychologische toestand van mensen in de drie dagen voordat bloed werd afgenomen voorspelde hun mitochondriale gezondheidsindex, maar niet andersom, wat duidt op een oorzaak-en-gevolg-relatie.
In dit geval werden de mitochondriën van immuuncellen (leukocyten) bestudeerd, wat rechtstreeks verband kan houden met hun vermogen om ziekteverwekkers te vernietigen. Maar zoals je zou kunnen aannemen, kan de mitochondriale gezondheid van andere cellen in het lichaam ook afhangen van de emotionele stemming van een persoon via een complex systeem van hormonale en andere cellulaire communicatie.
Caloriebeperking. De mitochondriën van kankercellen zijn niet in staat voldoende energie te produceren vanwege structurele en/of functionele afwijkingen *. Hoewel kankercellen de energieproductie aanzienlijk verhogen door middel van glycolyse, is de mitochondriale energieproductie nog steeds van cruciaal belang voor hen. Een verdere afname van de energie van kankercellen kan tot hun dood leiden, en de tumor kan tot een afname van de groeisnelheid leiden.
Meer dan 30 jaar onderzoek levert overtuigend bewijs dat caloriebeperking de krachtigste en breedst effectieve voedingsinterventie lijkt te zijn voor het onderdrukken van carcinogenese *. Metabolische overbelasting van voedingsstoffen veroorzaakt defragmentatie van het mitochondriale netwerk, terwijl intermitterend vasten autofagie induceert, waardoor disfunctionele mitochondriën worden verwijderd.
Redelijkerwijs kan worden aangenomen dat overtollige calorieën en gebrek aan zuurstof de remming van celproliferatie aanzienlijk verzwakken en de vorming van een kankercelfenotype versnellen. Aan de andere kant remt een gebrek aan calorieën en een overvloed aan zuurstof de celgroei en stimuleert autofagie, waardoor slecht functionerende organellen en cellen, waaronder kankercellen, worden verwijderd.
Theoretische modellen laten inderdaad zien dat een verhoogde toevoer van weefselbrandstof leidt tot de snelle manifestatie van kenmerken van kankercellen, zoals ongebreidelde groei en weefselinvasie *. Als bij een tekort aan glucose het concurrentievoordeel aan de kant van de cellen met een zuinigere aerobe ademhaling ligt, dan ligt dat bij een overvloed aan glucose aan de kant van de cellen met een snellere anaerobe ademhaling *.
Met andere woorden: onbeperkte hulpbronnen bevorderen de verspreiding van het kankerfenotype, terwijl beperkte hulpbronnen dit voorkomen. Gebaseerd op dit principe zou energiegebrek niet alleen het risico op kanker moeten verminderen, maar ook helpen kankercellen te onderdrukken en hen te neigen tot mitochondriale ademhaling.
Het beperken van de aanvoer van grondstoffen voor energieproductie naar cellen vertraagt de groei en ontwikkeling van vele soorten kanker, waaronder borstkanker, aanzienlijk *. Tegelijkertijd daalt niet alleen het niveau van insuline, maar ook het niveau van de groeifactor IGF-1, die de stofwisseling en groei van tumorcellen stimuleert *. Hoewel elk therapeutisch middel zich op één of meer doelen richt, omvat de beperking van de cellulaire energie een reeks therapeutische doelen, waaronder ontstekingen en angiogenese * *.
Je kunt de energiebronnen van cellen beperken met behulp van de volgende technieken:
Vermindering van het volume en het caloriegehalte van voedsel. Caloriebeperking kan downregulatie van meerdere genen en metabolische routes veroorzaken die de glycolyse reguleren *. Het fysiologische minimum aanbevolen door het Amerikaanse Bureau voor ziektepreventie en gezondheidsbevordering (The Office of Disease Prevention and Health Promotion) voor vrouwen met een gemiddeld postuur is ~1'600 kcal/dag *, deze waarde moet echter worden aangepast afhankelijk van leeftijd, lengte, lichaamsgewicht en niveau van lichamelijke activiteit *. Bij een gegeven minimumniveau mag het maximale caloriegehalte van de dagelijkse voeding niet hoger zijn dan 2.400 kcal/dag. Het is dit bereik van dagelijkse caloriewaarden dat geassocieerd wordt met de laagste morbiditeitscijfers *.
Maar zelfs een caloriearm dieet moet voedzaam zijn. Als voedsel niet voldoende essentiële stoffen kan leveren, zullen deze in de vorm van supplementen moeten worden ingenomen. Dit geldt vooral voor riboflavine, nicotinamide, pantotheenzuur en andere vitamines en enzymen die betrokken zijn bij de mitochondriale functie.
Omdat vetten het hoogste caloriegehalte hebben en koolhydraten het minste, is het het gemakkelijkst om uw calorie-inname uit vet te verminderen.
Verslechtering van de opname van koolhydraten in de darmen. Er zijn verschillende medicijnen ontworpen voor gewichtsverlies, gebaseerd op het principe van het verminderen van de opname van koolhydraten uit voedsel.
De bekendste en meest bestudeerde daarvan is metformine. Andere natuurlijke remmers van de glucoseopname, zoals resveratrol, fisetine, myricetine, quercetine, apigenine, cyanidine, daidzeïne, hesperetine, naringenine, catechine *, genisteïne * en silibinine * hebben in preklinische onderzoeken vergelijkbare effecten aangetoond. In vergelijking met metformine hebben ze echter allemaal een lage effectiviteit.
Remming van de glucoseproductie in de lever (remming van gluconeogenese)
Het meest toegankelijke, geteste en veilige medicijn dat de gluconeogenese vermindert, is metformine.
Uitputting van het glucosegehalte in het bloed als gevolg van toegenomen consumptie. Spiercellen gebruiken glucose als hun belangrijkste energiebron, en neuronen in de hersenen gebruiken glucose als hun enige energiebron. Het verhogen van de fysieke en mentale activiteit zal dus de glucoseconsumptie verhogen en de insulinespiegels in het bloed verlagen. Consequent lage glucose- en insulineniveaus zullen op hun beurt helpen een optimale mitochondriale gezondheid te behouden.
Er is opgemerkt dat borstkliercellen onder hypoxische omstandigheden een grote hoeveelheid energie accumuleren in de vorm van glycogeen, wat de cellen helpt beschermen tegen oxidanten en proliferatie. Bovendien geldt: hoe agressiever de tumor, hoe meer glycogeen zich daarin ophoopt *. De specifieke glycogeenreserves in een agressieve tumor kunnen vergelijkbaar zijn met de reserves in de lever. Door het vermogen om deze energie te gebruiken uit te schakelen met behulp van glycogeenfosforylase (een remmer van het enzym dat verantwoordelijk is voor de afbraak van glycogeen) worden kankercellen veel minder agressief *. Opmerkelijk is dat alleen de isovorm van het enzym dat kenmerkend is voor de hersenen en niet voor de lever hier effectief is. Hoe verleidelijk een dergelijk voorstel ook is, de praktische toepassing ervan is nog ver weg.
Beperking van de toegang van glucose tot de cel. Glucose wordt naar de cellen getransporteerd met behulp van de passieve membraantransporter GLUT of de ATP-afhankelijke en natriumafhankelijke transporter SGLT. Door het werk van deze transporters te verlammen, is het mogelijk de glucosestroom naar de cel te verminderen. Er zijn verschillende kruidengeneesmiddelen die de werking van glucosetransporters in vitro enigszins kunnen remmen.
Dit zijn catechine, daidzeïne, hesperetine, fisetine, naringenine *
en andere flavonoïden. De werkingsmechanismen van natuurlijke remmers kunnen echter aanzienlijk verschillen.
Genisteïne bindt zich bijvoorbeeld aan de GLUT1-transporter op het buitenoppervlak, terwijl quercetine interageert met het binnenoppervlak *.
Quercetine en EGCG *, luteoline, kaempferol *,
silibinine en theaflavine remmen de door insuline gestimuleerde glucoseopname.
Het lijkt erop dat hun combinatie effectiever zal zijn dan elk van de remmers alleen.
Ondanks de logica van het voorstel om de glucosestroom naar de cellen te beperken, zal insuline bij hoge concentraties glucose in het bloed krachtig protesteren tegen een dergelijke beslissing. Omdat het zijn taak is om het glucosegehalte in het bloed tot een acceptabel niveau te verlagen en het in de cellen te duwen. Als we het voor cellen moeilijker kunnen maken om glucose te importeren, kunnen we hoge niveaus van zowel glucose als insuline in het bloed hebben. Dat wil zeggen, we zullen symptomen van diabetes type II creëren. Dit betekent dat het beperken van glucose in de cel alleen mogelijk is op voorwaarde dat de concentratie ervan in het bloed binnen een veilig bereik ligt.
Onderdrukking van het glycolyseproces in cellen vermindert de hoeveelheid grondstoffen voor energieproductie. Zoals eerder vermeld, zal een gebrek aan energie de deling van kankercellen vertragen, en een ernstig tekort zal celdood veroorzaken.
Momenteel wordt een beperkt aantal speciaal ontworpen glycolyseremmers gebruikt, en deze hebben allemaal bepaalde nadelen.
• Imatinib is een tyrosinekinaseremmer. Het remt de activiteit van het eerste enzym in de metabolische keten van glycolyse, hexokinase, dat alle andere enzymatische omzettingen van glucose in pyruvaat blokkeert. Bovendien remt imatinib de activiteit van receptoren voor de van bloedplaatjes afgeleide groeifactor (PDGF) en stamcelfactor (SCF). Goedgekeurd voor klinisch gebruik bij leukemie. Remming van hexokinase is, in vergelijking met remming van andere glycolytische enzymen, voordeliger omdat hexokinase celapoptose kan blokkeren.
Lonidamine *
remt ook hexokinase.
• 3-broompyruvaat (3-BrPA) is een klinisch gebruikt geneesmiddel dat de hexokinase-activiteit remt. Tegenwoordig is het het krachtigste klinisch gebruikte middel voor het remmen van de anaërobe ademhaling. Broompyruvaat is krachtiger in het remmen van de ademhaling in kankercellen, omdat normale cellen veel minder transporters hebben die in staat zijn 3-BrPA naar de cellen te verplaatsen.
• Clotrimazol, gebruikt bij antischimmeltherapie, verdringt in vitro hexokinase uit het mitochondriale membraan en remt ook andere glycolytische enzymen – aldolase en fosfofructokinase * *. Clotrimazol vermindert in vitro de snelheid van lactaatproductie door tumorweefsels van de borstklier sterk (tot 85%), zonder de lactaatproductie door normale weefsels en de glucoseconsumptie door zowel controle- als tumorweefsels te beïnvloeden *. De resultaten van preklinische onderzoeken suggereren dat hoe agressiever de kankercel is, hoe effectiever clotrimazol ertegen is.
Dagelijkse subcutane injecties van clotrimazol (120 mg/kg gedurende 10 weken) verminderden het aantal longmetastasen bij immuundeficiënte muizen aanzienlijk *. Op menselijke schaal komt deze dosering overeen met ongeveer 700 mg/dag. De combinatie van clotrimazol en imatinib remde in vitro synergetisch de groei van borstkankercellen (T47D) bij muizen *.
• Vitamine C in zeer hoge doses remt het glycolytische enzym GAPDH (zesde stap van de glycolyse) en put cellulair glutathion uit, wat leidt tot energiegebrek en oxidatieve stress *. Intraperitoneale injecties van vitamine C (4 g/kg) verminderden de tumorgroei bij muizen aanzienlijk in vergelijking met controles *. De injectiedosering die equivalent is aan een dosis voor de mens zal ongeveer 25 g/dag zijn. Dergelijke overdoses zijn alleen op korte termijn acceptabel, bijvoorbeeld als aanvulling op bestraling of chemotherapie.
• Stiripentol (een anti-epilepticum) vertoonde in vitro een sterke remming van de glycolyse * en remming van de vorming van mammosfeer door MCF-7-cellen (IC50=100-200 μM).
• Oroxyline A is een flavonoïde uit de wortel van Glidkruid (Scutellaria baicalensis), dat in vitro (150 μM) glycolyse in borstcarcinoomcellen remt door hexokinase-II (HKII) te blokkeren * *.
Wogonine, een andere flavonoïde uit de wortel van het glidkruid, remt in vitro (2 μM), naast hexokinase, lactaatdehydrogenase, pyruvaatdehydrogenasekinase *,
evenals pyruvaatkinase (PK) *.
• Methylglyoxal *, alizarine *, shikonine * remmen de glycolyse in vitro (door andere glycolytische enzymen te remmen).
Het meest aantrekkelijk is het gebruik van hexokinaseremmers, omdat dit direct de aanmaak van zowel energie als bouwstof voor de vorming van een dochtercel verhindert.
Het probleem met het remmen van de glycolyse is dat de glucose die door de cel wordt opgenomen, in plaats van te worden besteed aan energieproductie, zich in de cel zal ophopen met alle negatieve gevolgen van dien. Om dit te voorkomen, kan een dergelijke therapie alleen worden gebruikt met een gelijktijdige vermindering van de totale calorische inhoud van het geconsumeerde voedsel.
Onderdrukking van alternatieve metabolische routes voor energieproductie. Ondanks de aanzienlijke afhankelijkheid van kankercellen van glycolyse, heeft de onderdrukking ervan onvoldoende effect op het remmen van de tumorgroei. Het beperken van de glucose-inname heeft zijn grenzen, en bovendien is glucose niet de enige bron van grondstof voor de productie van ATP. Als er een tekort aan glucose is, kunnen cellen alternatieve, minder efficiënte energiebronnen gebruiken, voornamelijk aminozuren en lipiden. Cellen vertonen over het algemeen buitengewone capaciteiten om energie te onttrekken aan beschikbaar materiaal, waaronder melkzuur *, ketonen * en tot nu toe onbekende bronnen *.
Verminderde ATP-productie uit glutamine. Prolifererende/glycolytische cellen schakelen gemakkelijk over van glucose naar aminozuurgrondstoffen, voornamelijk glutamine.
Glutamine kan door cellen worden gebruikt voor de productie van mitochondriale energie door middel van oxidatieve fosforylering. Net als andere energiebronnen komt glutamine de mitochondriën binnen, waar het deelneemt aan een reeks enzymatische reacties die de Krebs-cyclus worden genoemd. Moleculen die tijdens deze cyclus worden gevormd, zijn elektronendonoren voor het proces van oxidatieve fosforylatie (OF). Tijdens OF hoopt energie zich op in de fosfaatbindingen van het ATP-molecuul en wordt vervolgens besteed aan de behoeften van de cel.
Idealiter kan uit 1 glucosemolecuul dat de cel binnenkomt (gesplitst in 2 pyruvaatmoleculen) energie voor 38 eenheden ATP worden verkregen; hiervan worden er 8 geladen tijdens de glycolyse (2 direct en 6 indirect), 6 tijdens de omzetting van pyruvaat in acetyl-CoA en nog eens 24 tijdens OF. De uiteindelijke metaboliet bestaat uit 6 moleculen water en 6 moleculen kooldioxide. Hoewel kankercellen gewoonlijk worden uitgeschakeld door OF vanwege een slecht functionerende elektronentransportketen, behouden ze de functionaliteit van Krebs-cyclusenzymen. Daarom krijgt glutamine de kans om ATP-moleculen op te laden via de zogenaamde substraatfosforylering tijdens de omzetting van succinyl-CoA ⇒ succinaat (FTP). Deze reactie is enzymatisch, er is dus geen zuurstof voor nodig.
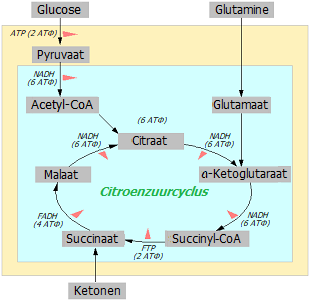
Waarom wordt er specifiek aandacht besteed aan glutamine en niet aan een ander aminozuur? Ten eerste is het het meest voorkomende aminozuur in het lichaam. En ten tweede vanwege de eigenaardigheden van het glutaminemetabolisme. Hoewel andere aminozuren ook energie kunnen leveren, is glutamine het enige aminozuur dat geen energieverbruik vereist om te worden gemetaboliseerd tot succinyl-CoA *. Hierdoor biedt glutamine, vergeleken met andere aminozuren, de grootste efficiëntie bij de energieproductie, en voor een kankercel is energiebesparing van cruciaal belang.
Kankercellen kunnen dus een behoorlijk grote hoeveelheid energie verkrijgen door glutamine te fermenteren. En zoals experimenten met glioblastoma-kankercellen hebben aangetoond, maken ze intensief gebruik van deze mogelijkheid *. Daarom zal vasten met glucose een ineffectieve therapie zijn, tenzij deze alternatieve bron van cellulaire energie wordt geblokkeerd *.
De strategie om de toevoer van glutamine naar cellen te beperken kan wisselend succes hebben, afhankelijk van het subtype van borstkanker. Cellen van het luminale type zijn glutamine-onafhankelijk, terwijl cellen van het basale type glutamine-afhankelijk zijn *. Glutaminaseremmers kunnen dus effectiever zijn tegen de meest agressieve subtypes, TNBC en basaalachtige HER2+-borstkanker, maar niet tegen luminale ER+-kanker *.
Helaas is het verlagen van het glutaminegehalte vanuit praktisch oogpunt problematischer dan het verlagen van het glucosegehalte. Het vermijden van dierlijke eiwitten en zuivelproducten, maar ook planten zoals spinazie, bonen en boerenkool, zou dit probleem enigszins kunnen oplossen. Plantaardig voedsel bevat echter niet alleen glutamine, maar ook vele andere nuttige voedingsstoffen, en het beperken ervan zal leiden tot onvolledige voeding.
Bovendien zijn eiwitten en glutamine nodig voor normale cellen, niet alleen voor kankercellen. In het bijzonder wordt glutamine actief gebruikt door macrofagen, T- en B-cellen van het immuunsysteem; evenals darmcellen. Bovendien is glutamine nodig voor de overdracht van impulsen door neuronen in de hersenen. Daarom kunnen we alleen maar praten over het beperken van bepaalde voedingsmiddelen en het veranderen van de structuur van het dieet in termen van het verminderen van de eiwitconsumptie tot een fysiologisch minimum. Omdat glutamine kan worden gesynthetiseerd uit andere aminozuren en door niet-kankercellen van de tumor zelf, kan het de moeite waard zijn om de inname van welk eiwit dan ook tijdens de therapie te beperken. En misschien zullen zelfs al deze inspanningen niet genoeg zijn als we geen glutaminolyseremmers gebruiken.
De zoektocht naar effectieve en veilige glutaminolyseremmers is nog niet erg succesvol geweest, maar het werk in deze veelbelovende richting stopt niet.
• Fenylbutyraat is een klinisch getest aromatisch vetzuur (300 mg/kg * *) dat wordt gebruikt voor de behandeling van congenitale ureumcyclusstoornissen. Fenylbutyraatmetabolieten binden zich aan glutamine en scheiden het uit in de urine, waardoor de plasmaspiegels aanzienlijk worden verlaagd *.
• Ursolzuur, vooral in combinatie met curcumine of resveratrol, belemmert de opname van glutamaat in de cellen *.
• EGCG (epigallocatechinegallaat) en andere polyfenolen uit groene thee * * remmen sommige stadia van het proces van glutaminolyse en lipogenese, maar de effectiviteit ervan is pas onthuld in preklinische onderzoeken, ook bij muizen. De dosis polyfenolen equivalent aan een persoon was 8 mg per 1 kg lichaamsgewicht, d.w.z. 500 mg voor een lichaamsgewicht van 65 kg.
Productie van ATP uit lipiden. Vetzuren worden op grote schaal gebruikt als brandstof voor de productie van ATP door lever-, nier-, spier- en vetweefselcellen.
Onder omstandigheden van glucosetekort kunnen cellen van veel andere organen en weefsels ook hun toevlucht nemen tot het lipidenmetabolisme. Tijdens langdurig vasten kunnen bijvoorbeeld ketonlichamen, die tijdens het vetzuurmetabolisme door de levercellen in het bloed worden vrijgegeven, als brandstofmoleculen worden gebruikt. Vet werd immers opgeslagen om zijn energie te gebruiken op een «vastendag».
De relatie tussen vetinname en het risico op kanker zal in meer detail worden besproken in de sectie «Dieet therapie» †. Maar we moeten begrijpen dat de mate van negatieve impact van vet op kanker afhangt van de calorische waarde van het dieet. Het maakt de cel immers niet uit waar hij zijn energie vandaan haalt, dus de algehele caloriebeperking kan belangrijker zijn dan de keuze van de bronnen van die calorieën.
Hoewel de metabolische routes voor de energieproductie uit glucose, aminozuren en vetzuren anders beginnen, komen ze uiteindelijk samen op een gemeenschappelijke locatie, de Krebs-cyclus, en moeten ze eindigen in oxidatieve fosforylering. Van alle belangrijke energiebronnen (glucose, lipiden en aminozuren) is alleen glucose de meest efficiënt fermenteerbare grondstof. Minder effectief, maar behoorlijk competitief, is glutamine. Andere energiebronnen zijn veel minder efficiënt, omdat ze energie nodig hebben voor hun metabolisme.
Hierboven werd al vermeld dat de kankercel de verminderde energievoorziening in de vorm van glucose tot op zekere hoogte kan compenseren door energie te leveren in de vorm van glutamine. Omdat zowel glucose als glutamine fermenteerbare grondstoffen zijn. Tegelijkertijd zijn ketonlichamen (acetoacetaat en β-hydroxybutyraat) geen fermenteerbare grondstoffen. Om er energie uit te produceren is oxidatieve fosforylering nodig. Ketonlichamen komen de mitochondriën binnen en gaan de Krebs-cyclus binnen in de vorm van succinaat, waarbij het metabolische stadium van substraatfosforylering (succinyl-CoA ⇒ succinaat) wordt omzeild *. Bovendien kan worden verwacht dat de opname van ketonlichamen in de Krebs-cyclus het gebruik van glutamine door de cellen zal verminderen, omdat ze in de volgende stadia van de Krebs-cyclus om enzymen zullen gaan concurreren.
Wat als we de toevoer van zowel glucose als glutamine naar de cellen zouden afsnijden, en ze in plaats van deze twee energiebronnen zouden voorzien van ketonlichamen, en wel in minimale hoeveelheden? Dan zal de energieproductie in zowel normale als kankercellen dalen. Normale cellen behouden echter een redelijk functionele staat van het OF-mechanisme, wat zorgt voor een hoge ATP-output. Daarom kunnen ze gemakkelijker een energiecrisis doorstaan door energie op te wekken uit ketonlichamen. Terwijl kankercellen en andere cellen met een aangetast OF-mechanisme onderhevig zullen zijn aan dodelijke metabolische stress.
Bovendien zullen kankercellen in dit geval niet kunnen vertrouwen op de hulp van andere cellen in de micro-omgeving van de tumor. De helpercellen zelf zullen in een staat van energiecrisis verkeren. Daarom zullen kankercellen in het nadeel zijn wat betreft overleving en gedwongen worden te stoppen met groeien. Cellen met de meest disfunctionele mitochondriën zullen het meest lijden en kunnen hun leven beëindigen door apoptose.
Op grond van dergelijke overwegingen is het verleidelijk om de structuur van de voedselconsumptie zodanig te veranderen dat de inname van gemetaboliseerde koolhydraten en eiwitten radicaal wordt verminderd, maar de inname van vetzuren wordt verhoogd. Uiteraard tegelijkertijd met een minimale vermindering van de totale calorie-inname. Het zogenaamde ketogene dieet is gebaseerd op dit theoretische principe, dat hieronder in meer detail zal worden besproken †. In sommige klinieken wordt het ketogene dieet in beperkte mate gebruikt als aanvullende therapie, maar ook om het therapeutische effect van chemotherapie na dit dieet te versterken.
De behandelstrategie van dr. Thomas Seyfried *, die hij Press-Pulse noemde, is op dezelfde aanpak gebaseerd. Hier wordt eerst energiedruk (Press) uitgeoefend op de kankercel. Hiervoor wordt een ketogeen dieet gebruikt, waarbij het totale energieverbruik zoveel mogelijk wordt verminderd. Om de glycolyse te blokkeren, wordt de inname van koolhydraten stopgezet en worden gedurende korte tijd glutaminolyseremmers gebruikt om de glutaminolyse te blokkeren, aangezien het onmogelijk is om het glutaminegehalte via een dieet te verlagen. Als gevolg hiervan neemt het vermogen om enzymatisch cellulaire energie te produceren sterk af, waardoor de energievoorziening van de kankercel ernstig wordt afgesneden *.
Zo wordt de groei van de kankercel onderdrukt. De energie die van het OF wordt ontvangen, kan echter nog steeds voldoende zijn om de levensvatbaarheid ervan te behouden. Daarom is de volgende stap chemotherapie (Pulse). In omstandigheden van een ernstige energiecrisis heeft de kankercel simpelweg niet genoeg kracht om gifstoffen uit de cel te pompen, en wordt hij erg kwetsbaar voor chemotherapie. Hierdoor kan de dosering van gifstoffen aanzienlijk worden verminderd, samen met de negatieve gevolgen van chemotherapie voor het hele lichaam. Het is waar dat een dergelijk protocol zeer nauwkeurige regelgeving vereist, wat alleen haalbaar is in een klinische setting.
Verminderde ATP-productie uit aldehyden *. Ketonlichamen die door de lever worden geproduceerd uit vetzuren kunnen worden gemetaboliseerd tot aldehyden, en aldehyden kunnen worden gemetaboliseerd tot carbonzuur door het enzym aldehyde dihydrogenase (ALDH1). Deze laatste reactie produceert NADH, wat een andere energiebron kan zijn voor de productie van ATP *.
Remming van ALDH met gossypol in combinatie met remming van mitochondriaal complex I met fenformine resulteerde in een afname van de ATP-productie in kankercellen tot 80%, terwijl normale cellen geen verlies aan ATP-productie hadden *.
Deze manipulatie ging gepaard met een vermindering van de groei van getransplanteerde tumoren bij dieren. Gossypol kan echter geen goede keuze voor mensen worden genoemd.
Tretinoïne (ATRA) equivalent dosis van 0,6 mg/dag *
en sulforafaan in equivalent dosis van 320 mg/dag *
onderdrukt in dierproeven ALDH, vermindert de tumorgroei en ziet eruit als aantrekkelijkere natuurlijke ALDH-remmers.
Onderdrukking van de brandstofproductie in de tumor. Kankercellen zijn niet het enige type cel dat een tumor vormt. Sommige cellen in de micro-omgeving van de tumor kunnen lactaat dat vrijkomt door glycolytische cellen weer omzetten in pyruvaat, dat kankercellen kunnen opnemen en opnieuw als brandstof kunnen gebruiken. Helaas is er nog geen manier voorgesteld om deze methode van het voeden van kankercellen te vermijden. Neutralisatie van lactaat in de extracellulaire ruimte van de tumor door intratumorale alkalische injecties, bijvoorbeeld zuiveringszout, lijkt een al te avontuurlijke methode. En het verminderen van de algehele zuurgraad van weefsels, bijvoorbeeld door alkalische infusies, lijkt ineffectief vanwege de hoge intratumorale druk, die de stroom van stoffen in de tumor verhindert.
Correctie van het pyruvaatmetabolisme. Correctie van het pyruvaatmetabolisme. Normalisatie van cellulaire ademhaling omvat het verhogen van de mitochondriale ATP-productie en tegelijkertijd het onderdrukken van de enzymatische ATP-productie. Hoewel de beperking van de brandstofgrondstoffen de energieproductie zal beperken en de cel ertoe zal aanzetten deze efficiënter te gebruiken, zal deze indirecte dwang zeker niet voldoende zijn. Om een cel te dwingen terug te keren naar de mitochondriale ademhaling, zal men zijn toevlucht moeten nemen tot directe dwangmethoden.
Remming van de pyruvaatfermentatie. Metabolisatie van pyruvaat tot lactaat vindt plaats met de deelname van het enzym lactaatdehydrogenase. Neutralisatie van deze biochemische reactie onderbreekt de metabolische route van ATP-productie die kenmerkend is voor kankercellen, waardoor ze een aanzienlijk deel van hun energie worden ontnomen.
• Diclofenac * is een niet-steroïde anti-inflammatoir geneesmiddel dat het transport en de uitscheiding van lactaat kan beïnvloeden. Van diclofenac is gemeld dat het de tumorgroei en de lactaatniveaus in de micro-omgeving van de tumor in vitro vermindert * *.
• Epigallocatechinegallaat (EGCG) * en roeripentol * kunnen ook tot op zekere hoogte lactadehydrogenase remmen.
Een dubbele klap voor de energievoorziening van kankercellen (fermentatie en zwakke mitochondriën) kan ze op de rand van het bestaan brengen. Daarom lijkt een combinatie van alle bovengenoemde maatregelen effectiever.
Activering van pyruvaattransport naar mitochondriën. Als de fermentatie van pyruvaat tot lactaat wordt geblokkeerd, kan het als gevolg van glycolyse verkregen pyruvaat door de mitochondriën worden gebruikt voor oxidatieve ademhaling. Het probleem is echter niet alleen dat de mitochondriën zelf niet goed werken, maar ook dat er mogelijk enkele obstakels zijn voor de penetratie van pyruvaat in de mitochondriën. Het in de cel aanwezige enzym pyruvaatdehydrogenasekinase (PDK) remt bijvoorbeeld de toegang van pyruvaat tot de mitochondriën. Er zijn vier isotypen van PDK (PDK1-PDK4), en daarvan heeft PDK3 de hoogste enzymatische activiteit en is het het enige enzym dat niet wordt geremd door hoge concentraties pyruvaat.
• Natriumdichlooracetaat (DCA) * * is een analoog van azijnzuur waarin twee van de drie waterstofatomen van de methylgroep zijn vervangen door chlooratomen (CHCl2COOH). DCA-zouten remmen PDK *, wat helpt de stroom van pyruvaat naar de mitochondriën te vergroten, waardoor deze de grondstof krijgen voor oxidatieve ademhaling. En activering van het oxidatieve metabolisme bij borstkanker leidt op zijn beurt tot een afname van de metastase en een afname van de tumorgroei *. Helaas remt DCA verschillende PDK-isotypen met verschillende sterktes, en PDK3 lijkt hiervan de meest resistente te zijn *.
DCA is klinisch getest voor de behandeling van lactaatacidose *. Bij patiënten met plaveiselcelcarcinoom van het hoofd-halsgebied waren de complete responspercentages aan het einde van de behandeling significant hoger in de DCA-groep vergeleken met placebo (71% vs. 38%). De overlevingsresultaten verschilden echter niet significant tussen de groepen *.
DCA-therapie wordt gecompliceerd door het beperkte vermogen ervan om doelmitochondriën te bereiken *. De toevoeging van co-enzym Q10, acetyl-L-carnitine, vitamine B-complex, magnesium en liponzuur helpt echter de therapeutische effecten te versterken *.
Dosering natriumdichlooracetaat: (1'000-3'500 mg/dag *), de dosering wordt gewoonlijk gestart op 15 mg/kg lichaamsgewicht. Dichlooracetaatzout wordt verdund in 100 ml water en 2-4 keer per dag ingenomen.
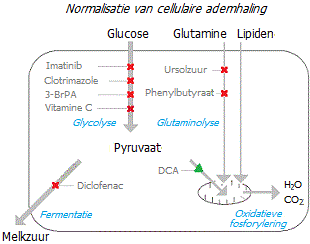
De hier gepresenteerde figuur toont alle hierboven voorgestelde inspanningen om het metabolisme van een kankercel te corrigeren en hem te dwingen te kiezen: overschakelen naar mitochondriale ademhaling of sterven.
Als mutaties in het mitochondriaal DNA ervoor zorgen dat de cel het OF niet volledig kan benutten, zal het moeilijk voor hem zijn om te overleven. Er kan echter niet worden gezegd dat deze methode voldoende succesvol zal zijn.
Ten eerste zal een algemeen (in plaats van lokaal) effect op cellen de energie van alle andere cellen in het lichaam remmen, niet alleen van kankercellen. Dit kan uiteraard de gezondheid van het lichaam als geheel verbeteren, door cellen met slecht functionerende mitochondriën af te stoten en degenererende cellen te behoeden voor de uiteindelijke overgang naar glycolyse. Er zijn echter veel normale cellen in het lichaam die alleen de glycolytische ATP-productie gebruiken. Een sterke remming van de glycolyse zal de werking van cellen zoals rode bloedcellen of netvliescellen beïnvloeden. Terwijl het onze taak is om uitsluitend op kankercellen in te werken.
Ten tweede is het op natuurlijke wijze afgeven van therapeutische stoffen aan de tumor moeilijk. Maar het rechtstreeks in de tumor injecteren is niet altijd mogelijk. Maar zelfs als dit probleem is opgelost, keren we terug naar het eerste punt: een tumor bestaat uit meer dan alleen kankercellen. We kunnen niet selectief actieve stoffen afleveren aan ons doelwit – kankercellen; ze zullen ook normale cellen bereiken die tumoren vormen. Bijvoorbeeld immuuncellen. En we kunnen niet voorspellen hoe onze acties hun functionaliteit zullen veranderen.
Het manipuleren van het metabolisme van tumorcellen heeft dus zijn eigen zekere limiet. Het kan echter een belangrijke bijdrage leveren aan de antitumorcontrole als het wordt opgenomen in een complexe therapie.
Alle pogingen om de zuurstofademhaling van tumorcellen te vergroten kunnen niet succesvol zijn als er een tekort is aan de belangrijkste deelnemer aan dit proces: zuurstof.
Een lage zuurstofconcentratie is een sleutelfactor voor een hoge zuurgraad in de tumor en de activiteit van het tumorproces. Gebrek aan zuurstof versterkt de glycolyse in cellen en veroorzaakt een kwaadaardige transformatie van hun fenotype (Warburg-effect). Omgekeerd veroorzaakt de aanwezigheid van zuurstof onderdrukking van de glycolyse (Pasteur-effect).
Verhoogde zuurstofconcentratie in weefsel. Tumorhypoxie vormt een ernstig obstakel voor effectieve kankertherapie *. Het belangrijkste mechanisme van bestralingstherapie is bijvoorbeeld het creëren van hoge concentraties reactieve zuurstofsoorten; daarom zorgt zuurstofgebrek voor een aanzienlijk hogere stralingsweerstand tegen hypoxische tumoren. Veel chemotherapiemedicijnen verliezen ook hun therapeutische effectiviteit onder hypoxische omstandigheden. Ten slotte vermindert hypoxie de effectiviteit van immunotherapie. Het verhogen van de zuurstofconcentratie door het verminderen van de zuurgraad in de micro-omgeving van de tumor en het verhogen van de zuurstofafgifte aan de tumor zijn dus uiterst belangrijke factoren bij antitumortherapie.
Het verminderen van de zuurgraad in weefsels wordt apart besproken in de paragraaf «Minerale modulatie»†. En de zuurstofconcentratie in het bloed kan op verschillende manieren worden verhoogd:
- Gebruik van natuurlijke dragers (erytrocyten). Gebrek aan zuurstof kan worden veroorzaakt door een laag aantal rode bloedcellen of door een tekort aan hemoglobine, waardoor het vermogen van de rode bloedcellen om zuurstof te transporteren afneemt. Dit laatste kan worden veroorzaakt door een tekort aan chemische elementen (zink, ijzer) en voedingsstoffen (vitamine B12, folaat), hun slechte opname, nierfalen, bloedverlies en andere redenen in de voeding.
- Gebruik van synthetische dragers. Naast rode bloedcellen kunnen alternatieve zuurstofdragers in het bloed worden gebruikt, maar deze blijven moeilijk toegankelijk.
- Door de bloedstroom te verhogen. Het verhogen van de bloedcirculatie, bijvoorbeeld door de bloedvaten te verwijden, verbetert het vermogen om zuurstof *,
mineralen en voedingsstoffen af te geven, en verbetert ook de effectiviteit van zowel therapeutische middelen als de preventie van metastasen. Om dit te doen, kunt u zowel fysieke procedures als sommige supplementen gebruiken, bijvoorbeeld vaatverwijders. Een slechte bloedcirculatie kan worden veroorzaakt door een hoge aggregatie van rode bloedcellen en microtrombose, waarvoor mogelijk extra inspanningen nodig zijn.
- Door zuurstof direct in het bloed op te lossen. Een directe verhoging van de zuurstofconcentratie in het bloed, waarbij de dragers worden omzeild, kan worden bereikt door gas met een zeer hoog zuurstofgehalte in te ademen – zowel bij normale atmosferische druk als bij verhoogde druk (hyperbare oxygenatie). Deze laatste optie vereist speciale apparatuur en de diensten van gekwalificeerd personeel. Langdurige ademhaling van zuivere zuurstof kan niet alleen voordelen opleveren, maar ook schade. Ten eerste zorgt zuurstof zonder toegevoegd kooldioxide ervoor dat de bloedvaten vernauwen. Het is dus niet alleen mogelijk om de zuurstoftoevoer niet te versterken, maar in tegendeel te verzwakken. Ten tweede is zuurstof gevoelig voor de vorming van reactieve zuurstofsoorten (ROS), die een destructief effect hebben op alle eiwitten in ons lichaam.
Het is ook de moeite waard eraan te denken dat langdurige blootstelling aan vaatverwijders de toevoer van niet alleen zuurstof verhoogt, maar ook energiebronnen – glucose en glutamine. Als glycolyse en glutaminolyse niet worden onderdrukt in combinatie met een verhoogde bloedcirculatie, kan dit bijdragen aan de progressie van kanker, wat de noodzaak van een geïntegreerde aanpak van de kankerbehandeling verder benadrukt.
Lokale hyperthermie (41-42 °С) verhoogt de beweging van de vloeistofstroom naar de tumor en verzwakt de weerstand van kankercellen tegen bestralingstherapie *. Hyperthermie kan de oxygenatie van hypoxische borsttumoren verbeteren *. Het hyperthermische effect kan tot 24 uur na de sessie aanhouden *.
De combinatie van hyperthermie en standaardbehandeling kan het therapeutische effect versterken. Er bestaat geen consensus over het gebruik van hyperthermie buiten de standaardbehandeling vanwege de gebrekkige kennis over dit onderwerp. Er bestaat bezorgdheid dat een verhoogde vochtcirculatie kan bijdragen aan de verspreiding van tumorcellen. Een soortgelijk risico geldt voor massage, infrarood- en ultrasone bestraling van het tumorgebied. Hyperthermie kan dus alleen als therapie worden beschouwd in combinatie met andere therapieën.
Proteolytische enzymen zijn enzymen die helpen bij het afbreken van eiwitten. Hun activiteit wordt zo gereguleerd dat ze vreemde, dode of niet-functionele eiwitstructuren vernietigen zonder de functionele cellen van het lichaam aan te tasten.
Proteolytische enzymen verbeteren de bloedstroom door de wanden van bloedvaten te reinigen en het fibrinogeengehalte * te verlagen, wat ook de bloeddruk verlaagt *. Ze reinigen zowel het bloed zelf als de cellen die het bevat van fibrine en slijm, en stellen daardoor antigenen op het oppervlak van kankercellen bloot aan het immuunsysteem, waardoor het risico op uitzaaiingen wordt verminderd. Van de vele proteolytische enzymen zijn er slechts enkele voldoende bestudeerd.
Trypsine en chymotrypsine zijn het meest effectief *,
maar zijn moeilijk verkrijgbaar.
Bromelaïne en papaïne worden respectievelijk gewonnen uit de ananasstengel en de papajafruit; en hun prijs is redelijker.
Serrapeptase (3×10 mg) wordt al lang in de sportgeneeskunde gebruikt om ontstekingen bij blessures en verstuikingen te verminderen. Van alle proteolytische enzymen op de markt lijkt serrapeptase het beste waardevoorstel te zijn.
Nattokinase (2×1'000-1'440 fibrinolytische eenheden) is de afgelopen jaren een ander populair stolselverminderend enzym geworden, maar de prijs ervan is nog steeds onaantrekkelijk.
Lumbrokinase bevat een groep proteolytische enzymen, waaronder plasminogeenactivator en plasmine. Het wordt verkregen uit de regenworm Gewone blauwkopworm (Lumbricus rubellus). In termen van zijn fibrinolytische eigenschappen is lumbrokinase 30 keer sterker dan nattokinase en 300 keer sterker dan serrapeptase, maar de prijs ervan is te hoog.
Verschillende enzymen zijn het meest actief bij verschillende zuurgraadniveaus, en daarom zal een complex dat trypsine, chymotrypsine, bromelaïne, papaïne en serrapeptase bevat waarschijnlijk veelzijdiger zijn dan elk van deze enzymen alleen. Een voorbeeld van zo’n complex is Wobenzym™. Dosering: 600-1'000 mg/dag, maar niet meer dan 4'000 mg/dag *. Langdurig gebruik zonder pauzes is toegestaan, maar voorzichtigheid is geboden. De combinatie van proteolytische enzymen en hun hoge dosering versterken de werking van andere anticoagulantia, wat in veel gevallen zeer gevaarlijk kan zijn.
NSAID's – niet-steroïde anti-inflammatoire geneesmiddelen.
• Acetylsalicylzuur gaat de DNA-mutatie tegen, waardoor het risico op elke vorm van kanker wordt verminderd. Bovendien voorkomt het de aggregatie van bloedplaatjes – aan elkaar plakken, waardoor de bloedvloeibaarheid wordt verbeterd. Omdat bloedplaatjes circulerende kankercellen beschermen tegen detectie en vernietiging door immuuncellen, en het voor hen ook gemakkelijker maken om zich op afgelegen plaatsen aan epitheelwanden te hechten, kan aspirine metastasen tegengaan. Aspirine vermindert ook het stolselvormende effect van sommige therapeutische middelen, zoals tamoxifen. De combinatie van ginkgo-extract (450 mg/dag) met aspirine (100 mg/dag) in een klinisch onderzoek versterkte hun antibloedplaatjeseffect bij patiënten na een beroerte *. Dosering: 100 mg/dag.
Langdurig gebruik van aspirine, hoewel mogelijk, is ongewenst vanwege mogelijke schade aan het epitheel van het maagdarmkanaal en verhoogde darmpermeabiliteit. Gelukkig worden salicylaten in vrij hoge concentraties aangetroffen, niet alleen in wilgenbast, maar ook in veel voedingsmiddelen *. Voorbeelden hiervan zijn munt, komijn, tijm, paprika, kurkuma, zwarte komijn, kardemom *. Het wijdverbreide gebruik ervan als smaakmaker zou het mogelijk maken de dosering van aspirine zelf te verlagen.
• Naizilat® (amtolmetine guacil). Een modern niet-steroïde ontstekingsremmend medicijn, een aantrekkelijk alternatief voor aspirine. Vermindert trombusvorming, verbetert de bloedstroom. Dosering: 600 mg/dag. Op een lege maag ingenomen.
Een ander aspect van de antitumoractiviteit van sommige NSAID's, zoals celecoxib, is het vermogen om de mitochondriale ademhaling, het transmembraan elektrisch potentieel en de ATP-productie direct te remmen, waardoor overmatige ROS wordt veroorzaakt en apoptose van kankercellen wordt veroorzaakt. Bovendien verminderen ze het vermogen van kankercellen om te migreren * *.
Dibazolum is een bekende vaatverwijder. Dibazol ontspant de spieren van de wanden van bloedvaten, waardoor de bloedcirculatie verbetert. Bovendien werkt het als een milde stimulant van het immuunsysteem. In tegenstelling tot acetylsalicylzuur veroorzaakt dibazol geen verzuring van lichaamsweefsels. Dosering: 3×20 mg 2 uur vóór of 2 uur na de maaltijd.
Vitamine В3 (vitamine PP, niacine, nicotinezuur, nicotinamide) verwijdt kleine bloedvaten (inclusief die van de hersenen), waardoor de microcirculatie van het bloed verbetert. Het heeft een zwak anticoagulerend effect, normaliseert het cholesterolgehalte in het bloed en heeft ook ontgiftende eigenschappen. De dosering voor gezonde mensen is 20 mg/dag. Een overdosis tot 100 mg/dag veroorzaakt geen schade.
Arginine (3×700 мг) is een essentieel zuur dat stikstofmonoxide (NO) kan produceren, waardoor gladde spiercellen ontspannen. Als gevolg hiervan verwijden de bloedvaten zich, waardoor de bloedstroom toeneemt en de zuurstoftoevoer naar de weefsels verbetert.
Linnen. Bij muizen resulteerde de consumptie van lijnzaad (10% van de totale maaltijd) tijdens de behandeling met tamoxifen in een verminderde microvasculaire dichtheid van de tumor en een verminderde afgifte van het pro-inflammatoire cytokine IL-1 *. De combinatie van lijnzaad en tamoxifen remde de grootte van de geïnoculeerde tumoren bij muizen met meer dan 53% vergeleken met tamoxifen alleen *.
Hemocirculatoire planten verbeteren de bloedcirculatie in kleine bloedvaten en haarvaten.
• Witte paardenkastanje (Aesculus hippocastanum) bevat aescine, dat ontstekingen vermindert en congestie in aderen en kleine bloedvaten * vermindert door de capillaire permeabiliteit te verminderen. Naast escine bevatten kastanjevruchten coumaarzuur (p-coumaarzuur), cafeïnezuur (cafeïnezuur), quercetine, kaempferol en apigenine. Waterig-alcoholisch extract van fruit: 250-300 mg 2 maal daags *, of 100-150 mg escin per dag * *.
• Ginkgo (Ginkgo biloba) bevat flavonoïden en terpenoïden die de tonus van de arteriële en capillaire bloedvaten helpen verbeteren en het cognitieve vermogen verbeteren *. Bovendien beschermt ginkgo-extract het mitochondriaal DNA tegen oxidatieve schade * en verbetert het de mitochondriale ademhaling *. Bladextract: 40-120 mg 2 maal daags *.
• Centella (Centella asiatica), ook bekend als Gotu Kola. Vermindert de aggregatie van bloedplaatjes en verbetert de bloedcirculatie, ook in de hersenen, bevordert ontspanning, verlicht symptomen van angst * en verbetert het cognitieve vermogen *. Gedroogd bladextract: 60 mg 1-2 maal daags. Het wordt afgeraden om de plant langer dan 6 weken achter elkaar te gebruiken.
• Salie (Salvia miltiorrhiza) bevat polyfenolen en tanshinonen, die in vivo de aggregatie van bloedplaatjes remmen, wat de bloedstroom helpt verbeteren * *.
Elk van deze remedies kan achtereenvolgens worden ingenomen, afwisselend elke 1,5-3 maanden.
Bekende bloedplaatjesremmers zijn inositol, ginseng, kurkuma, gember, lijnzaadolie, visolie, vitamine E. Voorzichtigheid is echter geboden bij het gebruik ervan, omdat overmatige remming van de bloedplaatjes inwendige bloedingen kan veroorzaken, evenals inwendige bloedingen. Het gebruik van de hierboven besproken medicijnen moet vanaf 2 weken vóór de operatie worden gestopt en niet eerder dan 1 week na de operatie worden hervat, in overleg met uw arts.
Gezien het feit dat de bovengenoemde geneesmiddelen elkaars effecten versterken, moet de dosering, wanneer ze samen worden ingenomen, aanzienlijk worden verlaagd.
Het verminderen van de zuurstofbehoefte. Een alternatieve en wellicht effectievere oplossing voor hypoxie is niet het voldoen aan de cellulaire vraag naar zuurstof, maar het verminderen van die vraag. Het verminderen van het zuurstofverbruik door cellen vermindert de zuurstofuitputting in het weefsel, waardoor de zuurstofverzadiging toeneemt. Uit computermodellen blijkt dat het verminderen van het zuurstofverbruik met 30% net zo effectief is in het omkeren van hypoxie als het vier keer verhogen van de bloedstroom *. Hiervoor kunnen de volgende middelen worden ingezet:
• Atovaquone is een antimalariamiddel dat tumorhypoxie vermindert en het effect van bestralingstherapie in vitro versterkt *.
• Natriumhydrosulfide (NaHS) is een donor die waterstofsulfide (H2S) afgeeft. NaHS interfereert met de ademhalingsketen van de mitochondriën van tumorcellen, verbetert de oxygenatie van tumoren en verhoogt de effectiviteit van bestralingstherapie. Tumoren die 15 minuten na een enkele injectie met NaHS werden bestraald, waren tweemaal zo gevoelig voor bestralingstherapie als tumoren die alleen met bestraling werden behandeld *. NaHS wordt echter niet gebruikt in klinische omgevingen.
• NSAID's (niet-steroïde anti-inflammatoire geneesmiddelen), zoals diclofenac, indomethacine en piroxicam, verminderen binnen een half uur hypoxie bij levertumoren en fibrosarcomen bij muizen *.
• Metformine is een antidiabeticum dat het zuurstofverbruik vermindert door het remmen van mitochondriaal complex I *. Behandeling met metformine (equivalent van 1'000 mg/dag) verbeterde de oxygenatie van de getransplanteerde tumor bij muizen aanzienlijk *. Deze dosering is, in menselijke termen, niet hoger dan die welke wordt gebruikt bij de behandeling van diabetes bij mensen.
Het is belangrijk om te begrijpen dat het zuurstofniveau in tumorweefsel ook wordt beïnvloed door vele fysiologische factoren, en niet alleen door een geforceerde toename van het zuurstofniveau. Schildklierhormonen spelen bijvoorbeeld een leidende rol bij de metabolische activiteit en het zuurstofverbruik van cellen. Hogere niveaus van het hormoon T4 worden in verband gebracht met een hoger risico op elk type kanker, inclusief borstkanker *. De gezondheid van de schildklier heeft dus een grote invloed op de zuurstofverzadiging van het weefsel en de effectiviteit van antitumortherapie.