Gezondheidsstrategie.
Het hormonale evenwicht is vooral belangrijk voor de gezondheid van vrouwen, inclusief de gezondheid van de borsten van vrouwen. Hormonen reguleren vitale biologische functies van het lichaam, waaronder het cardiovasculaire, ademhalings-, spijsverterings-, voortplantings-, hersen- en immuunsysteem *.
Hormonen zijn uiterst krachtige modulatoren van biochemische processen. Extreem lage concentraties van een bepaald hormoon zijn voldoende om zijn effect teweeg te brengen. Ze zijn echter slechts voor een bepaalde periode nodig. De werking van sommige hormonen op dit moment kan in de toekomst worden gecompenseerd door de werking van andere hormonen. De hormoonspiegels veranderen dus voortdurend, afhankelijk van verschillende omstandigheden. De belangrijkste tegenstelling tussen geslachtshormonen vindt plaats tussen oestrogenen en androgenen, in het bijzonder tussen estradiol en progesteron.
Elk hormoon speelt zijn eigen rol, zoals een muzikant in een orkest, en als resultaat van hun algehele gecoördineerde werk krijgen we een symfonie van een normaal functionerend organisme. Hormonen kunnen veel fysiologische en zelfs psychologische verschijnselen beheersen. Er zijn echter veel redenen waarom het harmonieuze geluid van hormonen kan worden verstoord, wat kan resulteren in een grote verscheidenheid aan ziekten. Sommige subtypes van kanker zijn hormoongevoelig. Het is niet bewezen dat oestrogenen kanker veroorzaken, maar ze kunnen dit proces bevorderen en samenwerken met zowel de oorzaken als andere promoters.
Hoewel verhoogde oestrogeenspiegels in verband zijn gebracht met een verhoogd risico op borstkanker, is het doel van hormonale modulatie niet om de oestrogeenspiegels onvoorwaardelijk te verlagen, maar om de niveaus van antagonistische hormonen in evenwicht te brengen. Als een chronische onbalans ten gunste van oestrogeen niet door geschikte tests wordt bevestigd, is er geen noodzaak voor hormonale modulatie. Maar helaas is dit niet altijd het geval.
Oestrogeen is de algemene naam voor een groep steroïde hormonen die bij vrouwen tot aan de menopauze voornamelijk in de eierstokken worden geproduceerd. Een deel van het oestrogeen wordt geproduceerd door de bijnieren, en nog minder wordt geproduceerd in het vetweefsel en de lever *. Oestrogeen kan ook in het borstweefsel zelf worden gesynthetiseerd uit andere steroïde hormonen *; deze route wordt steeds actiever in de postmenopauze. Bij vrouwen is oestrogeen een sleutelfactor in de puberteit, de menstruatiecyclus en seksuele activiteit.
Estetrol (E4) is het zwakste en dus minst gevaarlijke oestrogeen. De niveaus ervan worden pas merkbaar hoog tijdens de zwangerschap, omdat het door de foetus wordt geproduceerd. Er wordt gedacht dat zwangerschap het risico op borstkanker van een vrouw op korte termijn vergroot. Dit risico is echter waarschijnlijker als gevolg van verhoogde concentraties estradiol tijdens de zwangerschap, terwijl oestrol een beschermende rol kan spelen door sterkere oestrogenen weg te duwen van cellulaire receptoren.
Oestriol (E3) maakt ongeveer 80-90% uit van de totale hoeveelheid vrouwelijk oestrogeen. Het is een biologisch zwak oestrogeen. Een onbalans van oestrogeen, wat resulteert in een afname van oestriol, leidt niet alleen tot zwaarlijvigheid *, maar ook tot de dominantie van sterkere oestrogenen.
Oestron (E1) vormt ongeveer 5-10% van het totale oestrogeen. Het vertoont een sterkere binding aan de oestrogeenreceptor dan oestriol, hoewel zwakker dan estradiol.
Estradiol (E2) maakt ook ongeveer 5-10% van het totale oestrogeen uit. Dit is het krachtigste en gevaarlijkste oestrogeen omdat het 12 keer actiever is dan oestron en 80 keer actiever dan oestriol. Overtollig lichaamsvet, evenals overtollig voedingsvet, verhogen de oestron- en estradiolspiegels in het lichaam. De aandoening komt zeer vaak voor bij vrouwen in de pre-menopauze in «rijke» landen en verhoogt het risico op borstkanker aanzienlijk.
Omdat de meeste borsttumoren hormoonpositief zijn, kan het corrigeren van het hormonale evenwicht een beslissende bijdrage leveren aan het terugdringen van de incidentie van de ziekte.
Het niveau en de duur van de blootstelling aan oestrogeen zijn sleutelfactoren die de ontwikkeling van kanker bevorderen of voorkomen. Er is al lang een verband gevonden tussen een verhoogde levenslange blootstelling aan estradiol bij vrouwen (vroege menarche, vertraagde menopauze, aantal voldragen zwangerschappen) en een verhoogd risico op borstkanker. Borstcellen zijn zeer oestrogeen en oestrogeen is het voorwaardelijke groeihormoon van het lichaam, omdat het de deling van oestrogeengevoelige cellen stimuleert *.
Oestrogenen en hun chinonmetabolieten veroorzaken borstkanker via een mechanisme op twee niveaus waarbij ze: a) celgroei en -deling stimuleren * * en b) oxidatieve stress en DNA-schade veroorzaken * *, waardoor de snelheid van genetische mutaties toeneemt *. Langdurige blootstelling aan oestrogeen, onevenwichtig door androgeen, veroorzaakt ook transformatie van fenotypes en genomische veranderingen in borstepitheelcellen geassocieerd met hoge proliferatie, invasiviteit en migratie * *.
Oestrogenen binden aan de twee belangrijkste oestrogeenreceptoren op borstcellen, ERα en ERβ. De binding van oestrogeen aan de receptor veroorzaakt de transcriptie van een groot aantal genen die ermee geassocieerd zijn *. Beide oestrogeenreceptorsubtypen worden tot expressie gebracht in borstweefsel, maar oestrogeenafhankelijke celproliferatie en borstcarcinogenese zijn voornamelijk geassocieerd met ERα-signalering, terwijl ERβ ER-afhankelijke gentranscriptie kan onderdrukken. De rol van ERβ bij borstkanker lijkt echter afhankelijk te zijn van de aan- of afwezigheid van ERα, aangezien is aangetoond dat ERβ de celproliferatie in ERα-negatieve borstkankercellen stimuleert *.
Progesteron is een vrouwelijk steroïdhormoon dat de proliferatieve activiteit van estradiol in evenwicht brengt. Hun verhouding bij een vrouw van volwassen leeftijd is niet constant; het fluctueert tijdens de menstruatiecyclus, dus het leunt naar de ene of de andere kant. Estradiol domineert in de eerste (ovulatoire) fase van de cyclus, waardoor de celgroei wordt gestimuleerd, en progesteron domineert in de tweede (luteale) fase van de cyclus, waardoor apoptose en celdifferentiatie worden gestimuleerd.
Beide hormonen zijn essentieel voor de borstontwikkeling en bevorderen actief de celdeling tijdens de borstvorming, maar ook tijdens de zwangerschap. Men denkt dat oestrogeen de belangrijkste stimulator van celgroei is, maar proliferatie vereist eigenlijk een combinatie van beide antagonistische hormonen *. Terwijl oestrogeen de groei van normale oestrogeengevoelige borstcellen stimuleert, kan progesteron de groei van borststamcellen stimuleren *.
Androgeen is de algemene naam voor een groep steroïde hormonen die bij mannen door de teelballen worden geproduceerd, en bij vrouwen door de eierstokken en de bijnierschors.
Testosteron is het belangrijkste androgeen bij vrouwen. Dit is een anabool hormoon dat een oestrogeenantagonist is. Hoewel algemeen wordt aangenomen dat oestrogeen een vrouwelijk hormoon is en androgeen een mannelijk hormoon, is de balans tussen androgenen en oestrogenen belangrijk voor zowel mannen als vrouwen. Hormonale onbalans wordt in verband gebracht met de allereerste stadia van tumorziekte, wat erop wijst dat er een oorzaak-gevolgrelatie tussen bestaat.
Hormonale onbalans wordt ook waargenomen bij goedaardige tumoren. Een analyse van de hormonale profielen van premenopauzale en postmenopauzale patiënten met goedaardige ziekten onthulde gemiddeld respectievelijk: een toename van estradiol – met 22,4% en 32,0%; oestron – met 26,2% en 30,9%; testosteron – met 19,5% en 16,5% vergeleken met de profielen van gezonde vrouwen *. Bovendien hangt de snelheid van proliferatie rechtstreeks af van het niveau van deze hormonen in het circulerende bloed.
Concentraties van oestrogeen en androgeen variëren sterk tussen goedaardige en kwaadaardige tumorweefsels en in het circulerende bloed. Bij postmenopauzale (maar niet premenopauzale) vrouwen had borstkankerweefsel significant hogere niveaus van estradiol (56%), androsteendion (33%) en testosteron (33%) vergeleken met normaal weefsel. En de niveaus van dehydroepiandrosteron en androstenediol zijn hoger in goedaardige dan in kankerweefsel (respectievelijk 6 keer en 2 keer). Bovendien is de concentratie van androgenen hoger in plasma dan in weefsels, wat erop wijst dat ze actief worden omgezet in oestrogenen door het vetweefsel van de borstklier *. Mede hierdoor kan bij postmenopauzale vrouwen de concentratie estradiol in de borsttumor 10-20 maal hoger zijn dan in plasma * *.
Bij premenopauzale vrouwen tonen prospectieve onderzoeken een direct verband aan tussen de circulerende oestrogeenspiegels en het risico op het ontwikkelen van borstkanker * *. Bovendien wordt dit risico op betrouwbare wijze in verband gebracht met een hoge concentratie estradiol in de folliculaire fase, maar niet in de luteale fase van de menstruatiecyclus *.
Bij postmenopauzale vrouwen is het risico hoger * in groepen met hogere concentraties van totaal estradiol, vrij estradiol, oestron en hun voorlopers – androsteendion, dehydroepiandrosteron en testosteron * *. Hogere niveaus van geslachtshormoonbindend globuline (SHBG) gaan echter gepaard met een lager risico. Elke activiteit die resulteert in een verlaging van de circulerende oestrogeenspiegels, vooral estradiol, vermindert mogelijk het risico op het ontwikkelen van borstkanker *.
Het verminderen van de oestrogeenbelasting kan op de volgende manieren worden bereikt:
1) verwijdering van hormonale systeemverstoorders;
2) het verbeteren van het proces van het verwijderen van oestrogeenmetabolieten uit het lichaam;
3) het verbeteren van de verhouding tussen gezonde oestrogene metabolieten en carcinogene metabolieten;
4) verminderde productie van estradiol;
5) verhoogde progesteronniveaus;
6) het «uitschakelen» van de oestrogeenreceptor;
7) controle van schildklierreceptoren en receptoren van andere geslachtshormonen.
Punten 1, 2 en 3 zijn preventief; hun belang neemt echter niet af tijdens hormoontherapie. Punten 4 en 5 kunnen nuttig zijn als de estradiolspiegels hoog zijn, maar het gebruik ervan moet strikt gecontroleerd worden. De overige punten zijn puur therapeutisch en zijn extreme maatregelen die niet door patiënten alleen mogen worden toegepast.
Het elimineren van externe hormonale stoornissen is de eerste stap in hormonale normalisatie *. Kankerverwekkende effecten kunnen worden veroorzaakt door: natuurlijke of bio-identieke oestrogenen, voornamelijk estradiol (terwijl oestriol een beschermend effect kan hebben); oestrogeenmetabolieten zoals 4-OH-E2, 16α-OH-E2 en andere; oestrogeenachtige medicijnen zoals orale anticonceptiva en hormonale medicijnen; xeno-oestrogenen (herbiciden, pesticiden, fungiciden, sommige kunststoffen, inclusief die welke voor verpakkingen worden gebruikt); veel chemicaliën (koelmiddelen, industriële oplosmiddelen, bleekmiddelbijproducten, polycyclische aromatische koolwaterstoffen, enz.), giftige metalen (koper, kobalt, nikkel, kwik, lood, tin en chroom *); hormonen die worden gebruikt om dieren vet te mesten en de melkproductie te stimuleren, die in het eindproduct terechtkomen. Orale anticonceptiva of hormoonsubstitutietherapie alleen al kunnen het risico op borstkanker met wel 25% verhogen *.
In 1996 nam de Europese Commissie xeno-oestrogenen op in haar lijst van prioritaire risicofactoren. Lucht-, water- en voedselverontreiniging kan optreden als gevolg van het wijdverbreide gebruik van xeno-oestrogenen in de landbouw en voedselproductie *, maar ook als gevolg van de migratie van ftalaten naar voedsel uit plastic verpakkingen. Huidbesmetting met ftalaten komt voor bij het gebruik van deodorants, maar ook bij cosmetische crèmes die ftalaten en parabenen bevatten. U kunt de huidverzorgingsproducten en huishoudelijke chemicaliën die u thuis gebruikt onafhankelijk beoordelen op hun xenoestrogene gevaren met behulp van de onafhankelijke online bron EWG *.
Naast het zoveel mogelijk verwijderen van alle bovengenoemde stoffen uit uw leven, kunt u ook ontgifters gebruiken om ze uit het lichaam te verwijderen. Veel hormoonontregelaars zijn in vet oplosbaar en kunnen zich ophopen in vetophopingen, en de borstklier bestaat grotendeels uit vet. De weefselconcentraties van bisfenol-A bij patiënten met kanker zijn bijvoorbeeld aanzienlijk hoger dan bij patiënten zonder kanker (4,2 versus 1,8 ng/g weefsel) *. Op dezelfde manier hopen parabenen zich op in het borstweefsel *, en hetzelfde kan worden verwacht van andere vetoplosbare stoffen.
Een zekere bijdrage aan het risico op het ontwikkelen van borstkanker, vanwege de grote hoeveelheid groeihormonen die ze bevatten, wordt geleverd door dierlijke melk en daaruit vervaardigde producten, waaronder kaas en zelfs yoghurt *. Bovendien leidt hitte en elke andere behandeling van melk niet tot de vernietiging van de insuline-achtige groeifactor *. Helaas wordt de schade van melk aan de gezondheid van volwassenen in het publieke bewustzijn nog steeds onderschat.
Alcoholgebruik, zelfs in kleine doses, heeft een negatieve invloed op de gezondheid van de borsten. Slechts 15 g pure alcohol per dag (een glas wijn) verhoogt bijvoorbeeld de serum-oestronsulfaatconcentraties met 7,5% *, waardoor de oestrogeen:androgeenverhouding verslechtert. Je moet ook de consumptie van suiker en suikerhoudende voedingsmiddelen en dranken volledig elimineren.
Regelaars voor het insulineniveau. Hoewel er medicatiemethoden zijn om de insuline te verlagen, is de meest natuurlijke methode om het insulineniveau laag te houden het verminderen van de totale hoeveelheid voedsel die u eet en het eten van voedsel met een lage glycemische lading in plaats van voedsel met een hoge glycemische lading. Metformine kan indien nodig als aanvulling worden gebruikt.
Regelaars van oestrogeenniveaus. Het verlagen van de totale oestrogeenspiegels, vooral estradiol, kan het risico op kanker in oestrogeengevoelige weefsels verminderen.
Omdat oestrogenen een beschermende rol spelen voor neurotransmitters, bestaat er legitieme bezorgdheid dat de uitputting van oestrogeen een negatieve invloed kan hebben op de menselijke cognitieve functies; deze veronderstelling is echter nog steeds discutabel *.
Overtollig oestrogeen wordt door de lever gebonden (geglucuronideerd) en via het galkanaal naar de darm geleid voor verdere verwijdering. Na glucuronidering wordt oestrogeen inactief. In de darmen kan het echter weer vrijkomen en terug in het bloed terechtkomen, waardoor de kans op kanker toeneemt. Dit proces is sterk afhankelijk van de samenstelling van de voedselmassa en daarmee van de samenstelling van darmbacteriën. Vezels en de darmbacteriën die zich ermee voeden, vertragen en maken het moeilijk voor oestrogeen om weer in de bloedbaan te worden opgenomen. Dankzij hen wordt overtollig oestrogeen uit het lichaam verwijderd. Daarentegen kunnen vlees en de bacteriën die zich ermee voeden de afgifte en activering van oestrogeen bevorderen.
Naast het verhogen van uw risico op kanker, kunnen hoge oestrogeenspiegels tijdens uw menstruatie matige tot ernstige pijn veroorzaken. Oestrogeen stimuleert de groei van hormoongevoelige cellen in de baarmoeder om deze voor te bereiden op de ontvangst van een eicel. Hoe meer oestrogeen er in de folliculaire fase aanwezig is, hoe dikker het baarmoederslijmvlies wordt. Dienovereenkomstig wordt aan het einde van de cyclus, in de luteale fase, meer van deze cellulaire massa afgebroken en komen er meer pro-inflammatoire prostaglandinen vrij, die spasmen en pijn veroorzaken.
Sommige niet-medicamenteuze behandelingen kunnen de algehele oestrogeenspiegels helpen verlagen.
• Lignanen (uit lijnzaad) en vezels (uit de zemelen van granen – tarwe, rogge, gerst, haver) zijn prebiotica die gunstige omstandigheden creëren waarin darmbacteriën zoals Lactobacillus acidophilus kunnen gedijen. Dit type bacterie zorgt voor een lage activiteit van β-glucuronidase en β-glucosidase. Het verminderen van de activiteit van beide enzymen helpt het proces van oestrogeenuitscheiding via de darmen te verbeteren; het verhogen van de concentratie van geslachtshormoonbindende globulinen (SHBG); verminderde aromatase-activiteit en overexpressie van het HER2-oncogen; en helpt in het algemeen de overleving van de patiënt te vergroten *.
Vrouwen met een hoge inname van lignanen hebben, vergeleken met vrouwen met een lage inname, een 44% lager risico op het ontwikkelen van borstkanker * * *.
Postmenopauzale vrouwen met borstkanker met de hoogste lignan-inname versus degenen met de laagste inname vertoonden een 51% lager risico op sterfte door alle oorzaken, en een 71% lager risico op borstkankersterfte *.
Dosering: 25-30 g/dag *
fijngemalen lijnzaad.
• Lijnzaadolie bevat gebonden ω-3-vetzuren, die de overmatige niveaus van cholesterol en oestrogeen in het bloed verlagen, vooral estradiol (E2) en oestron (E1), waardoor de oestrogeenbalans verschuift ten gunste van het zwakkere oestrogeen, oestriol (E3). Lijnzaadolie helpt hardere vetten en dioxine uit het lichaam te verwijderen.
Elke extra ingenomen 0,1 g ω-3 per dag vermindert het risico op het ontwikkelen van borstkanker met 5% *.
Patiënten met gemetastaseerde borstkanker die chemotherapie op basis van antracyclines ondergaan, kunnen hun overlevingstijd meer dan verdubbelen door 1,8 g docosahexaeenzuur (DHA) per dag te consumeren *.
Bovendien kunnen ω-3-vetzuren (4 g/dag gedurende 3 maanden) de negatieve effecten van aromataseremmers op het botweefsel bij postmenopauzale vrouwen compenseren *.
Dosering: 0,5-1 eetlepel/dag.
Andere plantaardige bronnen die iets minder rijk zijn aan ω-3-vetzuren zijn dederzaadolie (Camelina sativa) en chiazaadolie (Salvia hispanica). In al deze planten is de verhouding ω-3:ω-6 in olie groter dan één, in tegenstelling tot andere plantaardige oliën.
In aanwezigheid van zuurstof, vooral in licht, oxideren ω-3-vetzuren snel, waardoor kankerverwekkende verbindingen worden gevormd. Daarom moeten plantaardige oliën rechtstreeks uit de koelkast van de verkoper worden gehaald en niet langer dan een maand in een koelkast thuis worden bewaard.
• Visolie is een alternatieve, betrouwbaardere bron vanω-3-vetzuren. Terwijl EPA en DHA worden verkregen door alfa-linoleenzuur (ALA) uit lijnzaadolie te metaboliseren, bevat visolie beide in kant-en-klare vorm. Dit is vooral belangrijk voor mensen wier genetische kenmerken hen niet in staat stellen deze vetzuren effectief uit plantaardig materiaal te synthetiseren. En er zijn er nogal wat onder de Europese bevolking.
Bovendien is de metabolische efficiëntie van plant ω-3 erg laag. De conversie van ALA naar EPA en EPA naar DHA wordt geschat op respectievelijk 5-10% en 2-5% *. Vissen ω-3s zijn dus effectiever dan planten ω-3s *. Voor langdurige opslag wordt het echter aanbevolen om visolie in afgesloten gelatinecapsules te kopen vanwege de hoge oxidatiebaarheid. Dosering: maximaal 1 ml/dag *.
• D-glucaraat wordt aangetroffen in grapefruit, appels, sinaasappels, broccoli en spruitjes. Het remt de β-glucuronidase-activiteit; helpt oestrogenen veilig te metaboliseren, binden en uit het bloed te verwijderen en om te zetten in een minder giftige vorm *. D-glucaraat vermindert systemische ontstekingen en remt aanzienlijk de groei van gevestigde borsttumoren bij dieren * *. De combinatie van glucaraat met lage doses retinoïden werkt synergetisch in dierproeven *. Dosering calcium D-glucaraat: 1'200-3'000 mg/dag *.
• Sojamelk (400 ml/dag, ~109 mg/dag isoflavonen) verlaagde gedurende 3 maanden de oestron- en estradiolspiegels met respectievelijk 23% en 27% bij Japanse vrouwen *. Een vergelijkbare daling van de oestrogeenspiegels werd waargenomen bij mannen, zonder effect op androgenen *.
Bij Amerikaanse vrouwen in de pre-menopauze verminderde de dagelijkse consumptie van 1 liter sojamelk (~200 mg isoflavonen) gedurende een maand de oestradiolspiegels in de folliculaire fase met 31% en de oestradiol in de luteale fase met 49%. Tegelijkertijd daalde het niveau van progesteron in de luteale fase met slechts 35% *. Interessant is dat zelfs na het stoppen met sojamelk de oestrogeenspiegels laag bleven gedurende cycli van 2-3 maanden.
Consumptie van soja en sojagerelateerde isoflavonen kan een gunstig effect hebben op de menstruatiecyclus bij jonge vrouwen (20-30 jaar). Uit één onderzoek bleek dat de consumptie van 60 g soja-eiwit per dag (45 mg isoflavonen per dag) de menstruatiecyclus aanzienlijk verlengde door de folliculaire fase te verlengen *. Het hoogste niveau van borstepitheelcelgroei vindt plaats tijdens de luteale fase, dus het verlengen van de folliculaire fase van de cyclus verkort de duur van de luteale fase en kan daardoor het risico op hormoongevoelige vormen van kanker verminderen. Niet alle onderzoeken hebben echter zulke hoge succespercentages aangetoond.
• Jodium lijkt de gevoeligheid van borstcellen voor estradiol te verminderen *.
Veranderingen in levensstijl kunnen een grotere impact hebben op het verlagen van de oestrogeenspiegels dan het nemen van supplementen zonder negatieve effecten te veroorzaken. Bovendien geldt dit voor vrouwen van elke leeftijd en elke menopauzestatus.
Een matige vermindering van de vetinname tijdens de puberteit gaat gepaard met positieve veranderingen in de concentraties en verhoudingen van geslachtshormonen; de oestrogeenspiegels kunnen bijvoorbeeld met 30% worden verlaagd *. Een dieet met een zeer laag vetgehalte (10-12% van de totale calorie-inname) en een hoog vezelgehalte (25 g/dag) gedurende 2 maanden verlaagt het gehalte aan estradiol en oestron bij gezonde vrouwen aanzienlijk zonder enig effect op de ovulatie * * *. Wanneer het vetgehalte in voedsel echter boven de 20% van het totale aantal calorieën stijgt, wordt dit effect verzwakt *.
Het verminderen van de bijdrage van vet aan de calorie-inname van 40% naar 20% vermindert ook aanzienlijk de plasmahormoonconcentraties bij gezonde postmenopauzale vrouwen *. Binnen slechts 14 weken na het verminderen van de vetinname van 68,5 g/dag naar 29,5 g/dag daalde de plasma-estradiolspiegel met 17% *.
In één manipulatief onderzoek werden postmenopauzale vrouwen, met of zonder hormoonsubstitutietherapie, gedurende drie weken op een vetarm (10% totaal aantal calorieën) vezelrijk dieet (65-70 g/dag) geplaatst, in combinatie met lichaamsbeweging. Als gevolg hiervan stegen de SHBG-spiegels (geslachtshormoonbindend globuline) met een kwart, daalden de insulinespiegels met een derde, en daalden ook de body mass index en het totale cholesterol aanzienlijk *. Dit regime verlaagt het niveau van groeifactor IGF-1 aanzienlijk en verhoogt het niveau van IGF-1-bindend eiwit. Bloed afgenomen bij vrouwen na 2 weken in vitro experiment verminderde de groei met 7-18% en verhoogde de apoptose van verschillende borstkankercellijnen met 20-30% *.
Vegetariërs vertonen, vergeleken met alleseters, significant lagere plasma-oestradiol, vrij estradiol, vrij testosteron en significant hogere SHBG *. Het verwijderen van alle soorten alcohol uit uw dieet vermindert de circulerende niveaus van steroïde hormonen, vooral oestrogenen *. Het verminderen van de lichaamsvetmassa zal ook het oestrogeen verminderen, omdat vetweefsel een oestrogeenfabriek is.
Een afname van de oestrogeenactiviteit (zie diagram) kan op verschillende manieren optreden. Bijvoorbeeld door een actiever oestrogeen (estradiol) om te zetten in een minder actief oestrogeen (oestron). Dit kan enerzijds worden bereikt door HSD17β1-dehydrogenase te onderdrukken met specifieke remmers *, en anderzijds door HSD17β2-dehydrogenase te activeren, bijvoorbeeld met retinoïnezuur *.
Sommige flavonoïden hebben in vitro een remmend effect op de 17HSDβ1-activiteit. Dit zijn genisteïne uit sojabonen, lignanen uit vlas *, gossypol uit katoenzaadolie *, genquanine uit elzenzaden, diosmetine uit heggenwikke, scutelarine uit kalotjewortel, fisetin *, chrysine, kaempferol *. Een verschuiving in de verhouding tussen E1, E2 en E3 ten gunste van E1, en vooral ten gunste van E2, genaamd «oestrogeenonbalans», komt over de hele wereld zeer vaak voor. Elke manipulatie gericht op het corrigeren van de oestrogeenonbalans zou de oestrogeenbelasting kunnen verminderen.
De activiteit van oestrogeen wordt verder verminderd door het in een inactieve toestand om te zetten via de chemische reacties van glucuronidatie en sulfatering, en door het te binden aan speciale globulinen, die geslachtshormoonbindende globulinen worden genoemd (SHBG). Een verdubbeling van de serumconcentraties van deze globulinen gaat gepaard met een vermindering van het kankerrisico met 22% *.
Steroïdsulfataseremmers blokkeren de reductie van gebonden oestrogeen naar zijn actieve vorm. Momenteel zijn er verschillende specifieke onomkeerbare steroïdesulfataseremmers ontwikkeld.
Een onbeperkt dieet met weinig dierlijke vetten en geraffineerde koolhydraten, rijk aan voedingsmiddelen met een lage glycemische index, enkelvoudig onverzadigde en ω-3 meervoudig onverzadigde vetzuren en fyto-oestrogenen, kan het hormonale profiel van postmenopauzale vrouwen gunstig veranderen *. In de interventiegroep stegen de niveaus van geslachtshormoonbindend globuline aanzienlijk, vergeleken met de controlegroep, en daalden de serumtestosteronniveaus.
Overschakelen naar een traditioneel «mediterraan» dieet (van een overheersende consumptie van dierlijke vetten en eiwitten naar een overheersende consumptie van plantaardige vetten en eiwitten) gedurende 6 maanden verlaagt de oestrogeenspiegels aanzienlijk (meer dan 40%) *. Een groot deel van dit effect was gebaseerd op duidelijke reducties van specifieke oestrogeenmetabolieten, waaronder hydroxy- en keto-derivaten van estradiol of oestron.
Aromatase-activiteitsremmers. De oestrogeenconcentraties kunnen worden verlaagd door de synthese ervan te remmen. Aromatase is een enzym dat betrokken is bij de omzetting van androgenen in oestrogenen. Verhoogde aromatase-activiteit draagt aanzienlijk bij aan de toename van oestrogeen en verhoogt de onbalans tussen androgeen en oestrogeen, waardoor de tumorgroei wordt gestimuleerd.
Factoren waarvan bekend is dat ze de aromatase-activiteit verhogen, zijn onder meer leeftijd, ontstekingen, zwaarlijvigheid, alcohol, insuline en gonadotropines. Onderzoek heeft ook de aanwezigheid aangetoond van een link tussen obesitas en ontstekingen die de aromatase-activiteit in het borstweefsel stimuleert *, wat waarschijnlijk geassocieerd is met een verhoogd risico op hormoongevoelige subtypes van borstkanker.
Onderdrukking van de perifere en interstitiële oestrogeenactiviteit * met behulp van aromataseremmers helpt het risico op kanker en het opnieuw optreden ervan te verminderen *. Wat betreft het therapeutische effect van het remmen van de tumorgroei zijn aromataseremmers vergelijkbaar met het verwijderen van de eierstokken die geslachtshormonen produceren *.
Er zijn momenteel twee hoofdklassen aromataseremmers die klinisch worden gebruikt. Type I-steroïde geneesmiddelen omvatten formestaan en exemestaan; ze zijn een analoog van het androgeensubstraat, dat competitief maar onomkeerbaar aan het enzym bindt. Niet-steroïde type II-remmers, zoals anastrozol en letrozol, binden zich reversibel aan het enzym en bieden uitzonderlijke potentie en specificiteit tegen aromatase.
Anastrozol * en exemestaan * halveren de incidentie van ER+-borstkanker ruimschoots. Voor exemestaan zijn geen bijwerkingen gemeld, zoals cognitieve achteruitgang, die doorgaans gepaard gaan met behandeling met tamoxifen. Er worden andere nieuwe generatie aromataseremmers ontwikkeld met minder negatieve bijwerkingen. Norendoxifen, een metaboliet van tamoxifen, werkt als een krachtige competitieve remmer van aromatase (IC50=90 nM) en kan ook bijdragen aan de anti-oestrogene activiteit *.
Sommige vrij verkrijgbare aromataseremmers worden gebruikt bij bodybuilding.
ATD (androstatrienedione) is erg populair omdat het goedkoop en effectief is, maar het libido kan verminderen. Gemethyleerde ATD heeft de voorkeur omdat het niet giftig is voor de lever. Dosering: tot 75 mg/dag.
3-OHAT is even effectief als ATD en werkt sneller.
Formestane, ook bekend als 4-OHAD, kan transdermaal worden gebruikt, waardoor niet alleen een lagere dosis nodig is, maar ook een minder frequente dosering.
6-OXO, een onomkeerbare remmer, is ook populair. Suppletie van 300 mg/dag 6-OXO gedurende 8 weken kon, vergeleken met de uitgangswaarde, de vrije testosteronconcentraties met 90%, DHT met 192%, oestron met 22% en de testosteron-oestrogeenverhouding met 53% verhogen *.
De nadelen van synthetische aromataseremmers zijn, naast hun bijwerkingen, onder meer het vermogen van cellen om snel resistentie tegen geneesmiddelen te ontwikkelen *, wat een terugval van de ziekte * en hergroei van de tumor veroorzaakt na 12-18 maanden behandeling. Om de resistentie tegen geneesmiddelen te overwinnen, worden remmers van MEK, Raf, PI3K, mTOR en Akt als mogelijke kandidaten beschouwd *. Helaas zijn tumoren in staat onconventionele routes voor de omzetting van geslachtshormonen te versterken, waarbij ze de geremde traditionele routes omzeilen *.
We mogen de wederzijdse werking van verschillende receptoren en hormonen niet vergeten. Het blokkeren van de route die androsteendion in oestron omzet, kan de omzetting ervan in testosteron verhogen. Daarom kan remming van aromatase zonder gelijktijdige remming van aldo-ketoreductase omstandigheden creëren voor het verhogen van de belasting van de androgeenreceptor. Wat, bij triple-negatieve borstkanker, hoogstwaarschijnlijk contraproductief zal zijn.
Natuurlijke aromataseremmers kunnen qua effectiviteit niet concurreren met synthetische. Ze hebben echter niet zulke sterke bijwerkingen. Ze kunnen afzonderlijk of als onderdeel van complexen de werking van door een arts voorgeschreven aromataseremmers versterken en daardoor de dosering en bijwerkingen ervan verminderen. Er worden veel natuurlijke aromataseremmers in voedingsmiddelen aangetroffen, wat ons enige mogelijkheid geeft om de aromatase-activiteit te beïnvloeden door middel van aanpassingen in het dieet.
Tot op heden zijn ongeveer 300 natuurlijke producten geëvalueerd op hun vermogen om aromatase te remmen, waarvan de meeste zogenaamde zijn. fyto-oestrogenen; er zijn echter slechts enkele positieve onderzoeken gepubliceerd *.
• Polyfenolen.
Flavonoïden die in vitro het meest uitgesproken anti-aromatase-effect vertoonden *:
chrisine, uit de bladeren van Passiflora (Passiflora), 500 mg/dag; apigenine, vervat in de wortel van Salie (Salvia officinalis); 8-prenylnaringenine, gevonden in de kegels van Hop (Humulus lupulus); quercetine uit de bladeren van Ginkgo (Ginkgo biloba); biochanine A uit de bladeren van Rode klaver (Trifolium pratense).
Biochanine vertoont dubbele effecten: het remt de aromatase-activiteit bij lage concentraties, maar is oestrogeen bij hoge concentraties *.
Biochanine is effectief in het verminderen van de groei van oestrogeenafhankelijke MCF-7-tumoren (equivalent dosis 1 mg/kg per dag) *.
Kaempferol, aangetroffen in de bladeren van Ginkgo (Ginkgo biloba), staat ook bekend als een aromataseremmer die de effecten van tamoxifen versterkt *.
Het plantenextract (500 mg/kg) remt krachtig de aromatase-activiteit en vermindert de in vitro en in vivo oestradiolspiegels in ER+-borstkankercellen die aromatase tot overexpressie brengen (AROM MCF-7) *.
Dosering: 40 mg droog extract *,
of 1 ml 10% alcoholextract van plantenbladeren driemaal daags.
In een in vitro onderzoek naar ER+-borstkankercellen (MCF-7) remden flavonoïden de enzymactiviteit van aromatase in de volgende volgorde van afnemend effect: chrysine ⇒ naringenine ⇒ genisteïne ⇒ apigenine ⇒ biochanine ⇒ quercetine. Er werd echter opgemerkt dat de oestrogeniteit van deze fytochemicaliën groter was dan hun aromataseremming *. Bovendien is een algemeen nadeel van flavonoïden hun slechte biologische beschikbaarheid, waardoor hun effect in vivo aanzienlijk wordt verminderd.
Chalconen. 8-isoliquiritigenine, aanwezig in de wortel van Zoethoutplant (Glycyrrhiza glabra), in een concentratie van 36 μM, vermindert de in vitro expressie van aromatase-gerelateerde genen, waardoor de oestrogeenproductie wordt onderdrukt *. In tegenstelling tot veel andere aromataseremmers, die afhankelijk van hun concentratie dubbele effecten vertonen, is isoliquiritigenine in vivo niet oestrogeen en heeft het geen invloed op het baarmoedergewicht bij experimentele muizen *. Dosering: equiv. 800 mg/dag *.
Lignanen zoals enterodiol en enterolacton uit lijnzaad en stilbenen zoals resveratrol uit druivenschillen * zijn ook natuurlijke aromataseremmers.
• Mirrehars (Commiphora myrrha vertoont in vitro een sterk anti-aromatase-effect dankzij de triterpenen die het bevat *.
• Paddestoelen. Oesterzwam (Pleurotus), Champignon (Agaricus bisporus) en enkele andere onderdrukken de aromatase-activiteit * en kunnen de incidentie van borstkanker met 50% verminderen, en in combinatie met groene thee met 90% *. Ethylacetaat-paddenstoelenextract bevat geconjugeerd linolzuur, dat de aromatase-activiteit kan blokkeren. Dosering: 100 g champignons, gemalen in een blender en gekookt *.
• Verse sappen (in volgorde van afnemende anti-aromatase-effectiviteit: granaatappel, rode druif, aardbei, appel, pruim, grapefruit, perzik, sinaasappel). Dosering: 250 ml/dag.
Druif (Vitis).
Rode wijn of druivenpitextract is rijk aan procyanidines en flavonoïden, die een anti-aromatase-effect hebben. Rode wijn verhoogt het vrije testosteronniveau en verlaagt het SHBG-niveau, met een zeer kleine daling van het estradiolgehalte *.
De meest gunstige wijnen zijn Merlot * *,
Pinot Noir, Cabernet, Chardonnay *.
Om de negatieve rol van alcohol te verminderen, kan alcohol vóór het drinken gedeeltelijk worden verdampt door het kort te verwarmen. Dosering: 100 mg extract of 125 ml droge rode wijn per dag *.
Granaatappel (Punica granatum), gefermenteerd sap (wijn), zaadolie en ethanolextract van vruchtwand. Ellaginezuur, dat in alle delen van de vrucht wordt aangetroffen, evenals ellagitanninen die worden gemetaboliseerd tot ellaginezuur, en vooral urolithine B, onderdrukken in vitro de groei van borstkankercellen *,
vooral oestrogeenafhankelijke *,
en remmen aromatase * *.
Granaatappelrode wijn bevat 3 keer meer antioxidanten dan rode wijn *.
• Andere meest genoemde natuurlijke aromataseremmers zijn natriumbutyraat, selenium, zink, magnesium en vitamine D *.
Melatonine* *
kan ook werken als een aromataseremmer in ER+-cellen (T47D) en vertoont een activiteit die vergelijkbaar is met die van letrozol, maar zonder de bijwerkingen van laatstgenoemde. Dosering: 20-40 mg/dag * *.
Metformine lijkt ook enige anti-aromatase-effecten te hebben, omdat het AMPK activeert, het enzym dat verantwoordelijk is voor de oestrogeenbiosynthese in menselijke borstvetcellen * *.
Sildenafil (Viagra™), tadalafil en vardenafil, gebruikt om erectiestoornissen te behandelen, kunnen de oestrogeenbiosynthese behoorlijk effectief onderdrukken (tot 35%) *.
Helaas kunnen aromataseremmers die oraal worden ingenomen alleen effectief zijn bij postmenopauzale vrouwen of bij vrouwen bij wie de eierstokken zijn verwijderd. De reden hiervoor is dat bij vrouwen in de pre-menopauze aromataseremmers, door het verlagen van de estradiolspiegels, de afgifte van gonadotropines uit de hypothalamus stimuleren, en gonadotropines de eierstokken een signaal geven om oestrogeen te produceren om hun natuurlijke niveau te herstellen *. Als gevolg hiervan zal het directe effect van aromataseremmers worden onderdrukt en zullen bijwerkingen optreden, waaronder botverzwakking en het risico op cysten in de eierstokken *. Topisch gebruik van aromataseremmers zal waarschijnlijk een groter effect hebben dan het systemische gebruik ervan.
Er is nog een ander probleem bij het gebruik van aromataseremmers. Onlangs zijn androgene metabolieten geïdentificeerd die worden geproduceerd door andere enzymen, zoals 5α-androstane-3β, 17β-diol (3β-diol), androst-5-ene-3β en 17β-diol (A-diol). Ze activeren ook de oestrogeenreceptor (ERα) *. Door deze metabolische routes te gebruiken als alternatief voor aromatase, kunnen cellen resistentie tegen aromataseremmers ontwikkelen. Er zijn waarschijnlijk nog andere, nog onbekende, oplossingen voor het omzetten van androgenen in oestrogenen.
Regelaars van het oestrogeenmetabolisme. Oestrogene hormonen worden via urine en ontlasting uit het lichaam uitgescheiden nadat ze metabolisch zijn omgezet in minder bioactieve en meer in water oplosbare verbindingen.
De belangrijkste metabolieten van estradiol en oestron zijn hun gehydroxyleerde vormen: 2-OH en 16α-OH; andere metabolieten zijn in relatief kleinere hoeveelheden aanwezig. Hiervan heeft 16α-OH de meest uitgesproken oestrogene activiteit, die de activiteit van de hormonen zelf kan overtreffen * *. De productie van 16α-OH-E1 is verhoogd bij vrouwen met borstkanker of met een hoog risico op het ontwikkelen van borstkanker.
Integendeel, 2-OH-metabolieten hebben enig anti-oestrogeen effect. Lage concentraties 2-hydroxyestron zijn in verband gebracht met een hoger risico op borstkanker bij premenopauzale vrouwen *.
Omdat 2-OH-E2 sneller methyleert dan 4-OH-E2, hoopt dit laatste zich in grotere mate op in de borst dan 2-OH-E2 *.
4-OH-metabolieten beschadigen eiwitstructuren, waaronder DNA, en dragen bij aan zowel het ontstaan van kanker als de resistentie ervan.
Ongeacht de absolute oestrogeenspiegels is het belangrijk om de verhouding tussen sterkere en zwakkere oestrogenen (en hun metabolieten) te verminderen. Dat wil zeggen, verminder de verhouding van estradiol tot oestron en oestriol; 2-OH-oestron tot 4-OH-oestron en 16α-OH-oestron; 2-OH-estriol tot 4-OH-estriol en 16α-OH-estriol.
Veranderingen in het dieet en supplementen kunnen de balans tussen «slechte» en «goede» oestrogeenmetabolieten aanzienlijk verschuiven ten gunste van de laatste.
• Eetpatroon. Het verminderen van de vleesconsumptie en het verhogen van de vezelinname vermindert de concentratie van geconjugeerde steroïde hormonen in de darm; verhoogt het niveau van geslachtshormoonbindend globuline in het bloed, waardoor de biologische beschikbaarheid van oestrogenen wordt beperkt; en verwijdert galgifstoffen uit het lichaam.
• Lijnzaad, versgemalen geconsumeerd, verhoogt de verhouding 2-OH-E1:16α-OH-E1 dankzij de verbetering van de darmmicroflora. Het overzetten van muizen naar een dieet met 10% lijnzaad van het totale voedselvolume remt de groeisnelheid van de getransplanteerde ER–-borsttumor (MDA-MB-435) met 45%, en vermindert de uitzaaiingen ervan met 2,5 keer *.
Bij muizen bij wie een ER+-tumor (MCF-7) was geïmplanteerd, vertraagde de consumptie van lijnzaad ook de groei ervan en versterkte het antiproliferatieve effect van tamoxifen aanzienlijk * *.
Regelmatige consumptie van gemalen lijnzaad verhoogt de serum-2-OH-E1-waarden en de 2-OH-E1:16α-OH-E1-verhouding aanzienlijk bij postmenopauzale vrouwen * * *,
waardoor het risico op premenopauzale borstkanker *
wordt verminderd.
Dosering: 15 g/dag *.
• Indool-3-carbinol (I3C) verhoogt de oestrogeen-2-hydroxylering * * en vertoont een statistisch significante regressie van baarmoederkanker binnen 12 weken na suppletie *. Dosering: 400mg *.
• Diindolylmethaan (DIM), een indool-3-carbinoldimeer, verhoogt ook de 2-OH-E:16-OH-E1-verhouding *, maar verlaagt de plasmaspiegels van tamoxifen-metabolieten *. Dosering: 2×150 mg BioResponse DIM® *.
• Omega-3-vetzuren, voedingsvezels, cimetidine, progesteron verbeteren ook de 2-OH:16α-OH-verhouding.
• Resveratrol in een dosering van 1'000 mg/dag verhoogt het urinegehalte van 2-hydroxyestron (2-OH-E1) bij postmenopauzale vrouwen met gemiddeld 73%, wat leidt tot een gunstige verandering in de 2-OH:16α-OH-E1 verhouding*.
• Genisteïne uit soja hydroxyleert oestrogenen tot minder mutagene en carcinogene metabolieten: 4-OH-E2 en 4-MeO-E1 *. Genisteïne verhoogt ook de concentratie van geslachtshormoonbindende globulinen (SHBG) in het bloed, waardoor het niveau van vrije actieve oestrogenen en androgenen wordt verlaagd. Dosering genisteïne: 150 mg/dag tijdens de behandeling en 40 mg/dag als profylactisch regime. Het consumeren van hele soja biedt echter waarschijnlijk grotere voordelen dan het consumeren van slechts één van de componenten ervan.
• Bioactieve stoffen geïsoleerd uit Zilverkaars (Actaea racemosa) en Rode klaver (Trifolium pratense) versterken de activiteit en mRNA-expressie van het enzym CYP1A1, dat verantwoordelijk is voor het omzetten van oestrogenen in niet-carcinogene metabolieten 2-OH-E1 en 2-OH-E2 * *. In tegenstelling tot wat men vreest, tonen veel onderzoeken aan dat zilverkaars de groei van borstkankercellen niet bevordert, zowel in vitro als in vivo.
• Zoethout (Glycyrrhiza sp.), waterig aftreksel van de wortel. In borstepitheelcellen moduleren verschillende zoethoutsoorten, Glycyrrhiza glabra (GG) en Glycyrrhiza inflata (GI), en hun verbindingen op differentiële wijze de expressie van het oestrogeenontgiftingsgen CYP1A1 en het genotoxiciteitsgen CYP1B1. GG en GG-bevattend glycyrrhetinezuur * en isoliquiritigenine verhoogden de expressie van CYP1A1, terwijl GI en licochalcone A de expressie van CYP1A1 en CYP1B1 verlaagden *.
• 6-prenylnarnigenine uit hopextract verzwakt de door oestrogeen geïnduceerde expressie van CYP1B1 *, waardoor de niet-toxische 2-hydroxylatie van oestrogeen wordt versterkt. Dosering ethanolhopextract: 300 mg/dag.
• Granaatappel. Granaatappelpolyfenolen in concentraties van 100-1'000 μg/ml in vitro remmen het oestrogene enzym 17-bèta-hydroxysteroïddehydrogenase 1 (HSD17B1) van 34% naar 79% in de volgende volgorde van afnemende effectiviteit: zaadolie ⇒ polyfenolen uit gefermenteerd sap ⇒ pericarp polyfenolen *. G ecombineerd gebruik van ellaginezuur met fosfatidylcholine in een verhouding van 1:4 kan de biologische beschikbaarheid ervan verdubbelen *.
• Retinoïnezuur (vitamine A) induceert in vitro, door de activiteit van retinoïnezuurreceptoren, de expressie van het anti-oestrogene enzym 17-bèta-hydroxysteroïde dehydrogenase 2 (HSD17B2), dat zeer actief oestrogeen (estradiol) omzet in een zwak actief oestrogeen (estron) *, en kan daarom het risico op baarmoederkanker en eierstokken verminderen.
• N-acetylcysteïne en resveratrol voorkomen in vitro de oxidatie van oestrogeen tot metabolieten die borstkanker veroorzaken * * *.
• Vitamine B6 maakt in vitro overtollig oestrogeen niet-toxisch door methylering *. B ovendien leidt een verhoging van de intracellulaire B6-spiegels tot een verzwakking van de transcriptionele respons op glucocorticoïden, progesteron, androgeen of oestrogenen. Omgekeerd vertonen cellen met een tekort aan vitamine B6 een verhoogde gevoeligheid voor steroïde hormonen * *.
• Vitamine C speelt een belangrijke rol bij de hormoonsynthese *. Het oraal innemen van 1 g vitamine C per dag verhoogt de oestradiolspiegels, afhankelijk van het initiële niveau van de vitamine in het lichaam, met 20-50% *. Maar tegelijkertijd vermindert het de productie van aromatase in de eierstokken *.
• Vitamine D3 verhoogt in vitro de synthese van progesteron, estradiol en oestron *, terwijl het de expressie van aromatase en inflammatoire cytokines in macrofagen vermindert *, en verbetert ook de botbescherming wanneer de oestrogeenspiegels verlaagd worden *.
• Vitamine E helpt oestrogeen te ontgiften. Sommige (maar niet alle) vormen van vitamine E onderdrukken de effecten van oestrogeen, vooral in het borstweefsel. Het effect van γ-tocotrienol in ER+-borstkankercellen (MCF-7) wordt versterkt in combinatie met EGCG en resveratrol *. Celproliferatie in de aanwezigheid van EGCG (50 μM), resveratrol (25 μM) en γ-tocotrienol (10 μM) was respectievelijk ongeveer 33%, 50% en 58% versus controle. Het gedurende 9 weken voeren van ratten met gemengde γ- en δ-tocoferolen in hoeveelheden van 0,1%, 0,3% of 0,5% van het totale voedselvolume onderdrukte de groei van borsttumoren met respectievelijk 38%, 50% of 80% *.
• Vitamine K2 helpt in vitro de verhouding estradiol:oestron te verlagen door zich te binden aan het oestrogeenenzym 17-bèta-hydroxysteroid dehydrogenase 4 (HSD17B4), dat oestron omzet in estradiol *, en door de oestrogeenactiviteit te remmen door zich te binden aan de receptor *. Helaas kunnen hoge doses vitamine K bloedstolsels bevorderen.
• Jodium kan in vitro de expressie veranderen van minstens 43 verschillende genen die betrokken zijn bij het hormoonmetabolisme, evenals de genen die betrokken zijn bij de regulatie van de celcyclus, de groei en differentiatie van borstcellen *.
• Lichaamsbeweging en een eiwitrijk dieet kunnen ook helpen de 2-OH:16α-OH-verhouding te verlagen.
Een andere oplossing om oestrogenen veilig te metaboliseren is hun glucuronidering en sulfatering, waardoor ze hun biologische activiteit verliezen. Momenteel bekende middelen die oestrogeensulfatie bevorderen zijn celecoxib, resveratrol, quercetine en glucocorticoïden.
Doelstellingen die moeten worden bereikt door het reguleren van het oestrogeenmetabolisme:
- het niveau van 16α-hydroxyestron bij gezonde vrouwen is 10-15 ng/ml in de pre-menopauze, en 4 ng/ml in de post-menopauze;
- het niveau van 2-hydroxyestron bij gezonde vrouwen is 13-23 ng/ml in de pre-menopauze, en 6 ng/ml in de post-menopauze;
- de verhouding van de oestrogeenmetabolieten 2-OH-E1 tot 2-OMe-E1 is 0,6-6 (bij gezonde vrouwen vóór en na de menopauze);
- de verhouding van de oestrogeenmetabolieten 2-OH-E1 tot 16α-OH-E1 is van 1,6 in de premenopauze tot 1,5 in de postmenopauze;
- de verhouding van de oestrogeenmetabolieten 4-OH-E1 tot 4-OMe-E1 is van 0,4 in de premenopauze tot 0,3 in de postmenopauze.
Oestrogeenreceptormodulatoren. Oestrogenen bevorderen de groei van borstkanker door middel van oestrogeenreceptor-alfa (ERα)-signalering, die tot uiting komt in ongeveer 70% van de borstkankers *. Daarom is een andere anti-oestrogene strategie, naast het verlagen van de oestrogeenspiegels, het verminderen van de oestrogeenreceptor (ER)-activiteit in oestrogeengevoelige cellen. Er is echter gemeld dat een dergelijke therapie mogelijk minder effectief is dan aromataseremmers *.
Selectieve oestrogeenreceptormodulatoren (SERM’s), zoals tamoxifen of raloxifene, zijn effectief tegen terugkerende ER+-borsttumoren *. Tamoxifen wordt in de lever gemetaboliseerd met behulp van de enzymen CYP2D6 en CYP3A4. De resulterende metabolieten werken als een ER-antagonist, concurreren met oestrogenen om oestrogeenreceptoren in borstweefselcellen en onderdrukken de transcriptie van oestrogeen-responsieve genen *. De metabolieten van tamoxifen vertonen een grotere affiniteit voor ERα en ERβ dan estradiol: respectievelijk 1,8 en 3,4 maal *. Omdat de ERα- en ERβ-receptoren in verschillende mate tot expressie komen in verschillende weefsels, werkt tamoxifen als een ERα-antagonist in de borst en als ERβ-agonist in de baarmoeder en de eierstokken *, waardoor het risico op kanker in deze organen toeneemt.
Oestrogeenreceptormodulatoren die zonder recept verkrijgbaar zijn, zijn minder effectief, maar ze zijn veiliger en kunnen de effecten van SERM's die door uw arts zijn voorgeschreven versterken, waardoor u uw dosering kunt verlagen. Ze kunnen ook worden gebruikt in plaats van voorgeschreven SERM's nadat ze zijn gestopt.
• Melatonine vermindert in vitro de grootte en het aantal mammosferen van borstkankercellen door de binding van oestrogeenreceptoren in ER+-kankercellen *, inclusief kankerstamcellen * *, te blokkeren. Melatonine heeft een dubbele anti-oestrogene werking: het blokkeert niet alleen het metabolisme van oestrogeen in actievere vormen en houdt het circulerend oestrogeen in een inactieve toestand * *, maar het vermindert ook de gevoeligheid van oestrogeenreceptoren, waardoor de stimulatie van de celgroei wordt verminderd * * .
De combinatie van melatonine met tamoxifen verhoogt de in vitro remming van de groei van borstkankercellen door tamoxifen met een factor 100 *. Het innemen van 20 mg melatonine 's avonds en 20 mg tamoxifen 's middags gedurende 8 maanden veroorzaakte een gedeeltelijke respons bij 28,5% van de patiënten met gemetastaseerde borstkanker die niet reageerden op een voorbehandeling met tamoxifen *. In een ander onderzoek onder een groep van 25 hopeloze kankerpatiënten die niet op alle voorgaande behandelingen hadden gereageerd, produceerde hetzelfde behandelingsregime bij 3 mensen een gedeeltelijke respons en stabiliseerde het de toestand bij nog eens 13 mensen *.
• Knoflook (Allium sativum), vooral wanneer verrijkt met selenium *, remt in vitro de activiteit van de oestrogeenreceptor ERα in borstkankercellen. Diallyltrisulfide (DATS) in knoflookolie in een concentratie van 20 μM vermindert de levensvatbaarheid van ER+-kankercellen (MCF-7 en T47D) met ongeveer een kwart *. In tegenstelling tot sommige andere therapeutische middelen werd de celgroeiremming veroorzaakt door DATS niet opgeheven door overexpressie van estradiol of ERα. Het gebruik van knoflook kan de ontwikkeling van reeds gediagnosticeerde borstkanker in stadium II en III aanzienlijk verminderen *. Intraperitoneale injecties van diallyltrisulfide, aanwezig in knoflookolie, bij muizen verminderden de snelheid van de ontwikkeling van kanker met een factor drie *. Dosering: 200 mg DATS in combinatie met 100 μg selenium *.
Alternatieve bronnen van DATS – gerijpte knoflook (10 maanden oud na malen en mengen met een gelijke hoeveelheid waterige alcoholische oplossing *); zwarte knoflook (knoflook gefermenteerd gedurende 2-4 weken bij 60-90°C en 80-90% vochtigheid); droog knoflookpoeder. Het DATS-gehalte in knoflook bedraagt ongeveer 1-3%, dus de concentraties die nodig zijn om de ER-expressie en -functie te onderdrukken kunnen worden bereikt door 10-15 g rauwe knoflook per dag te consumeren *. Het is onwaarschijnlijk dat de fytonciden in rauwe knoflook een dergelijke hoge knoflookinname mogelijk maken. Ze hebben een brandend effect op het slijmvliesoppervlak van het maagdarmkanaal, vernietigen de darmflora en veroorzaken een slechte adem. Tegelijkertijd is het knoflookproduct in capsules vrij van deze tekortkomingen. Dosering: 10 g/dag rauwe knoflook *, of 500 mg droog extract van oude knoflook *.
• Selenium vermindert in vitro de expressieniveaus van ERα-eiwitten en vermindert de binding van oestradiol aan de oestrogeenreceptor in ER+-borstkankercellen (MCF-7), terwijl het de expressie van ERβ-eiwit in ER–-borstkankercellen verhoogt (MDA-MB-231) *. Bij muizen met ER+-borsttumoren (MCF-7) verhoogde methylselenocysteïne op synergetische wijze de antitumorale werkzaamheid van tamoxifen *. En bij muizen met triple-negatieve borstkanker (MDA-MB-231) verhoogde methylselenzuur synergetisch de werkzaamheid van paclitaxel *. Dosering methylselenocysteïne: tot 7 mg/dag *.
• Hop (Humulus lupulus) bevat 8-prenylnaringenine, dat vele malen sterker aan ERα * bindt dan enig ander fyto-oestrogeen *. Door te concurreren met oestrogeen voor ER, kan het de oestrogene effecten van oestrogeen verminderen *. Hierdoor voorkomen hopextract en 8-prenylnaringenine kwaadaardige degeneratie van de borstklier *. Lage doses hopextract hebben geen oestrogeen effect op de baarmoeder *. Dosering: Hoptabletten van 500 mg met daarin 0,1 mg 8-prenylnaringenine driemaal daags *.
• Indool-3-carbinol (I3C), aangetroffen in kruisbloemige groenten, heeft in vitro een proliferatief effect in ER+-borstkankercellen (MCF-7) bij lage concentraties * * *. Maar bij hoge concentraties (100 μM) heeft het een antiproliferatief effect *, voornamelijk als gevolg van een afname van de expressie van ERα-mRNA *. In tegenstelling tot tamoxifen concurreert I3C niet met oestrogeen voor receptorbinding, maar gebruikt het verschillende mechanismen (ligandbinding aan AHR), en hierdoor kan het het in vitro antiproliferatieve effect van tamoxifen versterken *. De combinatie van I3C en genisteïne verhoogt synergetisch de expressie van GADD (DNA Schade-indicatoreiwit), waardoor de apoptose toeneemt, en zorgt voor een verlaging van de effectieve dosis van elk van deze fytonutriënten *. Dosering: 400 mg/dag *.
• Ellaginezuur * * en linolzuur-isomeren * * in de vrucht van Granaatappel (Punica granatum) verminderen in vitro de binding van estradiol (E2) aan ERα- en ERβ-cellulaire receptoren, waardoor de groei en proliferatie van ER+-borstkankercellen worden geremd. Bovendien vermindert een emulsie van een mengsel van gefermenteerd sap en granaatappelpitolie * de expressieverhouding van ERα:ERβ, die werd gevonden in experimenten met ratten bij een dosering van 5 mg/kg *. Hoewel granaatappelextract op dezelfde manier werkt als tamoxifen en andere SERM’s, lijkt het de celproliferatie of het baarmoedergewicht niet te verhogen bij muizen waarbij de eierstokken zijn verwijderd *.
Granaatappelfruitextract (300 μg/ml) verbetert in vitro de door tamoxifen geïnduceerde oestrogeenremming, het stoppen van de celcyclus en apoptose in borstkankercellen *. Bovendien herstelt het de gevoeligheid voor tamoxifen in tumorcellen die resistent zijn tegen tamoxifen. Polyfenolen in gefermenteerd sap (wijn) vertonen een ongeveer tweemaal zo groot antiproliferatief effect vergeleken met polyfenolen in vers granaatappelsap. Granaatappelzaadolie (100 μg/ml) leidde in vitro tot een onderdrukking van 75-90% van de proliferatie in ER+-borstkliercellen (MCF-7) en veroorzaakte apoptose in 54% van de ER–-cellen (MDA-MB-435) *.
Naast het effect op oestrogeen kan één glas granaatappelsap per dag de serumtestosteronspiegels met gemiddeld 24% verhogen bij zowel mannen als vrouwen gedurende 2 weken *. Bij postmenopauzale vrouwen veroorzaakt de dagelijkse inname van 250 g sap echter een significante daling van de oestron- en testosteronspiegels bij vrouwen *. Dosering: vgl. 500 mg/dag methanolisch granaatappelextract *.
• Epigallocatechinegallaat (EGCG) en andere polyfenolen uit groene thee verhogen de in vitro werkzaamheid van tamoxifen bij ER–-borstkanker zonder de expressie van ER-eiwitten te veranderen*. Behandeling met EGCG remde het invasieve ERα+-fenotype van borsttumorcellen bij muizen *. Bij muizen met geïmplanteerde triple-negatieve borstkanker verminderde de combinatie van EGCG (25 mg/kg) met tamoxifen (75 μg/kg) de tumorgroei met 71% vergeleken met onbehandelde controles *. Uit zes maanden durende onderzoeken bij vrouwen met stadium I of II ER–-borstkanker die 400-600 mg EGCG per dag innamen, bleek echter een zeer kleine afname van de ERα-expressie *. Dosering EGCG: tot 1'200 mg/dag * *, wat overeenkomt met 12-18 kopjes groene thee per dag.
• Baicaleïne, een flavonoïde uit de wortel van Glidkruid (Scutellaria baicalensis), kan binden aan oestrogeenreceptor α (ERα) en G-eiwit-gekoppelde oestrogeenreceptoren (GPER), twee cruciale routes die verband houden met estradiol *. Dit steekt gunstig af bij tamoxifen, dat een antagonist is voor ER maar een agonist voor GPER, wat het risico op baarmoeder- en eierstokkanker verhoogt bij vrouwen die tamoxifen gebruiken. Dosering baicaleïne equivalent aan die onderzocht bij dieren: tot 125 mg/dag *, deze hoeveelheid zit in ongeveer 20 g droge wortel.
• Resveratrol, quercetine en catechine, druivenpolyfenolen die voorkomen in druivenschillen, werken ook als selectieve oestrogeenreceptormodulatoren *. Polyfenolen vertonen echter een aantal ordes van grootte minder activiteit vergeleken met natuurlijke hormonen. Resveratrol bindt bijvoorbeeld ERα en ERβ 7'000 keer zwakker dan estradiol (E2) *. Het voeden van muizen met een mengsel van gelijke delen reveratrol, quercetine en catechine in een totale dosering van 5 mg/kg driemaal daags verminderde de omvang van hun getransplanteerde TNBC-tumoren (MDA-MB-231 en MDA-MB-435) met een derde in vergelijking met controle *, en de belangrijkste bijdrage werd geleverd door resveratrol en quercetine. Vanwege de negatieve effecten van alcohol op de gezondheid van de borsten, moet alcohol vóór consumptie uit rode wijn worden verwijderd; thuis kan dit door verdamping.
• Bèta-sitosterol is een oestrogeenreceptoragonist die zich bij voorkeur aan ERβ bindt *. Kleine supplementen van bèta-sitosterol aan het dieet van muizen (1% van het voedselgewicht) verlagen hun serumestradiolspiegels met een derde, maar de overmatige inname ervan via voedsel of supplementen kan een oestrogeen en proliferatief effect hebben op ER+-borstkankercellen. Naast het reguleren van hormonen verlaagt bèta-sitosterol het cholesterol (LDL), de bloedsuikerspiegel en oestrogeen, onderdrukt het ontstekingen en versterkt het het immuunsysteem *. Dosering: 330-1'200 mg/dag.
• Ginkgetin, een biflavonoïde uit de bladeren van Ginkgo (Ginkgo biloba), induceert in vitro de dood van ER-positieve borstkankercellen door de expressie van oestrogeenreceptoren te remmen *.
Van verschillende natuurlijk voorkomende stoffen, waaronder morin, silybin, epigallocatechinegallaat (EGCG), myricetine, baicaleïne, curcumine, kaempferol of quercetine, is gemeld dat ze de biologische beschikbaarheid van tamoxifen en zijn metabolieten verhogen *.
In tegenstelling tot aromataseremmers is oestrogeenreceptoronderdrukking effectief voor zowel premenopauzale als postmenopauzale vrouwen, maar er zijn een aantal negatieve bijwerkingen waarmee rekening moet worden gehouden bij het gebruik van ER-remmers:
• Bij 16% van de vrouwen die tamoxifen gebruiken, wordt atypische hyperplasie *, vatbaar voor neoplasie *, waargenomen in de baarmoeder en de eierstokken. Het belangrijkste middel om dit te voorkomen blijft progesteron, en zwak alternatieven zijn genisteïne (50 mg/dag, minimaal zes maanden) en metformine (850 mg/dag) * *.
• Vrouwen die tamoxifen gebruiken hebben tot 5 keer meer kans op het ontwikkelen van ER–-tumoren in de contralaterale borst *, die agressiever zijn dan ER+-tumoren, vergeleken met vrouwen die geen behandeling krijgen. Dit effect kan met succes worden tegengegaan door een combinatie van hoge lichamelijke activiteit en epigenetische middelen zoals groene thee-extract en broccoli-extract, evenals andere kruisbloemige groenten zoals koolrabi, spruitjes, bloemkool, mosterdgroen, koolraap, radijs, wasabi/mierikswortel *.
• Een verlaging van de oestrogeenspiegels kan leiden tot verzwakking van de botmassa, wat tot op zekere hoogte kan worden gecompenseerd door de inname van ω-3-vetzuren, vitamine D, cordyceps (5-20 ml/dag), melatonine (3-20 mg/dag) *, en complex van calcium, magnesium en fosfor *.
• Een ander negatief effect van tamoxifen en raloxifen is de zogenaamde «verdikking» van het bloed en verhoogde trombose *. Om deze verschijnselen te compenseren, kan het nemen van medicijnen zoals bromelaïne, aspirine en het beperken van de inname van vitamine K geïndiceerd zijn.
• Tamoxifen vermindert de gevoeligheid van cellen voor insuline aanzienlijk, waardoor diabetes type II ontstaat. Dit effect kan tot op zekere hoogte worden gecompenseerd door het innemen van metformine (500 mg/dag).
• Verlies van oestrogeen leidt tot een verlaging van de plasmaspiegels van koper, chroom, zink en magnesium *. Postmenopauzale vrouwen die een eierstokoperatie hebben ondergaan, of die oestrogeenremmers gebruiken en die niet genoeg groenten en volle granen consumeren, kunnen deze elementen in de vorm van supplementen nodig hebben.
Patiënten die tamoxifen voorgeschreven krijgen, kunnen met hun arts de mogelijkheid bespreken om het te vervangen door raloxifen *, of beter nog, door toremifen of lasofoxifen, die een aanzienlijk lager carcinogeen effect hebben op de baarmoeder en de eierstokken, evenals een aanzienlijk lager risico op een beroerte en trombose/trombo-embolie *. Aan de andere kant is tamoxifen effectiever * en behoudt zijn werking gedurende 5 jaar na stopzetting van het gebruik. En het effect van andere SERM’s kan na verloop van tijd afnemen *.
Een alternatief voor oraal tamoxifen is de gepatenteerde BHR-700-gel (Besins Healthcare), die 4-hydroxytamoxifen (4-OHT) als actief ingrediënt bevat. In tegenstelling tot de tabletvorm kan tamoxifen-gel gemakkelijk door de huid van de borst worden opgenomen en rechtstreeks in de borstklier terechtkomen, waardoor de dosering en bijwerkingen worden verminderd; ook met betrekking tot de baarmoeder. Het heeft echter nog geen klinische proeven ondergaan en goedkeuring van de FDA gekregen.
Een ander alternatief zou zijn om een natuurlijk hormoon, oestriol, te gebruiken in plaats van tamoxifen. Oestriol vertoont een 10 keer zwakker oestrogeen effect dan estradiol. Door te concurreren met estradiol om dezelfde receptor, zou oestriol de proliferatieve activiteit van estradiol kunnen verminderen. Maar een dergelijke therapie bevindt zich nog steeds in de fase van een gewaagd voorstel.
Een andere, meer toegankelijke en bewezen verbetering van hormoontherapie is de toevoeging van een natuurlijk androgeen, progesteron, aan tamoxifen. Bij postmenopauzale patiënten met gevorderde borstkanker verdubbelde het afwisselen van wekelijks tamoxifen (20 mg/dag) met tamoxifen + progesteron (500 mg/dag oraal progesteron) de effectiviteit van tamoxifen in termen van tumorkrimp, ziektestabilisatie en tijd vóór progressie *.
Vanwege het verhoogde risico op voortplantingsorgaankanker, die meestal in een vergevorderd stadium wordt gediagnosticeerd, wordt regelmatige screening aanbevolen voor vrouwen die SERM's gebruiken.
GPER-receptormodulatoren (G-eiwit-gekoppelde oestrogeenreceptor 1). Dit is de derde onlangs ontdekte oestrogeenreceptor, die, samen met ERα en ERβ, wordt beschouwd als een belangrijke modulator van de tumorontwikkeling *. In tegenstelling tot ERα en ERβ, die werken via de controle van genexpressie, werkt GPER op een snellere, niet-genomische manier door activering van signaalroutes die betrokken zijn bij de overleving, proliferatie en invasie van kankercellen. GPER-1 komt wijdverspreid tot expressie in borstkankercellijnen en primaire borsttumoren * *.
De vraag of deze receptor geactiveerd of geremd moet worden, blijft een onderwerp van intens debat vanwege tegenstrijdige onderzoeksresultaten. In verschillende weefsels en onder verschillende omstandigheden (in het bijzonder de aanwezigheid of afwezigheid van het ligand ervan) kunnen GPER-modulatoren op tegenovergestelde manieren werken.
Bij borstkanker is er een verhoogde expressie van GPER-1, wat een marker is van de ziekte en een sterke voorspeller van een slechte prognose *. Omgekeerd wordt de afwezigheid van GPER-expressie geassocieerd met een uitstekende langetermijnprognose van ER+- en PgR+- primaire borstkanker bij behandeling met tamoxifen *. Desondanks leidt behandeling van cellen met GPER-agonisten in vitro tot tumorsuppressie.
GPER-1 is van bijzonder belang bij triple-negatieve borstkanker. Activering van GPER door zijn agonist (G-1) remde de in vitro groei van TNBC-borstkankercellen *.
Het identificeren van GPER-modulatoren is een uitdaging omdat het biologische effect van op GPER gerichte moleculen specifiek kan zijn voor verschillende cellen en weefsels. Screening heeft verschillende effectieve chemische moleculen geïdentificeerd die in staat zijn om GPER * in vitro selectief te remmen, maar ze zijn nog niet allemaal beschikbaar. Er zijn slechts enkele natuurlijke modulatoren van GPER-1 bekend.
• Baicalein, een flavonoïde uit de wortel van Glidkruid (Scutellaria baicalensis), blijkt de meest effectieve bekende GPER-modulator te zijn. Het kan zowel ER- als GPER-receptoren binden *, terwijl tamoxifen ER blokkeert maar GPER stimuleert. De dosis baicaleïne bij mensen, overeenkomend met studies bij muizen, is 125 mg/dag *.
Laboratorium- en prospectieve studies wijzen op een leidende rol van hormonen bij het optreden en de ontwikkeling van de meeste gevallen van hormoonafhankelijke borstkanker. En over het algemeen is het moeilijk om jeugdig en vitaal te blijven als je gedurende je hele leven niet voldoende hormonen op peil houdt. Er is een groot aantal internationale onderzoeken gepubliceerd over de voordelen van natuurlijke hormoonsupplementen bij tekorten. In de medische praktijk wordt de nadruk echter vooral gelegd op oestrogenen. Dit geldt niet alleen voor de officiële geneeskunde, maar ook voor veel klinieken voor alternatieve of complementaire geneeskunde.
Suppletie van belangrijke hormonen lijkt de eenvoudigste, meest directe en goed gecontroleerde interventie voor hormonale deregulering. Hoewel een teveel aan oestrogeen het gebruik van verschillende complexe strategieën vereist om het te verminderen, kunnen tekorten aan andere hormonen gemakkelijk worden gecompenseerd door het gebruik van natuurlijke supplementen. Deze aanpak vereist echter toezicht door een gekwalificeerde specialist.
Er zijn verschillende regels voor hormonale correctie.
1. Het innemen van exogene hormonen is alleen mogelijk nadat hun tekort door analyse is bevestigd. Verrassend genoeg volgen zelfs medische hulpverleners deze regel niet altijd.
Helaas levert de hormonale analyse van geslachtshormonen in weefsel bepaalde problemen op.
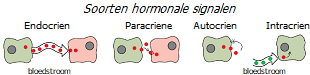
Ten eerste is de eenvoudigste manier om het niveau van hormonen te achterhalen die in het bloed circuleren, dat wil zeggen hormonen die betrokken zijn bij endocriene signalering. Het is veel moeilijker om de niveaus van hormonen te bepalen die betrokken zijn bij paracriene en autocriene signalering. En nog meer – in het intracriene gebied, waar de synthese van actieve hormonen uit hun voorlopers plaatsvindt in dezelfde cellen waarop ze hun effect uitoefenen; daarom is er geen significante lekkage in de bloedvaten *. Dit betekent dat de intracellulaire concentratieniveaus van geslachtssteroïden niet adequaat kunnen worden beoordeeld door de niveaus ervan in het bloed te meten.
Ondertussen bedraagt de intracriene vorming van oestrogeen in perifere weefsels bij vrouwen ongeveer 75% vóór de menopauze en bijna 100% na de menopauze *. Daarom weerspiegelt het focussen op serumniveaus voor hormonale correctie niet voldoende het niveau van hormonen in het weefsel, en kan dit leiden tot een meervoudige overschatting van de dosering van de ingenomen supplementen.
Ten tweede moet, om de biologische activiteit van een bepaald steroïdhormoon te bepalen, het niveau ervan in vrije toestand (niet geassocieerd met specifieke globulinen of albumine) worden bepaald. Omdat alleen hormonen in een vrije staat biologische activiteit vertonen. Helaas tonen serumtests die door de meeste laboratoria worden uitgevoerd meestal de totale hoeveelheid hormonen aan die in het bloed worden aangetroffen, dat wil zeggen de gebonden en ongebonden (vrije) fracties samen. Er wordt aangenomen dat de verhouding tussen gebonden en vrije hormonen tussen 20:1 en 100:1 ligt, maar de werkelijke waarde ervan is niet precies bekend.
De niveaus van steroïde hormonen gemeten in speeksel weerspiegelen waarschijnlijk de niveaus in het borstweefsel beter dan de niveaus gemeten in het bloed * *. Maar helaas zijn speekseltests in klinieken erg duur en zijn online laboratoriumdiensten * * * niet in alle landen beschikbaar.
Ten derde fluctueren de oestrogeen- en progesteronspiegels bij vruchtbare vrouwen, afhankelijk van de dag van de ovulatiecyclus *. Om de toestand adequaat te beoordelen, moet u daarom ten minste twee materiaalmonsters nemen – op de 11e en 20e dag van de 28-daagse menstruatiecyclus, wanneer respectievelijk piekconcentraties van estradiol en progesteron worden waargenomen *.
Hormonale analyse wordt elke 3 maanden uitgevoerd, waarna de specialist beslist of verdere therapie nodig is.
2. Neem bio-identieke hormonen in plaats van synthetische hormonen. Natuurlijke of bio-identieke hormoonmoleculen hebben een moleculaire structuur die perfect overeenkomt met de structuur van hun receptor. Synthetische hormoonmoleculen hebben een moleculaire structuur die anders is dan wat de receptor ervan verwacht. Om deze reden kunnen ze zich niet goed binden aan de overeenkomstige receptoren en zijn ze niet in staat dezelfde fysiologische activiteit te bieden als natuurlijke hormonen. Tot overmaat van ramp veroorzaken veel ervan kankerverwekkende bijwerkingen * *.
Meerdere onderzoeken tonen aan dat progestagenen (synthetische analogen van progesteron) de mammografische borstdichtheid * en de proliferatie van borstcellen aanzienlijk verhogen. Dit gebeurt voornamelijk door stimulatie van de oestrogeenreceptor * * en een significante toename van het aantal genen dat tot expressie komt in vergelijking met het natuurlijke hormoon (2'500 versus 600) *. Tegelijkertijd veroorzaken zowel natuurlijk progesteron als een lage dosis natuurlijk estradiol, transdermaal toegediend, dit negatieve effect niet * * *.
Vrouwen die progestageen plus oestrogeen gebruiken als hormoonsubstitutietherapie (HST) verdubbelen hun risico op borstkanker vergeleken met vrouwen die helemaal geen HST gebruiken. Vrouwen die natuurlijk progesteron innemen in plaats van progestageen in combinatie met oestrogeen, verkleinen dit risico daarentegen *. Orale anticonceptiva die synthetische vormen van progesteron bevatten, verhogen ook het risico op kanker * *.
De enige redelijke verklaring waarom synthetische hormonen nog steeds worden geadverteerd en gepromoot in plaats van natuurlijke hormonen, is de mogelijkheid om hun formule te patenteren en daardoor extra winst te behalen. Helaas gaat dit ten koste van de gezondheid van vrouwen.
3. De dosering van exogene hormonen moet adequaat zijn. De dosering hangt grotendeels af van het individuele geval en wordt bepaald door een specialist op basis van verschillende indicatoren. Supplementen van hormonen die niet als behandeling worden gebruikt, maar als compensatie voor hun tekort, mogen geen hogere concentratie in het weefsel creëren dan fysiologisch. De spiegels van steroïdhormonen mogen niet hoger zijn dan die waargenomen in jongere jaren. Hun verhouding moet ook overeenkomen met de verhouding die in jonge jaren wordt waargenomen.
4. Suppletie van een bepaald hormoon moet de relatie ervan met de antagonist corrigeren en geen onbalans veroorzaken. Om aan deze regel te voldoen, moet u de spiegel van alle andere belangrijke hormonen controleren, en niet alleen die van belang. Dat wil zeggen dat niet alleen estradiol, progesteron, DHEA en testosteron moeten worden gecontroleerd, maar ook cortisol en schildklierhormonen (TSH, T3, T4). De resultaten van de analyse kunnen wijzen op de noodzaak van correctie van andere hormonen.
5. De wijze van toediening van hormonen moet effectief zijn. Bij orale toediening hebben steroïde hormonen een slechte biologische beschikbaarheid en nadat ze vanuit de darm in het bloed zijn terechtgekomen, ondergaan ze metabolische transformaties in de lever, en 90% ervan is gebonden aan eiwitten. In deze vorm worden ze in water oplosbaar en verspreiden ze zich gemakkelijk via het bloedserum door het hele lichaam, maar verliezen ze tegelijkertijd hun biologische activiteit.
Wanneer ze via de huid worden toegediend, komen steroïdhormonen in de bloedbaan terecht zonder eerst de lever te passeren en verspreiden ze zich via het lymfestelsel en blijven in een vrije, bioactieve toestand. Het lokale gebruik van steroïde hormonen als onderdeel van een zalf zal dus doelgerichter en zuiniger zijn en een betere controle mogelijk maken van de hoeveelheid exogeen hormoon dat het lichaam binnenkomt.
Ten slotte moeten op het juiste moment aanpassingen aan de hormoonspiegels en -verhoudingen worden doorgevoerd. Bij vrouwen in de pre-menopauze bereikt de concentratie estradiol dus zijn maximum in de luteale fase van de maandelijkse cyclus, en het is vooral belangrijk om het teveel ervan op dit moment te bestrijden. Melatonine heeft het lichaam alleen 's nachts nodig en mag alleen voor het slapengaan worden ingenomen.
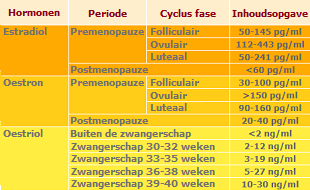
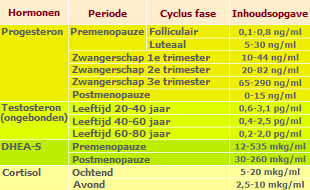
De hier gegeven tabel toont de gemiddelde serumconcentraties van bepaalde hormonen die bij vrouwen in verschillende levensfasen en de ovulatiecyclus zijn waargenomen.
Het niveau en de verhouding van hormonen zijn sterk afhankelijk van leeftijd, zwangerschap, fase van de ovulatiecyclus, voedselsamenstelling en andere omstandigheden.
Als je naar de onderstaande grafiek kijkt van de gemiddelde geslachtshormoonspiegels van vrouwen naarmate ze ouder worden, zul je merken dat de DHEA-productie begint te stijgen op de leeftijd van 6-7 jaar. Naarmate de concentratie toeneemt, beginnen er testosteron, oestron en estradiol uit te worden gesynthetiseerd. In eerste instantie overtreft de groei van oestrogeen de groei van androgenen, waardoor de groei en rijping van de voortplantingsorganen en de borstklier worden bevorderd. Wanneer de vorming van de specifieke kenmerken van het vrouwelijk lichaam is voltooid, neemt de concentratie van androgenen toe, waardoor het proliferatieve effect van oestrogenen wordt geremd en in evenwicht wordt gebracht.
De afname van de DHEA-productie, die begint na de leeftijd van 30 jaar *, leidt tot een geleidelijke afname van de productie van niet alleen oestrogenen, maar ook van testosteron. Parallel hiermee begint enkele jaren vóór de menopauze een geleidelijke afname van de productie van progesteron en testosteron. Het niveau van oestrogeenprecursoren in het serum daalt kritisch, waardoor er eerst een vermindering en vervolgens een stopzetting van de productie van estradiol in de eierstokken plaatsvindt. Tegelijkertijd wordt uit DHEA een toenemende hoeveelheid oestrogeen rechtstreeks in oestrogeengevoelig weefsel gesynthetiseerd.
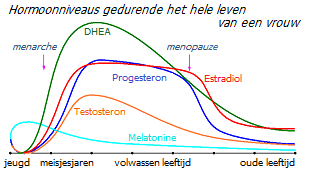
Dat wil zeggen dat de daling van de oestradiolspiegels die tijdens de menopauze wordt waargenomen slechts de laatste hand is aan eerdere functionele veranderingen, en niet de kern van het probleem.
Bovendien, als we aannemen dat de afname van estradiol een beschermende reactie is op een onbalans van oestrogeen:androgeen, dan lijkt het in dit geval onredelijk om te proberen het niveau ervan te herstellen met exogene supplementen zonder tegelijkertijd de oestrogeen:androgeenverhouding te herstellen.
Bij vrouwen met nieuw gediagnosticeerde borstkanker werd een specifiek hormonaal profiel opgemerkt, dat werd gekenmerkt door verhoogde niveaus van estradiol (met 17,2%) en oestron (met 24,5%) in het speeksel, en verlaagde niveaus van oestriol (met 23%), testosteron (met 15,5%) en gesulfateerd dehydroepiandrosteron (DHEA-S) (met 17,5%) vergeleken met controle *.
Andere rapporten hebben ook significant hogere niveaus van totaal * of vrij * * estradiol gemeld bij een groep vrouwen met nieuw gediagnosticeerde kanker vergeleken met controles.
De balans tussen oestrogeen en androgeen bij deze vrouwen is dus aanzienlijk scheef in de richting van hormonen die de proliferatie bevorderen en het risico op borstkanker verhogen. Het corrigeren van het hormonale profiel door het nemen van de juiste hormonen lijkt dus een redelijke oplossing.
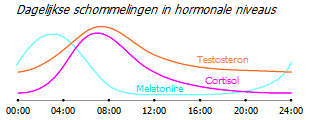
De cortisolspiegels ondergaan normaal gesproken cyclische dagelijkse schommelingen, die in de vroege ochtend tot een maximum stijgen en in de late avond tot een minimum dalen. Kankerpatiënten ervaren zowel een toename van het gemiddelde dagelijkse niveau van cortisol in het speeksel als een egalisatie van het circadiane ritme. Maar hoe duidelijker deze afwijking is, hoe lager het aantal natuurlijke killercellen, hoe meer hun toestand wordt onderdrukt, hoe uitgesprokener de vermoeidheid van patiënten en hoe slechter de prognose voor patiënten met gemetastaseerde borstkanker * * *. Dergelijke abnormale circadiane patronen zijn eerder een oorzaak van de ziekte dan een gevolg, en kunnen ook dienen om het risico op borstkanker te beoordelen bij vrouwen met een niet-gedetecteerde tumor *.
De testosteronniveaus zijn ook het hoogst in de eerste helft van de dag, en het is niet verrassend dat de ochtend de tijd is voor het meest effectieve werk. Tegelijkertijd zijn de melatoninespiegels in het holst van de nacht het hoogst, maar naarmate de cortisolspiegels stijgen, beginnen ze te dalen.
Progesteron (Pg) is een antagonist van estradiol (E2) en oestron (E1) *. Progesteron blokkeert oestrogeenreceptoren, wat leidt tot een afname van de weefselgevoeligheid voor oestrogeen * *. Terwijl estradiol de expressie van anti-apoptotische eiwitten (Bcl-2, survivin) en celproliferatie bevordert, bevordert progesteron de expressie van apoptotische eiwitten (p53) en gaat proliferatie tegen *. Het evenwicht tussen deze twee hormonen bepaalt het lot van borstcellen: dood of onsterfelijkheid. Een verhoging van de concentratie estradiol verhoogt het aantal delende cellen, en een verhoging van de concentratie progesteron neemt af *.
Hoewel estradiol de ontwikkeling van kanker bevordert en progesteron tegengaat, kan estradiol niet als een ramp worden beschouwd en progesteron als een redding. Estradiol is een hormoon van vrouwelijkheid en jeugd. Het vertoont een uitgesproken anabool effect *, en een leeftijdsgebonden daling van het niveau ervan wordt geassocieerd met het begin van de achteruitgang van de gezondheid van vrouwen en de ontwikkeling van leeftijdsgebonden ziekten *. In feite is het probleem niet zozeer het niveau van estradiol zelf, maar een onbalans tussen estradiol en androgenen die het remmen, waaronder progesteron. Dit betekent dat estradiol, wanneer de concentratie ervan toeneemt, niet alleen moet worden onderdrukt, maar ook moet worden gecompenseerd door de overeenkomstige concentratie van zijn natuurlijke antagonist, progesteron.
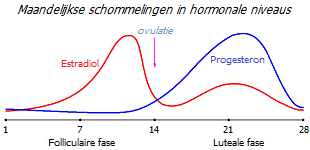
Een volwassen vrouw ervaart maandelijkse cyclische veranderingen in de oestrogeen- en progesteronbalans die het gedrag van hormoongevoelige cellen genetisch opnieuw bedraden om aan de eisen van de ovulatiecyclus te voldoen. Afhankelijk van de periode van de cyclus neemt de concentratie estradiol, die de proliferatie bevordert, of de concentratie progesteron, die in de tegenovergestelde richting werkt, toe. Zolang de gemiddelde concentratie van beide hormonen normaal is, zorgt deze maandelijkse schommel voor een gezond dynamisch evenwicht in hormoongevoelige weefsels.
De eierstokken van reproductieve vrouwen produceren tot 30 mg progesteron per dag tijdens de piek van de luteale fase, die ongeveer op dag 19-22 van de 28-daagse menstruatiecyclus plaatsvindt. De proliferatieve fase van de ovulatiecyclus (ontwikkeling van de follikels in de eierstokken) is tegen die tijd voltooid en een verhoogde productie van progesteron is nodig om te voorkomen dat estradiol overmatige weefselgroei stimuleert. Anders dreigt overmatige proliferatie op de lange termijn (meerdere maandelijkse cycli op rij) ongecontroleerde hyperplasie met de verdere ontwikkeling van baarmoederkanker. Op het hoogtepunt van de luteale fase stijgt het progesterongehalte in het bloedserum van een gezonde vrouw tot gemiddeld 18 ng/ml. Dit is ruim 30 keer minder dan tijdens de folliculaire fase van de cyclus (0,5 ng/ml) *, en 10 keer minder dan tijdens de zwangerschap (170 ng/ml) *. En in het speeksel neemt het niveau van vrij progesteron op het hoogtepunt van de luteale fase toe tot 75-270 pg/ml (1% van het serumniveau) versus 10-25 pg/ml in de folliculaire fase, en versus 12-50 pg/ml bij postmenopauzale vrouwen *.
Hieruit volgt dat ongeveer 18 ng/ml serumprogesteron nodig is om door oestrogeen geïnduceerde weefselproliferatie te remmen; op voorwaarde dat de serumestradiolspiegels binnen de normale grenzen liggen (160 pg/ml) *. Het is gemakkelijk te berekenen dat de verhouding progesteron:oestradiol (Pg:E2) in serum ongeveer 100:1 moet zijn.
Tijdens de menopauze en postmenopauze neemt, samen met een afname van de bijnieractiviteit, het niveau van niet alleen oestrogeen, maar ook androgeen af. Bovendien daalt de concentratie progesteron in het weefsel zelfs eerder en significanter dan de concentratie estradiol. Chronische hormonale onbalans, die «oestrogeendominantie» wordt genoemd, neemt toe. Naarmate de oestrogeenremming wordt verzwakt, neemt het proliferatieve effect ervan toe, waardoor het risico op goedaardige * en kwaadaardige * borsttumoren toeneemt.
Progesteronsupplementen helpen in dit geval niet alleen het risico op tumoren te verminderen, maar verlichten ook de symptomen van oestrogeen ten opzichte van androgeendominantie, zoals verminderde zin in seks en interesse in het leven, verhoogde bloedsuikerspiegel, vermoeidheid, cyclische migraine, wazig denken, prikkelbaarheid, botverlies , zwaarlijvigheid, schildklierdisfunctie *. Bovendien lijkt het innemen van fysiologische niveaus van natuurlijk progesteron tamelijk veilig. Verschillende grootschalige onderzoeken hebben geen verband gevonden tussen hogere serumprogesteronspiegels en het risico op borstkanker bij premenopauzale * * of postmenopauzale * vrouwen.
In tegenstelling tot progesteron wordt estradiol zowel in de postmenopauze als in de pre-menopauze geassocieerd met een verhoogd risico op ER+/PR+-kanker met een factor 1,9 tot 2,6; oestron met een factor 1,8 tot 2; testosteron met een factor 1,4 tot 2; androsteendion met een factor 1,5 tot 1,7 en DHEA met een factor 1,1 tot 2 bij het vergelijken van groepen met de hoogste en laagste niveaus van elk hormoon * * * *. De laatste drie hormonen zijn voorlopers van oestrogeen. In omstandigheden met krachtige aromatase-activiteit duiden hoge concentraties van deze hormonen op hoge concentraties estradiol en oestron, die het risico op kanker verhogen. Androgenen zelf kunnen dit risico echter juist verminderen *. Nu we deze feiten hebben samengevat, keren we nog steeds terug naar de fundamentele reden voor het risico op hormoongevoelige kanker: de dominantie van estradiol over andere hormonen.
Adequate progesteronspiegels zijn niet alleen belangrijk tijdens de postmenopauze. In de premenopauze worden hoge niveaus van endogeen progesteron, en daarmee een hogere serumprogesteron:estradiol-ratio, in verband gebracht met een lager risico op invasieve borstkanker *. Als bij gezonde vrouwen in de pre-menopauze het gemiddelde niveau van progesteron in het serum in de ochtend op dag 21 van de cyclus 17,6 ng/ml bedraagt, dan is dit bij vrouwen met hyperplasie 13,9 ng/ml en bij vrouwen met kanker 11,4 ng/ml *. Premenopauzale vrouwen met een regelmatige menstruatiecyclus die de hoogste serumprogesteronspiegels hadden (>13,5 ng/ml) versus vrouwen met de laagste spiegels (<9 ng/ml) hadden een 8 maal lager risico op het ontwikkelen van borstkanker *. Omgekeerd hadden vrouwen met een tekort aan progesteron, vergeleken met vrouwen met een normaal progesterongehalte, een 5,4 maal grotere kans op borstkanker en een 10 maal grotere kans om aan kanker te overlijden *.
Vrouwen met de hoogste niveaus van progesteron in hun bloed tijdens de zwangerschap, vergeleken met vrouwen met de laagste niveaus, vertoonden een sterke trend naar een verminderd risico op toekomstige borstkanker *. Voor vrouwen jonger dan 51 jaar was het verschil in risico op borstkanker tussen de twee groepen bijvoorbeeld maar liefst 70%. Deze gegevens zijn misschien onvolledig, maar ze bieden een doel waar we naar moeten streven: ongeveer 18 ng/ml serumprogesteron tijdens de luteale fasepiek bij een overeenkomstige oestradiolconcentratie.
In in vitro-experimenten vertoonde progesteron in een concentratie die dicht bij die in het derde trimester van de zwangerschap lag een sterk antiproliferatief effect op ER+/PR+-tumorcellen *. In tegenstelling tot chemotherapiemedicijnen, die in gelijke mate op alle cellen inwerken, stimuleert progesteron alleen de dood van die cellen waarin de normale regulatie van het zelfmoordprogramma verstoord is (dat wil zeggen kankercellen). En in dierproeven versterkte progesteron het antiproliferatieve effect van tamoxifen *. Progesteronsupplementen kunnen dus gunstig zijn voor vrouwen met een progesterontekort. Progesteron, aangebracht als een gel op de borsten, onderdrukt de door oestrogeen geïnduceerde celproliferatie * en kan het risico op borstkanker halveren bij premenopauzale vrouwen met goedaardige tumoren *.
De concentratie progesteron in het speeksel van gezonde vrouwen in de pre-menopauze tijdens de luteale fase ligt gewoonlijk tussen 0,3 en 0,5 ng/ml. De fysiologische dosering van transdermale progesteronsupplementen om een gemiddeld speekselgehalte van 0,5 ng/ml te bereiken is 12-15 mg/dag *. Om dit te doen, kunt u een receptcrème of zelfgemaakte crème gebruiken, die wordt bereid door 900-1'000 mg natuurlijk progesteron te mengen met 60 gram neutrale crème. De crème wordt rechtstreeks op de borst aangebracht (1 g/dag, d.w.z. ongeveer een kwart theelepel). Het verhogen van de dosering tot deze norm zou soepel moeten gebeuren, over een periode van 2 weken of langer.
Progesteron (15 mg) wordt na aanbrengen op de huid snel geabsorbeerd en na 2-3 uur bereiken de piekniveaus in het speeksel 12 ng/ml. Na 8 uur daalt het niveau met 80% – tot 1,5-3 ng/ml, en na 24 uur – tot 0,3 ng/ml *. Als het doel is om plotselinge hormonale schommelingen te voorkomen, kan de procedure in 2-3 doses worden verdeeld, waarbij een overeenkomstig kleiner deel van de crème wordt ingenomen.
Transdermale toediening van steroïde hormonen is de voorkeursvorm voor de behandeling van borsten bij vrouwen. Studies naar lokale toediening van geslachtshormonen aan verschillende lichaamsomgevingen suggereren dat ze in dit geval voornamelijk niet via de bloedbaan, maar via het lymfestelsel aan weefsels worden afgegeven. Hieruit volgt dat lokale hormoontherapie effectiever is voor weefsels met een goed ontwikkeld lymfestelsel, zoals de borstklier, baarmoeder, hersenen en het immuunsysteem. Weefsels met een minder ontwikkeld lymfestelsel (botten en skeletspieren) zullen daarentegen minder worden beïnvloed door hormoontherapie. Aan de andere kant zullen lokaal toegediende geslachtshormonen (zoals E2 en Pg) minder effectief zijn in het stimuleren van botgroei bij menopauzale osteoporose, en testosteron zal minder effectief zijn in het vergroten van de spiermassa bij androgeendeficiëntie-geïnduceerde sarcopenie *.
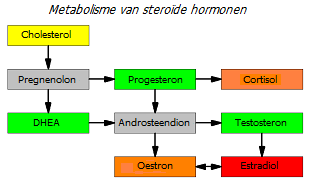
Progesteron is het voorloperhormoon van oestrogeen. Hieruit worden eerst androsteendion en testosteron gesynthetiseerd, en vervolgens worden oestron en estradiol gesynthetiseerd met behulp van het aromatase-enzym. Dit betekent dat wanneer de aromatase-activiteit hoog is (wat gebeurt naarmate we ouder worden), progesteronsupplementen een disbalans tussen progesteron en oestradiol kunnen veroorzaken. Hieruit volgt dat het voor een succesvolle hormonale correctie de moeite waard is om op zijn minst zwakke (natuurlijke) aromataseremmers te gebruiken, zoals granaatappelsap, zoethout, ginkgo biloba, melatonine en champignonpoeder.
Nogmaals benadrukken we dat niet alleen het niveau van het hormoon zelf belangrijk is, maar ook de relatie ervan met de niveaus van andere hormonen, evenals de cyclische veranderingen in deze niveaus. Progesteron wordt niet voorgeschreven aan vrouwen in de pre-menopauze met een tekort aan oestrogeen. Premenopauzale vrouwen met een teveel aan oestrogeen beginnen met het innemen van progesteron op de 12e dag van de cyclus en stoppen hiermee 2 dagen vóór het geplande einde van de cyclus, of tot het plotselinge einde ervan. En postmenopauzale vrouwen nemen het 3 weken per maand onafgebroken, en daarna een week vrij *. Als de hormonale onbalans van progesteron: estradiol ten gunste van estradiol onbeduidend is, moet de dosering van de crème minder dan 1 g/dag zijn. En als de crème wordt gebruikt als pre-operatief preparaat gedurende 2 weken, kan de dosering worden verdubbeld; en het zal beter zijn als dit gebeurt tijdens de luteale fase van de cyclus. In ieder geval is regelmatige controle van de niveaus van beide hormonen vereist.
Extreem hoge niveaus van progesteron (ongeveer 186 ng/ml in de luteale fase) worden echter ook in verband gebracht met een verhoogd risico op borstkanker en zijn net zo gevaarlijk als lage niveaus van progesteron *. Progesteron verhoogt de expressie van een immunomodulerend eiwit dat bekend staat als progesteron-geïnduceerde blokkerende factor (PIBF) *. Dit eiwit wordt tijdens de zwangerschap in overmaat geproduceerd, waardoor wordt voorkomen dat immuunkillercellen de foetus vernietigen. Overmatige hoeveelheden progesteron zullen dus de activiteit van immuun-NK-cellen onderdrukken, waardoor de tumorgroei wordt bevorderd. Dit benadrukt nogmaals de noodzaak van constante laboratoriummonitoring van adequate niveaus en balans van de belangrijkste geslachtshormonen.
Er is een klein aantal planten met progestagene activiteit bekend, maar hun activiteit is laag en zeer slecht onderzocht *.
• Rode klaver (Trifolium pratense). Van klaver en het ethanolextract ervan is gemeld dat ze een zwak progestageen effect vertonen *. Blijkbaar is dit te wijten aan het feit dat het daarin aanwezige kaempferol een gedeeltelijke PR-agonist is.
• Monnikspeper (Vitex agnus-castus) bevat kleine hoeveelheden apigenine, wat een progestageen effect lijkt te hebben *, bevestigd in experimenten met apen * *.
Uit speciale onderzoeken blijkt dat natuurlijk progesteron, in tegenstelling tot zijn synthetische vormen, borstkanker niet bevordert, maar er juist tegen beschermt *. Bovendien lijkt het de invasie en migratie van borstkankercellen te onderdrukken, ongeacht hun progesteronreceptorstatus *. Bovendien kan progesteron ook nuttig zijn bij het voorkomen van hart- en vaatziekten en neurodegeneratieve aandoeningen zoals een beroerte.
De combinatie van oestrogeen en progesteron bij HST brengt een lager risico op borstkanker met zich mee dan alleen oestrogeen. Hoe dan ook kan langdurige HST (langer dan zes jaar) dit risico met zich meebrengen *.
Voordat u probeert het tekort aan progesteron te compenseren door middel van suppletie, is het verstandig om te proberen de hormonale balans te normaliseren met natuurlijke middelen, zoals het verminderen van de blootstelling aan gifstoffen en stress; matige lichamelijke activiteit; kwaliteitsslaap; gezonde voeding (hoge inname van koolhydraten en vezels, lage inname van vet en dierlijke eiwitten). De emotionele toestand is belangrijk. Naarmate de stress toeneemt, stijgt de cortisolspiegel, en omdat cortisol wordt gemaakt uit progesteron, put chronische stress progesteron uit *. Ontspanning wordt aanbevolen om de negatieve effecten van chronische stress te verminderen.
Testosteron (Т) is het belangrijkste androgeen, niet alleen bij mannen, maar ook bij vrouwen, hoewel de testosteronniveaus bij vrouwen aanzienlijk lager zijn. Net als estradiol en progesteron wordt testosteron bij vrouwen geproduceerd in de eierstokken en zorgt het voor een evenwicht tussen oestrogeen en androgeen *. De toevoeging van testosteron aan oestrogeen verlaagt de ERα:ERβ-verhouding aanzienlijk *; en omdat ERα een aantal genen activeert die geassocieerd zijn met borstepitheelproliferatie, vermindert het het risico op borstkanker *.
Hoge androgeenspiegels bij gezonde vrouwen onderdrukken de borstproliferatie zo sterk dat ze borstatrofie kunnen veroorzaken, wat wordt gezien bij vrouwelijke atleten * en transseksuelen * die hoge doses androgeensupplementen gebruiken. Een teveel aan androgeen veroorzaakt ook polycysteus ovariumsyndroom, hoewel het relatieve risico op borstkanker gehalveerd kan zijn * *. Omgekeerd wordt androgeensuppressie bij mannen geassocieerd met gynaecomastie *, en mutaties in de androgeenreceptor veroorzaken borstkanker bij mannen *. Er is ook vastgesteld dat de combinatie van een anti-oestrogeen (tamoxifen) met een androgeen (fluoxymesteron) de effectiviteit van het anti-oestrogeen verhoogt en de ontwikkeling van de ziekte remt in vergelijking met alleen anti-oestrogeen * *. Dergelijke waarnemingen suggereren een beschermende rol voor biologisch beschikbare androgenen bij het tegengaan van de proliferatieve effecten van oestrogenen op borstweefsel * *.
Ernstige dalingen van de testosteronspiegels beginnen bij vrouwen al vanaf de leeftijd van 30 jaar * op te treden en worden intenser richting de menopauze, wat gepaard gaat met een leeftijdsgebonden toename van het risico op borstkanker. De toename van de incidentie van hormoongevoelige borstkanker treedt op op de leeftijd van 30 jaar, terwijl de toename van de incidentie van andere vormen van kanker vooral op de leeftijd van 50 jaar plaatsvindt.
Bij postmenopauzale vrouwen met borstkanker zijn, vergeleken met gezonde vrouwen van dezelfde leeftijd, de speekselspiegels van zowel DHEA-S als vrij testosteron aanzienlijk lager (respectievelijk 17,2% en 15,5%) *. Hun oestrogeen:androgeenbalans wordt dus verschoven ten gunste van oestrogeen. Met moderne behandelingen worden de symptomen van de menopauze en het falen van de eierstokken meestal gecorrigeerd door alleen estradiol en progesteron aan te vullen, zonder rekening te houden met testosteron. Met moderne behandelingen worden de symptomen van de menopauze en het falen van de eierstokken meestal gecorrigeerd door alleen estradiol en progesteron aan te vullen, zonder rekening te houden met testosteron. Het negeren van testosteron zorgt vermoedelijk niet voor een adequate balans tussen oestrogeen en androgeen.
Een tekort aan testosteron is vooral een probleem bij vrouwen in de pre-menopauze. Sommige andere vrouwen hebben echter mogelijk ook exogeen testosteron nodig. Bijvoorbeeld voor vrouwen die een hoge dosis metformine innemen (1'500 mg/dag) *. Metformine verlaagt de oestradiolspiegels, maar doet dit vooral door de spiegel van zijn voorloper, testosteron, te verlagen *.
Er bestaat een natuurlijke bezorgdheid dat testosteron contraproductief zou kunnen zijn bij borstkanker, omdat het door aromatase in estradiol zal worden omgezet. Maar dit risico lijkt afhankelijk te zijn van de menopauzestatus. Bij vrouwen in de pre-menopauze zijn verhoogde testosteronniveaus niet geassocieerd met een verhoogd risico op borstkanker. Maar bij postmenopauzale vrouwen die last hebben van oestrogeendepletie en een verhoogde vetaromatase-activiteit hebben, worden hogere testosteronniveaus geassocieerd met een hoger risico op borstkanker *.
Uit een onderzoek onder postmenopauzale vrouwen bleek inderdaad een toename van 248% in de incidentie bij degenen die een combinatie van estradiol en testosteron gebruikten, en een toename van 15% in de incidentie bij degenen die alleen estradiol gebruikten, vergeleken met degenen die helemaal geen hormoonsubstitutietherapie gebruikten *.
In tegenstelling tot deze observatie toonde een manipulatief onderzoek bij premenopauzale primaten aan dat testosteron de door oestradiol geïnduceerde proliferatie met 40% verminderde, terwijl progesteron dat niet deed *. Omgekeerd resulteerde de blokkade van androgeenreceptoren bij normale vrouwelijke primaten in een meer dan tweevoudige toename van de proliferatie van borstepitheel. De toevoeging van kleine fysiologische doses testosteron aan de standaard oestrogeentherapie verzwakte echter de door oestrogeen geïnduceerde proliferatie vrijwel volledig *. Onderzoekers hebben opgemerkt dat hormoonsubstitutietherapie alleen succesvol kan zijn als alle drie deze hormonen tegelijkertijd worden gebruikt, en niet slechts één of twee ervan.
Een manipulatieonderzoek bij postmenopauzale vrouwen liet vergelijkbare resultaten zien. Terwijl oestrogeen/progestageen hormoonsubstitutietherapie de borstepitheelproliferatie aanzienlijk verhoogde, maakte testosteronsuppletie dit effect teniet *.
Er zijn verschillende grootschalige onderzoeken uitgevoerd om het effect van serumconcentraties van verschillende geslachtshormonen op het risico op borstkanker op te helderen. In een vergelijking van vijf groepen postmenopauzale vrouwen met verschillende serumhormoonconcentraties was er een significante toename van het risico op borstkanker tussen de groepen met de hoogste en de laagste concentratie bij hogere absolute waarden van androgenen (DHEA-S, androsteendion, testosteron) en oestrogenen (oestron, estradiol); en vooral vrij estradiol (2,3 keer) en vrij testosteron (2,5 keer) * * * *. Onderzoekers waren het erover eens dat op weefselniveau de ontwikkeling van borsttumoren mogelijk meer wordt veroorzaakt door een teveel aan oestrogeen dan door androgeen. Maar in tegenstelling tot deze consensus stelde hun conclusie categorisch dat “onze gegevens sterk bewijs leveren tegen het gebruik van androgenen bij postmenopauzale hormoontherapie.”
Intussen is aromatase actief in het borstweefsel *, dat ter plekke testosteron omzet in estradiol. Daarom kan het verband tussen hoge testosteronniveaus en het risico op kanker, waargenomen in de hierboven genoemde onderzoeken, waarschijnlijker een stijging van de oestrogeenspiegels weerspiegelen bij toenemende androgeenspiegels, d.w.z. weerspiegelen aromatase-activiteit. In de onderzoeken waarbij rekening werd gehouden met oestrogenen was er geen verband tussen testosteron en borstkanker *.
Helaas heeft al dit enorme werk zich geconcentreerd op het vergelijken van de absolute waarden van hormonen in het serum, waarbij de vergelijking van de verhouding van hun waarden op de plaats die ons interesseert, namelijk in het weefsel, wordt genegeerd. Maar zelfs serumwaarden kunnen veel vertellen over het ziekterisico bij postmenopauzale vrouwen. In onderzoeken waarbij de gegevens open-label waren en vergelijking van absolute waarden mogelijk waren, werd een gemiddelde van 7% verhoogde serumestradiol:serumtestosteron-ratio waargenomen in de casusgroepen vergeleken met de controlegroepen * * * * *.
Er is soortgelijk uitgebreid onderzoek gedaan bij vrouwen in de pre-menopauze. Hier hadden progesteron en testosteron, in tegenstelling tot andere hormonen, vrijwel geen effect op de morbiditeit *. Ook hier werd echter geen rekening gehouden met hormoonverhoudingen. Maar een studie van open data-studies over dit onderwerp toont ook een gemiddelde superioriteit van 7% in de serumestradiol:testosteron-ratio in de casusgroep versus de controlegroep * * * *.
Uit het multinationale onderzoek bleek ook dat andere geslachtshormonen dan DHEA-S en testosteron significante lineaire associaties vertoonden met borstkanker bij postmenopauzale vrouwen. Hierbij hadden vrouwen bij wie na gemiddeld drie jaar de diagnose borstkanker werd gesteld, een estradiol:testosteron-ratio die 17% hoger was dan bij gezonde controlevrouwen *. Het verschil in weefselverhoudingen zou blijkbaar nog groter moeten zijn * *.
Andere klinische onderzoeken vonden ook geen negatief verband tussen fysiologische doses testosteron (tot 300 μg/dag) en het risico op kanker bij postmenopauzale vrouwen * *. In een 6 maanden durende klinische studie bij een groep postmenopauzale vrouwen die transdermaal testosteron (300 μg/dag) gebruikten naast een combinatie van estradiol (2 mg/dag) en synthetisch progesteron (1 mg/dag), was de proliferatie van borstcellen bijna volledig gestopt. Tegelijkertijd nam de celgroei in de groep zonder testosteronsuppletie vijf keer toe ten opzichte van het oorspronkelijke niveau *. Postmenopauzale vrouwen die testosteronsuppletie (300 μg/dag transdermaal) gebruiken, ervaren ook aanzienlijke verbeteringen in de kwaliteit van leven op gebieden als psychologisch welzijn en seksleven *.
Uit een systematische review van de publicaties bleek dat het gebruik van transdermaal testosteron bij postmenopauzale vrouwen de incidentie van borstkanker niet verhoogt *. Om de zorgen eindelijk weg te nemen, kun je testosteron combineren met aromataseremmers. De beste toedieningsmethode lijkt de implantatie van testosteroncapsules te zijn. Dit zal voorkomen dat het via de algemene bloedbaan andere delen van het lichaam binnendringt, wat ongewenste bijwerkingen veroorzaakt, en zal ook de binding van vrij testosteron door de lever vermijden.
Subcutane implantatie in de borst elke 3 maanden van twee capsules met een combinatie van testosteron (120 mg) en een aromataseremmer (anastrazol, 4-8 mg) vermindert de groei van ER+/PR+/AR+-borsttumoren aanzienlijk en keert deze zelfs om *. Drie implantaten (60 mg testosteron en 4 mg anastrazol) gedurende een behandeling van 46 dagen verminderden het volume van de AR+/ER+/HER2–-tumor van de patiënt met zeven keer, en in 13 weken tijd met twaalf keer *. Een vergelijkbare tumorregressie binnen 4 maanden werd bij de patiënt waargenomen als gevolg van implantatie van testosteron met anastrazol, een andere aromataseremmer *. Bij oudere vrouwen die deze therapie als profylaxe volgden, was de incidentie ruim 3,5 keer lager dan verwacht *. De berekende dosis testosteron die gedurende 100 dagen door de capsule werd afgegeven, was ongeveer 20 μg/kg, oftewel 1'500 μg/dag. Hierdoor waren de serumtestosteronniveaus bij patiënten meerdere malen hoger dan het fysiologische niveau, en zelfs nog hoger dan het initiële niveau *.
Er is ook succes gemeld bij de behandeling van uitgezaaide borstkanker die resistent is geworden tegen hormoontherapie met alleen testosteron. Hier was de dosering aanzienlijk lager: patiënten kregen intramusculair testosteronpropionaat (250 mg tweemaal per vier weken, en daarna regelmatig eens per vier weken). Bij 41,5% van de patiënten bleef de ziekte zich ontwikkelen, bij 41,5% stabiliseerde de ziekte, bij 15% was sprake van gedeeltelijke regressie en bij 2% was er sprake van volledige regressie *. De overleving van de patiënt werd met gemiddeld 1 jaar verhoogd. Testosteron heeft echter hetzelfde probleem als andere hormonen: cellen kunnen resistent worden tegen hormoontherapie, waardoor de effectiviteit ervan na verloop van tijd afneemt.
Net als bij andere geslachtshormonen is het, om de behoefte aan testosteronsupplementen te bepalen en de dosering ervan te bepalen, noodzakelijk om het huidige bloedniveau te kennen. Voor vrouwen in de vruchtbare leeftijd die geen tekort aan testosteron hebben, of voor vrouwen met contra-indicaties, wordt testosteronsuppletie niet aanbevolen *. Bovendien moet u het hormoonreceptorprofiel van de tumor kennen, omdat veel subtypes van borstkanker de androgeenreceptor tot expressie brengen *, inclusief de subtypes die geen oestrogeen- of progesteronreceptoren hebben (TNBC-tumoren) * *. Voor patiënten met dergelijke tumoren kan behandeling met androgeenreceptorremmers in plaats van behandeling met testosteron worden overwogen.
De testosteronproductie bij een vruchtbare vrouw bedraagt 300 μg/dag. Bij een bevestigd matig testosterontekort bij postmenopauzale vrouwen kan een dosering van 150 μg/dag dus voldoende zijn om het tekort te elimineren. In dit geval zou het nuttig zijn om de inname van testosteron te combineren met natuurlijke aromataseremmers die in voedingsproducten aanwezig zijn. Voor postmenopauzale vrouwen met overgewicht kan een dergelijke remmer metformine zijn (500 mg/dag).
Testosteron kan, net als estradiol, oestron en progesteron, het beste plaatselijk worden gebruikt in plaats van inwendig *. Transdermale toediening zorgt voor een hoge biologische beschikbaarheid van vrij testosteron. Sublinguaal wordt testosteron voor ongeveer 99% geabsorbeerd, op dezelfde manier als topisch aangebracht testosteron in een dimethylsulfoxide-oplossing; terwijl slechts 20% van het testosteron wordt geabsorbeerd uit transdermale crème, hetzelfde als testosteron dat oraal wordt ingenomen.
Om testosteronzalf te bereiden, meng je 10 mg injecteerbaar testosteron enanthaat (75% feitelijk testosteron) met 30 g ricinusolie en 25 ml 99% dimethylsulfoxide *. Breng 5 dagen per week 1 g 's morgens aan – op de borst bij problemen met de borstklier, of op de vagina om vaginale atrofie te voorkomen. Maar voordat u testosteron gaat gebruiken, moet u er natuurlijk, net als elk ander geslachtshormoon, zeker van zijn dat er een tekort aan vrij testosteron is, en vervolgens de dosering aanpassen aan het huidige niveau en lichaamsgewicht.
Dehydroepiandrosteron (DHEA) is het zogenaamde «levensduurhormoon» dat in de bijnieren wordt geproduceerd. Het is het voorloperhormoon van oestrogeen en androgeen; en ongeveer de helft van al het androgeen wordt bij vrouwen door dit hormoon geproduceerd *. DHEA vertoont antitumoreffecten * *, vooral door de proliferatie en migratie van cellen *, inclusief borstcellen * * *, te remmen, zoals aangetoond door talrijke preklinische en observationele onderzoeken *. Omgekeerd worden lagere niveaus van DHEA in verband gebracht met sommige soorten kanker, waaronder borstkanker *.
Het voordeel van DHEA ten opzichte van andere androgenen is dat het, bij fysiologische doses, alleen in bepaalde intracriene doelweefsels die over het juiste fysiologische enzymatische mechanisme beschikken, wordt omgezet in androgenen en/of oestrogenen. Hierdoor is de werking van DHEA beperkt tot alleen deze weefsels, waardoor andere weefsels onaangetast blijven. En daardoor worden de mogelijke bijwerkingen geminimaliseerd die worden waargenomen bij vrouwen in de pre-menopauze bij systemische toediening van androgenen of oestrogenen *.
Naarmate het lichaam ouder wordt, neemt de productie van oestrogeen en androgeen in perifere doelcellen af als gevolg van verminderde bijniersynthese van DHEA en DHEA-sulfaat (DHEA-S). Tijdens de menopauze bereikt deze afname gemiddeld 70% *, en blijft verder afnemen tot 95%, zij het met grote verschillen tussen vrouwen *. Als het lichaam van een vrouw tijdens de vruchtbare leeftijd 8-16 mg/dag DHEA produceert, in de premenopauze – 6-8 mg/dag, en in de postmenopauze – al 2-5 mg/dag en zelfs lager *. De redenen hiervoor zijn nog onbekend. Om het gebrek aan oestrogeen te compenseren, verhogen weefsels de lokale expressie van aromatase, waardoor ze het ontbrekende oestrogeen uit androgeen kunnen synthetiseren *.
Het probleem met DHEA is dat er, in tegenstelling tot andere hormonen, geen interne feedbacklus is om de niveaus ervan te reguleren. Er is op zijn minst geen intern mechanisme bekend dat de verhoogde DHEA-productie stimuleert wanneer de niveaus dalen *. Dit betekent dat bij een tekort aan DHEA alleen exogene supplementen het niveau op de gewenste waarde kunnen brengen.
Veel van de kernsymptomen van de menopauze kunnen snel worden verlicht door plaatselijke DHEA zonder de risico's die gepaard gaan met blootstelling aan oestrogeen *. Het voordeel van DHEA ten opzichte van andere androgene hormonen is dat het alleen in weefsels die over de juiste enzymatische machinerie beschikken, in andere hormonen wordt omgezet, zonder negatieve bijwerkingen op andere weefsels te veroorzaken. Dat wil zeggen dat DHEA-supplementen veiliger kunnen zijn dan progesteronsupplementen, en nog meer testosteron, die effecten hebben in alle androgeenreceptorweefsels. Orale toediening van 50 mg DHEA per dag gedurende 6 maanden veroorzaakte bijvoorbeeld geen negatieve veranderingen in de dikte van het endometrium * bij postmenopauzale vrouwen vanwege de afwezigheid van aromatase, dat DHEA omzet in oestrogenen * *. Topische DHEA 6,5 mg/dag kon de endometriumatrofie bij postmenopauzale vrouwen niet omkeren *, maar verbeterde wel andere menopauzesymptomen *.
Verschillende experimentele onderzoeken hebben aangetoond dat verhoogde niveaus van endogene DHEA-S het risico op borstkanker niet verhogen, in tegenstelling tot andere geslachtshormonen. Sommigen hebben zelfs aangetoond dat premenopauzale niveaus van DHEA of het sulfaat ervan omgekeerd geassocieerd zijn met het risico op borstkanker * *. Aan de andere kant is gemeld dat wanneer de DHEA-productie in verschillende delen van het lichaam extreem laag is, dit kan wijzen op de aanwezigheid van een kwaadaardige tumor ergens in het lichaam *.
DHEA wordt soms aanbevolen voor mensen ouder dan 60 jaar als antiverouderingsmiddel (50 mg/dag in de ochtend) *. Orale DHEA 100 mg/dag is zeer veilig gebleken, maar heeft in klinische onderzoeken een slechte werking bij gemetastaseerde borstkanker *. Er zijn echter publicaties waarin een dosering tot 12,5 mg/dag als optimaal wordt beschouwd, en een langdurige dosering van meer dan 25 mg/dag als gevaarlijk hoog *.
In de loop der jaren verplaatst de synthese van geslachtshormonen bij mensen zich van de endocriene klieren naar perifere weefsels *. En na de menopauze, wanneer de productie van estradiol in de eierstokken stopt, worden oestrogenen vrijwel geheel lokaal geproduceerd uit DHEA en DHEA-S afkomstig uit de bijnieren *. Het is aangetoond dat toediening van 4×400 mg DHEA oraal gedurende een maand zowel de serumoestrogeen- als androgeenspiegels verhoogt bij postmenopauzale vrouwen *.
DHEA kan eenmaal daags worden toegediend *. DHEA-suppletie vermindert ook aanzienlijk de niveaus van pro-inflammatoire moleculen (TNF-α en IL-6) bij oudere volwassenen *, het serumcholesterolgehalte bij postmenopauzale vrouwen *, vermindert de buikvetmassa en verbetert de insulinetolerantie *. Bij orale toediening bij vrouwen neemt de concentratie van testosteron, oestron en estradiol toe, en bij transdermale toediening – voornamelijk oestron en estradiol *.
Interessant is dat van alle andere geslachtshormonen DHEA-S het risico op postmenopauzale borstkanker het minst waarschijnlijk zou verhogen als de bloedconcentratie verdubbelde *. Dit maakt DHEA een veelbelovende kandidaat voor hormonale correctie bij postmenopauzale vrouwen in plaats van een combinatie van exogeen estradiol en testosteron. Hoewel het gebruik ervan ook een lage dosis combinatie met aromataseremmers kan vereisen.
Schildklierhormonen. Hogere serum-totaal-T4-concentraties worden in verband gebracht met borstkanker bij zowel premenopauzale als postmenopauzale vrouwen, maar het verband is tweemaal zo sterk bij premenopauzale vrouwen. Bij premenopauzale vrouwen neemt het schadelijke effect van T4 echter af naarmate de body mass index toeneemt, terwijl bij postmenopauzale vrouwen het tegenovergestelde patroon wordt waargenomen.
Lagere concentraties T3 worden ook in verband gebracht met borstkanker, maar de beschermende rol van T3 is bij premenopauzale vrouwen sterker dan bij postmenopauzale vrouwen. Er werden geen significante associaties gevonden met andere parameters van de schildklierfunctie (TSH, Tg, Tg Ab of TPO Ab) *.
Om de gezondheid van de schildklier te ondersteunen, kunnen de volgende supplementen in veel gevallen nuttig zijn.
• Jodium (5 mg/dag). Jodiumtekort, dat in bijna alle Europese landen voorkomt *, leidt tot schildklierstoornissen. Jodium is het belangrijkste element van de schildklier; het is essentieel voor de synthese van schildklierhormonen, helpt ook bij het reguleren van de niveaus van het stresshormoon cortisol * en draagt bij aan de normale immuunfunctie van witte bloedcellen en fagocyten *. Zeevruchten, vooral zeewier, zijn rijk aan organisch jodium. Onder plantaardige producten is de recordhouder voor jodiumgehalte de feijoa-vrucht (Feijoa sellowiana).
• Selenium (600 μg/dag) maakt deel uit van het enzym dat T4 omzet in T3. Ontstekingen, evenals hoge niveaus van oxidatiemiddelen, verminderen het seleniumgehalte in de schildklier. De rijkste bron van organisch selenium is paranoot; gevolgd door zeevruchten.
• Zink (25 mg/dag) * *, koper en ijzer*. Tekorten en/of onevenwichtigheden van deze metalen kunnen een ineffectieve regulatie van schildklierhormonen veroorzaken. Adequate consumptie van groenten kan hun tekort aanzienlijk wegnemen, en diversiteit in de voeding kan hun onevenwichtigheid wegnemen.
• Vitamine D3 (2'000-4'000 IE/dag). Een wijdverbreid vitamine D-tekort verhoogt het risico op auto-immuunziekten van de schildklier *.
• Vitamine Е (15 mg/dag). Kan helpen bij het verminderen van oxidatieve stress geassocieerd met schildklierdeficiëntie *.
• Vitamine А (25'000 IE). Een tekort aan retinoïnezuur veroorzaakt een disfunctie van de schildklier *.
• Vitamine В12 (3 μg/dag). Vitamine B12-tekort gaat gepaard met schildklierziekten *.
• Dehydroepiandrosteron (DHEA) en pregnenolon. Doorgaans zijn beide hormonen tekort bij patiënten met schildklierdeficiëntie *.
• Natuurlijke bronnen die de schildklierfunctie en de niveaus van schildkliergerelateerde hormonen verbeteren: kurkuma (1 g/kg voedsel) * en andere antioxidanten; mirrehars (equiv. 1'250 mg/dag) *; rhodiola*; ginseng (500 mg/dag-extract) * * en extract van ashwaganda (500 mg/dag) *. Bij patiënten met subklinische hypothyreoïdie verbeterde het ashwagandhawortelextract (600 mg/dag) de serum TSH-, T3- en T4-waarden significant gedurende 8 weken vergeleken met controles *.
Regelaars van serotonine. Serotonine (5-HT) reguleert de epitheliale homeostase in de borstklier via een aantal receptoren. Ontregeling van de serotoninesignalering heeft een negatieve invloed op borsttumoren door de celproliferatie te verhogen en de weerstand tegen apoptose te vergroten *.
• Zilverkaars (Actaea racemosa, Cimicifugae racemosae) vertoont geen competitieve binding aan oestrogeenreceptoren, noch regulatie van oestrogeen-induceerbare genen * bij lage tot matige doses. De overgrote meerderheid van de klinische onderzoeken rapporteert geen verandering of een lichte daling van de serumestradiolspiegels in verband met zilverkaars *.
Het nemen van extract van de wortelstok van zilverkaars kan echter de psychovegetatieve symptomen van de menopauze, zoals opvliegers * *, bij een aanzienlijk aantal vrouwen aanzienlijk verlichten en het risico op terugval verminderen bij patiënten die tamoxifen gebruiken *. Sommige onderzoeken hebben ook gunstige effecten van zilverkaars op botweefsel gevonden * *. Isopropanol-extract van zilverkaars remt de proliferatie in plaats van deze in vitro te bevorderen *, en ethanolextract remt de aromatase-activiteit in borstkankercellen (MCF-7) *. Zilverkaars heeft een sterk preventief effect bij vrouwen tegen borstkanker *, en verdrievoudigt na antikankertherapie de duur van de ziektevrije periode vóór terugval *.
In tegenstelling tot tamoxifen heeft zilverkaars geen negatieve oestrogene effecten in de baarmoeder of de borst * * * en heeft het geen nadelige invloed op de lever *. De hoeveelheid verzamelde gegevens geeft aan dat de werking van zilverkaars plaatsvindt als gevolg van hormonale regulatie door de hersenen; in het bijzonder door het beheersen van serotonine *, evenals dopamine, noradrenaline en gamma-aminoboterzuur *. Het effect begint niet onmiddellijk te verschijnen, maar na enkele weken gebruik. Dosering: 40 mg/dag droog plantaardig materiaal, wat overeenkomt met 4-8 mg droog extract *, maar niet meer.
Desondanks blijft zilverkaars een van de meest controversiële geneesmiddelen die worden gebruikt voor borstkanker, en de veiligheid van het gebruik ervan is nog steeds niet helemaal duidelijk.
• Valeriaan (Valeriana officinalis) wordt veel gebruikt om het inslapen te vergemakkelijken en de slaapkwaliteit te verbeteren. Hoewel de actieve ingrediënten van valeriaan niet zijn geïdentificeerd, is gemeld dat valeriaanwortelextract de dopamine- * en serotonine-routes * beïnvloedt en effectief kan zijn bij het verlichten van menopauzeklachten bij vrouwen, vooral bij het verminderen van de frequentie van opvliegers en nachtelijk zweten *. De dosering gedroogde valeriaanwortel in klinische onderzoeken was 765 mg/dag * en vertoonde geen negatieve bijwerkingen.
Regelaars van stresshormonen. Het lichaam reageert op stress met een onmiddellijke afgifte van adrenaline en noradrenaline. Dit verhoogt uw hartslag, bloeddruk en alertheid, waardoor u beter kunt reageren op levensbedreigende bedreigingen. Chronische stress zorgt er echter voor dat deze hormonen op een abnormaal hoog niveau blijven, zelfs als er geen gevaar is. Activering van de overeenkomstige cellulaire receptoren door hormonen zorgt ervoor dat cellen hun vermogen verliezen om de celdeling te remmen, en verhoogt zo het risico op kanker *.
Stress stimuleert de bijnieren om grote hoeveelheden cortisol vrij te geven. Cortisol kan de productie van andere hormonen beïnvloeden, zoals prolactine en oestrogeen. Prolactine kan pijnlijke gevoelens in de borstklieren veroorzaken, en er is al genoeg gezegd over de gevaren van een teveel aan oestrogeen.
Bètablokkers zijn een klasse geneesmiddelen die de effecten van adrenaline en noradrenaline verminderen door bijnierreceptoren te blokkeren. Diabetici die bètablokkers gebruiken, hebben een 67% lager risico op het ontwikkelen van kanker dan diabetici die deze niet gebruiken. Bovendien vermindert elke maand bètablokkers dit cijfer met 13% *. Patiënten die bètablokkers gebruiken, kunnen hun risico op overlijden door borstkanker met 50% verminderen vergeleken met patiënten die deze niet gebruiken *. Bovendien hadden vrouwen die al bètablokkers gebruikten ten tijde van de diagnose borstkanker een 56% hogere totale overlevingskans *.
Patiënten met HER2–-borstkanker die werden behandeld met bètablokkers verhoogden de progressievrije overleving aanzienlijk *. De doseringen die in de beoordeelde onderzoeken werden gebruikt, liepen echter sterk uiteen, waardoor het moeilijk was om de aanbevolen dosis nauwkeurig te bepalen. Daarom kunt u voortbouwen op de aanbevolen waarden voor andere ziekten. Voor propranolol kan dit 80-160 mg/dag zijn, en voor carvedilol – 12,5-25 mg/dag.
Helaas kunnen bètablokkers de bloeddruk verlagen en hebben ze ook een aantal andere bijwerkingen. Er wordt bijvoorbeeld van verdacht dat ze de incidentie van hartinfarcten en beroertes verhogen *. Er zijn ook verminderde overlevingspercentages gemeld bij patiënten die bètablokkers gebruiken *. De noodzaak voor het gebruik en de dosering van bètablokkers moet dus uitsluitend door de behandelende arts worden bepaald.
Het bekendste stresshormoon is cortisol. Dankzij cortisol worden de kracht en middelen van het lichaam gehaast om een kritieke «vecht- of vlucht-»situatie op te lossen. De bloeddruk, de bloedsuikerspiegel, het vermogen van bloed om bloedstolsels te vormen, nemen toe en de concentratie van lipiden in het bloed neemt toe. In dit geval treedt de verbetering van de bloedtoevoer naar de spieren en hersenen op als gevolg van een verslechtering van de bloedtoevoer naar andere organen. Bovendien verzwakt het de immuunafweer. Chronisch hoge niveaus van cortisol zijn dus, net als andere stresshormonen, schadelijk. Gelukkig keren de cortisolspiegels, zodra de kritieke situatie is opgelost, gewoonlijk terug naar de basislijn.
Onder normale omstandigheden zijn de cortisolspiegels onderhevig aan dagelijkse schommelingen (een stijging in de eerste helft van de dag en een daling in de tweede helft). Er zijn echter verschillende schendingen van deze cyclus. Met name door chronische stress kan het cortisolgehalte in het bloed te lang hoog blijven. Er zijn geen effectieve natuurlijke remedies die de cortisolspiegel kunnen reguleren. De volgende maatregelen kunnen echter worden geprobeerd:
- indien mogelijk bronnen van stress vermijden (giftige mensen, negatieve informatie, enz.);
- matige, maar geen sterke lichamelijke activiteit in de eerste helft van de dag (zie rubriek «Gezond bewegen †»);
- verbetering van de slaapkwaliteit (zie rubriek «Gezonde slaap †»);
- prettige sfeer – werk voor het plezier, hobby's, communicatie in goed gezelschap, gezellige muziek, dans, vermaak, een huisdier, etc.);
- het creëren van psychologisch gezonde relaties met anderen (familie, collega's, vrienden);
- wandelingen in de natuur, komedies kijken, gebed of meditatie.
Andere hormonale regelaars.
• Cordyceps is zachte, veelzijdige natuurlijke hormonale ondersteuning. In het bijzonder helpt het de niveaus van cortisol en andere stresshormonen te stabiliseren. Verhoogt het niveau van intracellulaire antioxiderende enzymen. Dosering: 5-20 ml/dag.
• Melatonine is een krachtig antioxidant en neuroprotectief hormoon dat een diepe, kwaliteitsvolle slaap bevordert. Het reguleert ook de balans van oestrogeen en insulineachtige groeifactor IGF-1, remt de aromatase-activiteit en gaat de activiteit van estradiol tegen. Melatonine is een vrij verkrijgbaar medicijn. Dosering: 3-20 mg sublinguaal voor het slapengaan. Langdurig gebruik van meer dan 9 mg/dag wordt niet aanbevolen, tenzij voorgeschreven door een arts.
• Thymoquinone is het hoofdbestanddeel van Zwarte komijn-zaden (Nigella sativa), heeft geen invloed op de productie van hormonen, maar zorgt ervoor dat testosteron in vrije vorm in het serum wordt vastgehouden. Extra vierge zaadolie, rijk aan thymoquinone, blijkbaar vanwege de antioxiderende eigenschappen, helpt ook de systolische en diastolische bloeddruk te verlagen, evenals de nuchtere bloedsuikerspiegel, triglyceriden en HDL-cholesterol, urinezuur en C-reactief eiwit *. Dosering: 1-3 g olie per dag of 3-5 g zaaden van zwarte komijn *.
• Bèta-sitosterol is een fytosterol dat de omzetting van testosteron in dihydrotestosteron verhindert door het overeenkomstige enzym (5α-reductase) te blokkeren. Het kan gunstiger zijn voor mannen, maar bij vrouwen helpt het ook om te voorkomen dat testosteron wordt gemetaboliseerd in andere hormonen. Het moderne dieet levert ongeveer 80 mg/dag aan fytosterolen, terwijl het Japanse of vegetarische dieet meer dan 340 mg/dag levert *. Rijke plantaardige bronnen van bèta-sitosterol en andere fytosterolen zijn onder meer graankiemen, sesam, pistachenoten, amandelen, macadamia's en zonnebloempitten *.
• Pioenroos (Paeonia lactiflora). De wortel van de plant helpt het niveau van een ander potentieel kankerverwekkend hormoon, prolactine, te verlagen *. Dosering: 15 ml (1 eetlepel) ethylwortelextract per dag *.
• Thioridazine is een antipsychoticum dat zich selectief richt op neoplastische cellen en dopaminereceptoren (DR) tegenwerkt, die tot expressie komen op zowel gewone borstkankercellen als kankerstamcellen *. Patiënten met schizofrenie die DR-antagonisten gebruikten, ondervonden een vermindering van de incidentie van rectum-, colon- en prostaatkanker *. Dosering: 4×25 mg.
• 8-prenylnaringenine (een bestanddeel van hop) verlaagt het niveau van follikelstimulerende en luteoniserende hormonen *.
De hormonale invloed op de gezondheid van vrouwen blijft een van de krachtigste, maar tegelijkertijd meest subtiele instrumenten, en vereist een verantwoordelijke en professionele aanpak.