Gezondheidsstrategie.
De strategie voor de bestrijding van kanker hangt af van welke van de kankertheorieën als de werkende wordt gekozen. Als de theorie waarop de behandeling is gebaseerd onjuist is, zal de behandeling zelf hoogstwaarschijnlijk niet succesvol zijn.
Momenteel zijn er verschillende theorieën over carcinogenese in de oncologie * * *. De dominante theorie blijft, ondanks de toenemende kritiek, nog steeds de Somatische Mutatietheorie (SMT) *.
In overeenstemming met de ideeën van deze theorie,
- de normale toestand van menselijke cellen is rust, geen expansie;
- het verschijnen van een tumor is een ongeluk;
- een tumor is een weefsel gevormd door abnormale (gemuteerde) cellen;
- een tumor ontstaat uit een enkele cel die een of meer mutaties heeft in genen die de celgroei en rijping controleren;
- mutaties van deze cellen zijn onomkeerbaar;
- deze mutaties resulteren in ongecontroleerde celgroei en de cellen vertonen andere kankerachtige kenmerken.
Op basis van deze standpunten zou de behandeling van kanker de vernietiging van kankercellen moeten zijn met alle mogelijke middelen, waarbij traditioneel het scalpel, het gif en de bestraling worden gebruikt. Het succes van de behandeling hangt af van hoe volledig de kankercellen zijn vernietigd.
Om kankercellen selectief te kunnen targeten zonder significante schade aan normale cellen, moet wij echter de verschillen kennen tussen kankercellen en normale cellen.
Het is gebruikelijk om de volgende hoofdsymptomen van kanker te identificeren:
- ontsteking en fibrose geassocieerd met tumor;
- het herprogrammeren van het energiemetabolisme van kankercellen, waardoor een verzuurde hypoxische intercellulaire omgeving ontstaat;
- overheersing van cellulaire groeisignalen ten opzichte van groeiremmende signalen;
- overheersing van celoverlevingssignalen boven doodssignalen;
- stimulering van duurzame groei van nieuwe bloedvaten (angiogenese);
- genomische instabiliteit van kankercellen, waardoor ze een hoog aanpassingsvermogen en vitaliteit krijgen;
- functionele inferioriteit veroorzaakt door onrijpheid van de cellen;
- het vermogen om een kankercel een onbeperkt aantal keren te delen;
- controle van de cellulaire micro-omgeving, inclusief immuuncellen;
- ontkieming van kankercellen in aangrenzende weefsels (invasie) en hun verspreiding naar afgelegen delen van het lichaam met de verdere vorming van tumoren daar (metastase) *.
Cellen die al deze kenmerken vertonen, worden hieronder «kankercellen» genoemd.
Ongebreidelde verdeeldheid. Het leven en het gedrag van een cel van een meercellig wezen is anders dan het leven en het gedrag van een eencellig wezen. De overgang van eencellig naar meercellig bestaan is een overgang van vijandigheid en concurrentie van cellen van hetzelfde type naar wederzijds voordelige samenwerking en samenwerking. Dit is een overgang van het complexe en gevaarlijke leven van een enkele cel naar een eenvoudiger en veiliger leven, ten koste van een gedeeltelijk verlies van iemands vrijheid en het aanvaarden van de last van verplichtingen jegens andere cellen. De overgang van individualisme naar collectivisme.
In een meercellig organisme volgt elke individuele cel niet zijn eigen zelfzuchtige belangen, maar de belangen van de hele gemeenschap van cellen. Elke volwassen cel vervult zijn specifieke functie en gehoorzaamt niet alleen zijn eigen interne en omgevingssignalen, maar ook de signalen van naburige en verre cellen. Elke individuele cel communiceert met andere cellen, stuurt hen berichten en ontvangt feedback van hen, waardoor ze geneigd zijn tot bepaalde acties, variërend van het «delen»-programma tot het «sterven»-programma.
De signaleringsomgeving van de cel is gevuld met veel tegenstrijdige instructies, maar welke ervan zullen worden uitgevoerd en welke zullen worden genegeerd, hangt af van hun kracht en evenwicht.
Een cel begint zich te delen wanneer de signalen die de deling belemmeren minder krachtig zijn dan de signalen die de deling stimuleren. Onder normale omstandigheden, wanneer er geen behoefte is aan de groei van organen of het lichaam als geheel, of aan het snelle herstel van verloren weefselcellen, worden signalen die de deling remmen versterkt. En bij bijvoorbeeld letsel en daarmee gepaard gaande acute ontstekingen treedt er tijdelijk een toename van delingssignalen op. Als gevolg hiervan vindt lokale weefselgroei (proliferatie) plaats.
In wezen zijn kankercellen cellen die hun sociale functie hebben verloren. Cellen die zijn teruggekeerd naar de eencellige manier van leven met zijn onsterfelijkheid, anarchie en egoïsme.
Ontduiking van apoptose. Als het bestaan van een cel vanwege haar minderwaardigheid of nutteloosheid niet in overeenstemming is met de publieke belangen, krijgt zij respectievelijk interne en/of externe bevelen om haar vitale activiteit te beëindigen. Als de overlevingscommando's zwakker blijken te zijn, wordt het proces van apoptose gelanceerd – de geprogrammeerde «zelfmoord» van de cel. Kankercellen slagen er echter in mechanismen te ontwikkelen waarmee ze commando's om zelfmoord te plegen kunnen negeren of commando's kunnen versterken om in leven te blijven.
Hoge genetische plasticiteit. Stressvolle omstandigheden in het bestaan van een cel vergroten de genomische instabiliteit, en genomische instabiliteit vergroot de genetische flexibiliteit, dat wil zeggen dat het meerdere mutaties in het DNA bevordert, inclusief mutaties die de cel in staat stellen zich aan te passen aan overleving in een ongunstige omgeving.
«Onsterfelijkheid». De stabiliteit van de terminale secties van DNA-moleculen wordt verzekerd door speciale eiwitten: telomeren. Het aantal telomeren, dat de DNA-stabiliteit bepaalt, wordt bij elke deling van een volwassen cel uitgeput, zodat deze zich een beperkt aantal keren kan delen. Volledige uitputting van telomeren leidt tot verstoring van het normale delingsproces en als gevolg daarvan tot celapoptose. Alleen stamcellen kunnen zich een onbeperkt aantal keren delen vanwege hun vermogen om telomeren te herstellen.
Wijziging van het metabolisme. Het cellulaire metabolisme is het geheel van alle chemische reacties die in cellen plaatsvinden. Normale cellen verkrijgen bijna alle energie die ze nodig hebben door de oxidatie van pyruvaat (aerobe ademhaling), dat wordt geproduceerd door de glycolyse van glucose. Kankercellen verkrijgen meestal een aanzienlijk deel van hun energie door melkzuur te produceren uit pyruvaat, waarvoor geen zuurstof nodig is (anaerobe ademhaling). Ze doen dit ongeacht of er voldoende zuurstof is voor aerobe ademhaling of niet.
Ontsteking geassocieerd met een tumor. Ondanks de verscheidenheid aan kankerverwekkende factoren, komen de meeste ervan neer op chronische ontstekingen met lage intensiteit, die kanker veroorzaken en stimuleren. Ontsteking en de daarmee gepaard gaande lokale weefselverdichting worden nu erkend als de centrale plaats van het gehele oncogene proces. Cellulaire processen geassocieerd met ontstekingssignalering spelen een belangrijke rol in alle stadia van carcinogenese, inclusief het ontstaan van de tumor (initiatie), ontwikkeling (progressie), invasie (invasie), verwerving van nieuwe bloedvaten (angiogenese) en verspreiding over lange afstanden (metastase) *.
Invasie en metastase. Goedaardige tumoren hebben een duidelijke rand en groeien, waarbij ze de omliggende weefsels uit elkaar duwen, maar zonder deze te beschadigen. In tegenstelling tot goedaardige tumoren groeien kwaadaardige tumoren niet alleen in omvang. Kankercellen kunnen de eiwitfilm rond de tumor, die voornamelijk uit collageen bestaat, wegvreten en naburig weefsel binnendringen. Om deze reden hebben ze geen duidelijk gedefinieerde grens.
Kankercellen die van de tumor zijn gescheiden, kunnen door interne vloeistofstromen (lymfe of bloed) naar afgelegen delen van het lichaam worden getransporteerd, waar ze nieuwe tumoren vormen. En hoewel ze bijna allemaal sterven tijdens deze moeilijke reis, slagen sommigen er nog steeds in om te overleven, waardoor het risico ontstaat dat er nieuwe tumorhaarden verschijnen.
Vorming van een quasi-organisme. Elke cel anders dan een normale gastheercel die in het zicht komt van normaal functionerende immuuncellen zal vroeg of laat worden geïdentificeerd en vernietigd. Dit routinematige natuurlijke proces vindt talloze keren plaats in verschillende delen van het lichaam.
Om de dood te voorkomen, hebben kankercellen veel verschillende trucjes: camouflage; mimicry; zich verstoppen in een beschermde stoffen nis; desoriëntatie van immuuncellen en het creëren van ongunstige omstandigheden voor hen; de vorming van microsferen uit cellen die op zichzelf lijken, waardoor hun weerstand toeneemt. En ten slotte de vorming van een omgeving van normale cellen die niet ten gunste van het lichaam zal werken, maar in plaats daarvan kankercellen zal voorzien van bescherming, grondstoffen en energie.
In zekere zin is een tumor niet zomaar een verzameling opstandige cellen. Het is een complex levend organisme dat bestaat uit verschillende soorten cellen die samenwerken om voedsel te verkrijgen, zichzelf te verdedigen en de vijandige omgeving te ontwijken die hen probeert te vernietigen. En natuurlijk streeft de tumor doelen na die volledig onverenigbaar zijn met de doelen van het gastheerorganisme. In dit opzicht lijkt het op een gangstergemeenschap die haar bestaan en haar bedrijfssucces boven het publieke succes stelt, terwijl ze parasiteert op de samenleving zelf.
Het moment waarop het lichaam de controle verliest over de processen in de micro-omgeving van een groep abnormale cellen kan worden beschouwd als het moment van het ontstaan van een kankergezwel. Een hele keten van lange en onderling verbonden gebeurtenissen leidt er echter toe.
De duidelijkst waargenomen structurele, metabolische, functionele en andere verschillen tussen normale en kankercellen/weefsels zijn samengevat in de onderstaande tabel. Deze verschillen maken het mogelijk om kankercellen te targeten en tegelijkertijd normale cellen te sparen.
Verschillen tussen normale cellen en kankercellen |
|
Norm |
Kanker |
Cel structuur |
|
Het DNA van de cel functioneert normaal. |
De structuur van het DNA van de cel is beschadigd of wordt gelezen met overtredingen. |
Mitochondriën zijn volledig functioneel. |
Het aantal mitochondriën kan worden veranderd en hun activiteit wordt aanzienlijk verminderd. |
Celmetabolisme |
|
Bijna alle energie wordt geproduceerd door de oxidatiereactie van pyruvaat in de mitochondriën. Het eindproduct van het pyruvaatmetabolisme is water en koolstofdioxide. |
Een aanzienlijk deel van de energie wordt geproduceerd door de pyruvaatfermentatiereactie in het cytoplasma. Het eindproduct van het pyruvaatmetabolisme is voor een groot deel melkzuur. |
Het bouwmateriaal voor het creëren van een nieuwe cel komt vooral van buitenaf.
|
De bouwstof voor het maken van een nieuwe cel wordt voor een groot deel binnenin de cel geproduceerd. |
De glucose-inname is normaal.
|
Het glucoseverbruik nam toe. |
Functies |
|
De cel is gedifferentieerd en heeft een gespecialiseerd functioneel doel. |
De cel is niet of slecht gedifferentieerd. |
Enzymen en hormonen werken op een evenwichtige manier. |
Hyperactieve of hypoactieve werking van enzymen en hormonen. |
Het gebruikelijke activiteitsniveau van heat shock-eiwitten. |
Verhoogde activiteit van heat shock-eiwitten. |
Celverdeling |
|
Komt overeen met de huidige omstandigheden en wordt gestuurd door de eisen van de celomgeving. |
Slecht beheerd of onbeheerd. |
Cellen delen zich op een ordelijke manier om alleen meer cellen te produceren als het lichaam ze nodig heeft. |
Cellen delen zich voortdurend zonder de noodzaak van vernieuwing, zonder structurele orde en controle; overtollige cellen vormen een weefselmassa die een tumor wordt genoemd. |
Celdood |
|
Het zelfmoordmechanisme dat door de mitochondriën wordt geactiveerd, werkt. |
De activiteit van de mitochondriën wordt onderdrukt, de cel sterft niet vanzelf. |
Celmembraan |
|
Geen afwijkingen. |
Bedekt met een laagje slijm, en bij uitzaaiing ook fibrine. Geen/aanwezigheid van specifieke antigenen op het membraan. Het aantal adhesiemoleculen en signaalreceptoren wordt verminderd. Het aantal insulinereceptoren neemt toe. |
Zuurgraadindex |
|
Binnen in de cel: pH 7,0-7,4. Buiten de cel is de indicator iets alkalischer: pH 7,4. |
Binnen in de cel: pH 7,1-7,5. Buiten de cel is de indicator licht zuur: pH 6,3-7,0. |
Vrije radicalen |
|
Ze zijn in een bepaalde hoeveelheid aanwezig. |
Verhoogde hoeveelheid oxidatiemiddelen en andere agressieve en giftige stoffen. |
Transmembraan potentieel |
|
Normaal niveau. |
Verlaagd niveau. |
Elektrolytenbalans |
|
De natuurlijke verhouding in de cel van interne en externe elektrolyten (kalium en magnesium versus natrium en calcium). |
Vaak is er sprake van een onevenwicht. |
Moleculaire zuurstof |
|
In voldoende hoeveelheid aanwezig. Neemt deel aan interne chemische reacties. |
Niet genoeg. Bevordert de dood van kankercellen. |
Groeifactoren |
|
Functioneren op normale metabolische niveaus voor zelfproductie in een gecontroleerd tempo. |
Hyperactiviteit en/of overproductie van groeifactoren. |
Aderen |
|
Weefsel heeft een ingebouwd, geordend systeem van bloedvaten. |
Het vasculaire systeem is verstoord, onvolwassen en zeer permeabel. |
Temperatuur |
|
Normaal. |
De temperatuur van het tumorweefsel is licht verhoogd *. |
Conclusies. Ondanks de aanwezigheid van deze onderscheidende kenmerken is geen van deze uitsluitend inherent aan kwaadaardige cellen, en in bepaalde omstandigheden niet inherent aan niet-kwaadaardige cellen *.
- Een verhoogde celgroei wordt ook waargenomen in normaal weefsel tijdens de massale dood van lichaamscellen als gevolg van enkele lokale rampen. Bovendien is de delingssnelheid van kankercellen niet hoger dan die van vervangende cellen als gevolg van fysiek trauma aan het weefsel of normale, snel delende cellen, bijvoorbeeld in de darmen of het beenmerg. Het probleem is niet de toegenomen celduplicatie, maar dat weefselconstructie/reparatie op onnatuurlijke wijze plaatsvindt..
- Het vermogen om signalen te ontwijken die apoptose bevorderen, evenals het vermogen om DNA te beschermen via telomerase, is bij kankercellen niet groter dan bij normale stamcellen. «Onsterfelijkheid» is echter geen exclusieve eigenschap van kankercellen; normale stamcellen zijn ook «onsterfelijk».
- Verhoogde energieproductie door glycolyse is ook geen uniek fenomeen in een kankercel. Het percentage glycolyse dat door kankercellen wordt gebruikt, is niet hoger dan dat van vroege embryonale cellen. Bovendien kunnen sommige normale cellen continu gebruik maken van glycolyse voor de energieproductie (bijv. neuronen) of tijdelijk naar deze modus overschakelen (bijv. spiercellen, sommige immuuncellen, enz.).
- Genetische modificaties zijn ook natuurlijk en stapelen zich op met de leeftijd. Het enige verschil tussen normale cellen en kankercellen is dat laatstgenoemde genetisch onstabieler zijn, omdat dit wordt vergemakkelijkt door een aantal interne en externe stressomstandigheden.
- Onvolledige differentiatie (functionele onvolwassenheid) is ook geen unieke eigenschap van kankercellen. Normale stamcellen zijn ook ongedifferentieerd. Nadat de stamcel zich heeft gedeeld, doorlopen de dochtercellen met verschillende snelheden het stadium van onvolledige differentiatie. Epitheelcellen differentiëren het snelst; bovendien differentiëren borstcellen zich pas volledig en definitief tijdens het laatste trimester van de zwangerschap van een vrouw. Het probleem met kankercellen is dat ze «onvolwassen volwassenen» blijven en soortgelijke «kinderen» voortbrengen.
- Invasie van aangrenzende weefsels is niet inherent aan normale cellen die verschillende organen vormen. Het wordt echter waargenomen bij sommige niet-kwaadaardige verschijnselen, bijvoorbeeld bij goedaardige groei van de baarmoeder buiten de natuurlijke locatie. Bovendien kan een gebeurtenis die lijkt op een «invasie» de penetratie van immuuncellen in de plaats van infectie in een weefsel worden genoemd, wat een routinematig natuurlijk proces is. In alle drie de gevallen worden dezelfde signaalroutes geactiveerd.
- Verspreiding naar verre oorden is ook geen normaal verschijnsel voor cellen. Maar theoretisch is het mogelijk als een normale, ongedifferentieerde cel in de circulerende vloeistoffen van het lichaam terechtkomt. Onder normale omstandigheden zal dit leiden tot de dood van de «verloren» cel.
Uit dit alles kunnen we concluderen dat wat kenmerkend is voor kanker niet de aanwezigheid van een van deze specifieke celkenmerken is, maar het feit dat er meerdere tegelijkertijd verschijnen. Een kankercel is niet een fundamenteel speciale cel. In dit opzicht verschilt het niet van normale cellen, net zoals een crimineel niet verschilt van een gezagsgetrouwe burger. Het verschil tussen hen zit alleen in het gedrag.
De conclusie waartoe verdere overwegingen ons zullen leiden is de volgende. Een kankercel is een cel die gedwongen wordt gedrag te vertonen dat doorgaans ongebruikelijk is voor een normale cel, om onder extreme omstandigheden te kunnen overleven. Ze verwerft een manier van acteren die een personage wordt. Ze negeert haar sociale doel in het lichaam.
In dit opzicht kan de externe manifestatie van kanker niet alleen worden beschouwd als een probleem van initiële of verworven fysieke defecten, maar ook als een probleem van celdesorganisatie, wat aanleiding geeft tot een nieuw cellulair fenotype *. Als een onnatuurlijk verloop van normale processen.
De hierboven genoemde kenmerken van tumorcellen blijven echter nog steeds een reeks puzzels en geen volledig beeld. We moeten niet de statica kennen, maar de dynamiek van het proces, de oorzaak-en-gevolgrelaties van de elementen ervan. Want alleen inzicht in hoe normale cellen kankergedrag verwerven, kan de vraag beantwoorden hoe dit proces kan worden voorkomen, vertraagd en, indien mogelijk, teruggedraaid.
Kanker is geen schotwond; het ontstaat niet plotseling. Het proces van kankerontwikkeling bestaat uit meerdere fasen en heeft een multifactoriële oorzaak. Het wordt voorafgegaan door een reeks geleidelijke, uiteenlopende veranderingen in de weefsels van een bepaald orgaan, die meerdere jaren kunnen duren en die niet altijd resulteren in een kwaadaardige tumor. Deze precancereuze veranderingen worden veroorzaakt door een verscheidenheid aan factoren die kankerverwekkende stoffen * worden genoemd en die hieronder zullen worden besproken †.
In een complexe keten van onderling verbonden intra- en extracellulaire risicofactoren kan elk van deze zowel een initiële oorzaak als een gevolg zijn van andere oorzaken. Het gebrek aan zuurstof in het weefsel kan bijvoorbeeld zowel een primaire factor zijn (als gevolg van een verslechtering van de bloedtoevoer) als een secundaire factor (vanwege de verzuring ervan – als gevolg van glycolysemetabolieten). Als gevolg daarvan de lus van deze factoren onderling verbonden processen kunnen de opkomende pathologie stabiliseren.
Andere positieve feedbacklussen kunnen complexer zijn. Korte termijn verstoringen in het gebruikelijke verloop van cellulaire processen veroorzaken de activering van compensatiemechanismen die het mogelijk maken de ontstane problemen te omzeilen. Ze vereisen echter extra metabolische reacties, wat extra energieverbruik betekent.
Wanneer de problemen verdwijnen, keert het cellulaire metabolisme terug naar normaal. Maar in gevallen waarin ze chronisch worden, moet de cel zich aanpassen aan nieuwe omstandigheden en zijn fenotype opnieuw opbouwen om succesvoller te kunnen reageren op stressvolle uitdagingen en te overleven in steeds verslechterende externe en interne omstandigheden.
Tumor-initiatie. Laten we proberen een van de mogelijke, schematisch vereenvoudigde beschrijvingen van de ontwikkeling van het kankerproces voor te stellen. In werkelijkheid zijn ze veel dieper, complexer en kunnen ze talloze andere variaties en accenten hebben. Het hieronder beschreven scenario dient alleen om de complexe verwevenheid van kankerprogressie te illustreren.
Chronische stress. De cellen, weefsels en organen van het lichaam worden voortdurend blootgesteld aan talloze acute traumatische gebeurtenissen. Een levend organisme herstelt echter vroeg of laat de schade die ontstaat.
Letsel veroorzaakt een aantal lokale reacties die de celdeling en vervanging van dode cellen door nieuwe bevorderen. Ontsteking vormt een speciale, omheinde zone op de plaats van verwonding, waarin omstandigheden worden gecreëerd die ongunstig zijn voor het leven van vreemde micro-organismen. Naarmate de wond geneest en het weefsel terugkeert naar de status quo, verdwijnen deze tijdelijke reacties. Chronisch letsel door verstorende factoren schept een beeld van een niet-genezende wond, wat omstandigheden schept voor voortdurende deling en ophoping van cellen.
Een tijdelijke toename van het aantal cellen in een bepaald orgaan kan ook worden waargenomen onder normale, «overgangs»-omstandigheden. Bijvoorbeeld de groei van borstcellen die gevoelig zijn voor geslachtshormonen tijdens de rijpingsperiode van het vrouwelijk lichaam. In deze gevallen wordt een kortetermijnstijging van het hormoonniveau, waardoor de celdeling van de kanalen of lobben van de borstklier wordt gestimuleerd, genetisch gereguleerd en gaat gepaard met een passend niveau van satelliethormonen en antagonisthormonen. Daarom vinden de processen van vorming en rijping van borsten en voortplantingsorganen bij vrouwen op natuurlijke en harmonieuze wijze plaats, zonder negatieve gevolgen te veroorzaken.
Een ander voorbeeld is de beheersing van de geboorte en dood van baarmoedercellen tijdens de ovulatiecyclus door schommelingen in het niveau van twee antagonistische hormonen: respectievelijk oestradiol en progesteron. Het handhaven van een evenwicht daartussen zorgt voor een normale maandelijkse cyclus en de gezondheid van de voortplantingsorganen. Tegelijkertijd beïnvloedt een chronisch hoog niveau van estradiol, de kankerverwekkende metabolieten ervan of andere oestrogeenachtige stoffen, dat om de een of andere reden is ontstaan en niet wordt beperkt door tegenwicht, slechts één aspect van de cellen: hun deling.
Een voorbeeld van een niet-hormonaal chronisch letsel is een verhoogde zuurgraad van borstweefsel. Laaggradige acidose is een van de meest voorkomende aandoeningen die ernstige degeneratieve ziekten bij de mens veroorzaken, waaronder borstkanker.
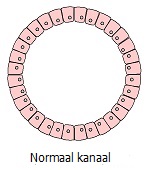
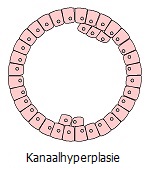
Chronische verstoring/irritatie/letsel leidt tot een aantal fenotypische transformaties van cellen die zijn blootgesteld aan chronische stress. Uiterlijk lijkt dit op een opeenvolgende ontwikkeling van lokale abnormale omstandigheden: hyperplasie (overmatige deling van normale cellen) ⇒ metaplasie (vervanging van cellen van het ene type weefsel door een ander) ⇒ dysplasie (ongecontroleerde groei en verlies van celdifferentiatie) ⇒ neoplasie (volledige verlies van weefselcontrole over de groeiende tumor). Laten we de keten van deze transformaties, die visuele symptomen zijn van tumorprocessen die onzichtbaar zijn voor het oog, eens nader bekijken.
Proliferatie. In normale volwassen weefsels wordt een evenwicht gehandhaafd tussen het aantal stervende cellen en het aantal nieuwe cellen dat op hun plaats verschijnt. Met andere woorden, er wordt een evenwicht gehandhaafd tussen apoptose (dood) en proliferatie (groei) van cellen. Maar tijdens het tumorproces wordt dit evenwicht chronisch verstoord in de richting van proliferatie.
Vanwege de heterogeniteit van de structuur van het orgaan/weefsel en de ongelijkmatige aanvoer van cellen, evenals de heterogeniteit van de verdeling van storende factoren daarin (intraductaal papilloma, lokale trombose, verkalkingen, alcohol, virussen, bacteriën, trauma, hormonen), een kritisch samenvallen van sommigen van hen op bepaalde punten van de borstklier heeft een aanzienlijk sterker lokaal stresseffect *. Dergelijke punten kunnen later het centrum van tumortransformaties worden.
Stress/letsel verstoort de mitochondriale functie, wat de expressie van cellulaire groei- en weefselherstelgenen (GR-genen) veroorzaakt. Dit resulteert in een verhoogde productie van groei- en herstelfactoren om de blessure te genezen. Bovendien stimuleren deze genen niet alleen de celproductie maar onderdrukt ook apoptose *. De balans tussen apoptose en proliferatie verschuift dus naar proliferatie.
Het lijkt erop dat langdurig onvermogen om een hoge stressbelasting te tolereren, stressgevoelige cellen dwingt hun aantal te vergroten om de stressfactor over een groter aantal cellen te verdelen. Soortgelijke verschijnselen treden op bij systematische intensieve lichamelijke activiteit, die een toename van het aantal spiercellen en spiermassa stimuleert. Zo zal op sommige punten in weefsel dat gevoelig is voor stimuli een significante toename van het aantal normale cellen (hyperplasie) worden waargenomen, wat een natuurlijke weefselreactie is als reactie op externe stimuli.
Borsthyperplasie komt zeer vaak voor en op de leeftijd van 70 jaar bereikt het aantal vrouwen met hyperplasie 69% *. De wijdverbreide prevalentie van hyperplasie betekent echter niet dat het normaal is. Net zoals de prevalentie van atherosclerose, hypertensie, zwaarlijvigheid, osteoporose en diabetes niet wijst op hun normaliteit.
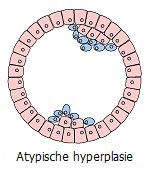
Als de ergernis niet afneemt en de mogelijkheden tot proliferatie beperkt of uitgeput zijn, kan de reactie bestaan uit het vervangen van celtypen die gevoeliger zijn voor een bepaalde stimulus in het weefsel door minder gevoelige typen normale cellen van hetzelfde orgaan (metaplasie). In dit geval worden cellen die typisch zijn voor een bepaald type weefsel vervangen door atypische cellen. Een sprekend voorbeeld hiervan is de vervanging van trilhaarepitheelcellen door platte cellen in de longen van zware rokers. Op dezelfde manier vindt de vervanging van estradiolgevoelige epitheelcellen van de kanalen en lobben van de borstklier door platte cellen plaats in een verder gevorderd stadium van tumorvorming *. Prolifererende cellen kunnen de eigenschappen van normale gespecialiseerde cellen verliezen en atypische hyperplasie vormen. Die na verloop van tijd, afhankelijk van de omstandigheden, kan normaliseren of de voorloper kan worden van een tumor – goedaardig of kwaadaardig *.
Proliferatie, die uiteindelijk aanleiding geeft tot een tumor, is dus een natuurlijke reactie op een traumatische factor. Het wordt gestimuleerd door dezelfde signalen die optreden tijdens letsel en ontsteking, en is gericht op het herstellen van beschadigd weefsel. Het probleem hier is de chronische aard van proliferatie, waarbij het lichaam een niet-genezende wond probeert te genezen die in werkelijkheid niet bestaat.
Overmatige celproliferatie schept ongunstige omstandigheden voor het bestaan van cellen. De concentratie voedingsstoffen neemt af, hypoxie en zuurgraad van de omgeving nemen toe, dit verhoogt de kans op DNA-schade en vermindert het herstelvermogen *. Ongecontroleerde proliferatie is echter niet voldoende om weefsel kwaadaardig te laten worden. Een eenvoudig voorbeeld van een niet-kwaadaardige proliferatie veroorzaakt door een carcinogeen agens, het papillomavirus, is een wrat. Een kwaadaardige tumor vereist verstoring van vele andere functies en processen en kwalitatieve degeneratie van cellen.
Het carcinogene effect van chronische stress op weefsel kan dus als volgt worden weergegeven. Als reactie op traumatische (carcinogene) signalen veroorzaken cellen een reeks natuurlijke reacties die verband houden met de genezing van verwondingen. Deze reacties omvatten de activering van groei- en herstelgenen (oncogenen), de afgifte van cytokines, de productie van verschillende groeifactoren, de deling en differentiatie van lokale en aangetrokken stamcellen, en de herstructurering van weefsels om hun vitale functies te garanderen.
Zowel bij trauma als bij tumoren hebben we te maken met vergelijkbare processen van celdeling om weefsel te herstellen. Alleen in het eerste geval is het echt nodig, maar in het tweede geval is het een valse noodzaak. Met andere woorden: in het eerste geval leidt een tijdelijke en beheersbare schijn van kanker tot genezing van het trauma, terwijl in het tweede geval een permanent en oncontroleerbaar trauma tot echte kanker leidt.
In het geval van acuut letsel is het proces van herstel van beschadigd weefsel uiteindelijk succesvol. Op de plaats van verwonding/genezing ondergaan ongedifferentieerde cellen terminale differentiatie * of apoptose * en worden alle niet-functionele cellen en moleculen geëlimineerd. In het geval van chronische traumatische signalering stoppen de pogingen om weefsel te herstellen niet. Als er lange tijd geen signalen van succes komen, begrijpen de cellen dit op zo'n manier dat de fenotypische capaciteiten die ze hebben niet voldoende zijn om het probleem op te lossen.
De uitputting van mogelijkheden om bestaande uitdagingen op eenvoudigere, kwantitatieve manieren te overwinnen, dwingt cellen om ze op te lossen door middel van kwalitatieve veranderingen. Deze veranderingen gaan gepaard met genomische en metabolische modificaties in de cellen zelf, evenals reorganisatie van het omringende weefsel en herprogrammering van het gedrag van omringende cellen *.
Verhoogde glycolyse. De stressbelasting veroorzaakt door ziekteverwekkers onderdrukt direct de werking van mitochondriën – cellulaire organellen. Bovendien verhoogt het het lokale ontstekingspotentieel, en ontstekingen verlagen het zuurstofniveau en verhogen het niveau van vrije radicalen.
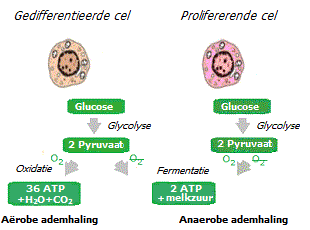
Zuurstof wordt door de mitochondriën van cellen gebruikt om energie te produceren uit pyruvaat (pyrodruivenzuur) via een elektrochemisch proces dat oxidatieve fosforylatie (aërobe ademhaling) wordt genoemd. Bij gebrek aan zuurstof kunnen de cellen niet genoeg energie uit de mitochondriën ontvangen. Om de ontbrekende energie te produceren, worden ze gedwongen een alternatief mechanisme voor energieproductie te gebruiken: fermentatie van pyruvaat buiten de mitochondriën, waarvoor geen zuurstof nodig is (anaerobe ademhaling).
De anaerobe methode voor energieproductie is meerdere malen minder efficiënt dan de aerobe methode. Om een vergelijkbare hoeveelheid energie te verkrijgen, is daarom een meervoudige toename van de toevoer van glucose naar de cellen en een toename van de intracellulaire glycolyse vereist. Aan de andere kant vereist anaërobe ademhaling slechts één chemische reactie om energie uit pyruvaat te halen, terwijl aërobe ademhaling er meerdere vereist (Krebs-cyclus). Dus hoewel glycolytische cellen meerdere keren minder moleculen ATP produceren uit één molecuul glucose, kunnen ze bijna honderd keer sneller en gemakkelijker ATP produceren, alleen al door hun glucoseverbruik te verhogen *.
Chronische toenames in de glycolyse en een verschuiving in de energieproductie van mitochondriaal naar enzymatisch hebben dramatische gevolgen. De productie van mitochondriale energie is nodig voor celdifferentiatie, dus de afname ervan veroorzaakt verlies van nieuwe celdifferentiatie en onbeperkte proliferatie *. Aan de andere kant is enzymatische energieproductie vereist voor celdeling, dus de groei ervan draagt ook bij aan proliferatie.
Verschillende enzymen die betrokken zijn bij de glycolyse, zoals hexokinase, zijn belangrijke regulatoren van apoptose en gentranscriptie *. Activering van hexokinase zorgt ervoor dat het zich van het cytoplasma naar het mitochondriale membraan verplaatst, waar het interageert met verschillende belangrijke componenten van mitochondria-afhankelijke apoptose en deze remt *. Zo kunnen glycolytische cellen (waaronder kankercellen) een overlevingsvoordeel behalen ten opzichte van niet-glycolytische cellen.
Verhoogde glycolyse verhoogt de concentratie van pyruvaat in de cel. In een gezonde cel gaat dit pyruvaat de mitochondriën binnen om energie te produceren en te metaboliseren tot water en koolstofdioxide. Maar als de mitochondriën dit niet kunnen, bijvoorbeeld door zuurstofgebrek of om andere redenen, hoopt een teveel aan pyruvaat zich op in de cel. Dit verhoogt de activiteit van een enzym genaamd lactaatdehydrogenase, dat pyruvaat metaboliseert tot lactaat (melkzuur), dat vervolgens door de cel wordt uitgescheiden naar de extracellulaire ruimte.
Verzuring van de extracellulaire omgeving. De metabolieten van aërobe ademhaling zijn water en koolstofdioxide, die in combinatie koolzuur vormen, dat een zwakke zuurwaarde heeft (pH 3,68). En de metaboliet van anaërobe ademhaling is melkzuur, dat een orde van grootte sterkere zuurwaarde heeft (pH 2,44). Bovendien produceert anaërobe ademhaling bij hetzelfde niveau van energieproductie vele malen meer melkzuur dan aërobe koolzuurademhaling. En om voldoende intracellulaire zuurgraad te behouden, moeten ze effectief uit de cel worden verwijderd. Het verwijderen van melkzuur uit een cel is meestal niet moeilijk, maar hetzelfde kan niet gezegd worden over de verwijdering ervan uit de intercellulaire ruimte. Wanneer melkzuur zich ophoopt, neemt de zuurgraad in de weefsels toe.
Een verhoging van de zuurgraad in een oplossing leidt tot een daling van het zuurstofniveau daarin (een alkalische omgeving helpt de oplossing met zuurstof te verzadigen, terwijl een zure omgeving zuurstof verdringt). Wanneer cellen de enzymatische ademhaling verhogen, ontstaat er een overmaat aan toxische metabolieten, waaronder melkzuur. Dit verhoogt de intercellulaire zuurgraad, waardoor het zuurstofniveau in de cellulaire omgeving niet voldoende kan stijgen. Een chronisch gebrek aan zuurstof vermindert de functionaliteit van de mitochondriën en zorgt ervoor dat cellen glycolyse op grote schaal blijven gebruiken.
Bovendien zorgt verzuring van de extracellulaire omgeving ervoor dat cellen de intracellulaire omgeving alkaliseren. En dit bevordert op zijn beurt de celdeling. Tijdens mitose wordt bijvoorbeeld een afname van de intracellulaire zuurgraad waargenomen * omdat een meer alkalische omgeving in de cel genen activeert die verband houden met de productie van eiwitten om een nieuwe cel te creëren *.
Een verhoogde zuurstofvrije ademhaling draagt dus bij aan verzuring en destabilisatie van de micro-omgeving van het weefsel, waardoor het pad naar tumorvorming wordt vergemakkelijkt * *. Chronisch zuurstofgebrek kan voor een normale cel voldoende zijn om zijn energieproductiemechanisme onomkeerbaar te veranderen en in een kankercel te transformeren. Dit werd ongeveer honderd jaar geleden voor het eerst aangetoond door Otto Warburg, wat hem reden gaf om te concluderen: “kanker ontstaat wanneer een cel 60% van zijn zuurstofbehoefte verliest... de belangrijkste oorzaak van kanker is de vervanging van de zuurstofademhaling door normale cellen met fermentatiesuikers” *.
Verminderde enzymfuncties. In elk organisme, en in elk van zijn cellen, die zijn eigen systeem vormen, vindt gelijktijdig een groot aantal biochemische reacties plaats die metabolisme of metabolisme worden genoemd. De intensiteit van elk van deze reacties vereist individuele controle, omdat ze allemaal op complexe manieren met elkaar verbonden zijn.
Om een intelligente controle van de stofwisseling te garanderen, gebruiken levende organismen complexe eiwitstructuren die enzymen worden genoemd. Enzymen versnellen bepaalde chemische reacties in de cel honderden keren, en sommige van deze reacties worden fundamenteel alleen mogelijk dankzij enzymen. Eiwitenzymen verschillen van andere chemische katalysatoren door hun buitengewone efficiëntie en extreem hoge specificiteit voor een bepaalde reactie. Deze oplossing zorgt ervoor dat de energie en grondstoffen voor elk specifiek proces alleen aan het reagerende molecuul worden geleverd *, en niet aan het hele systeem, zoals in een reageerbuis zou gebeuren. Dit fundamentele verschil in het verloop van chemische reacties onderscheidt de levende natuur van de levenloze natuur.
Het zijn de enzymen die bepalen welke specifieke metabolische route bepaalde biochemische reacties zullen volgen. Schending van de delicate en evenwichtige functie van enzymen leidt tot biochemische anarchie en, als gevolg daarvan, tot een grote verscheidenheid aan ziekten.
Verhoogde glycolyse en overstroming van weefsel met de eindproducten van het metabolisme verhogen niet alleen de ontsteking, maar veranderen ook de samenstelling en zuurgraad van de chemische omgeving. Vanwege het feit dat elk enzym actief is in een vrij smal bereik van temperatuur en zuurgraad, is het werk van het enzymsysteem ongeorganiseerd, wat ertoe bijdraagt dat biochemische processen in het weefsel uit de hand lopen.
Verminderde mitochondriale functies. Een groeiend aantal bewijzen wijst elk jaar op de conclusie dat kanker meer een stofwisselingsziekte is dan een genetische ziekte. Dat genomische mutaties in feite niet de oorzaak van kanker zijn. Ze veroorzaken geen kwaadaardige degeneratie van cellen, maar dragen er alleen aan bij en begeleiden deze.
Overtuigend bewijs hiervoor wordt geleverd door vele laboratoriumexperimenten die in tegenspraak zijn met de heersende theorie van carcinogenese. Er zijn bijvoorbeeld niet-genotoxische carcinogenen die kanker kunnen veroorzaken zonder het DNA te veranderen (zoals chloroform en dichloorbenzeen) *. Een kwaadaardige tumor zonder enige DNA-mutatie kan ook worden uitgelokt door niet-mutagene vreemde materialen in de lichaamsweefsels te introduceren die de cellulaire interactie verstoren *.
Het vervangen van de kern van een normale kiemcel door de kern van een kankercel (met gemuteerde genen) maakt deze niet kankerachtig; uit zo’n cel worden vervolgens normale organismen geboren *. Omgekeerd laat het vervangen van de kern van een kankercel door de kern van een gezonde cel (zonder mutaties) deze nog steeds kankerachtig achter. Gezonde klonen van muizenembryo’s werden verkregen uit de kernen van kankercellen van hersentumoren *. Kankercellen die in vroege embryo’s worden ingebracht, vormen gezonde weefsels en organen *. De organellen van een cel, en niet de kern, bepalen de kwaadaardige toestand van de cel * * *.
Aan de andere kant kan het introduceren van functionele mitochondriën in een kankercel de verschillende kwaadaardige kenmerken ervan omkeren, waaronder celproliferatie, levensvatbaarheid bij hypoxie, anti-apoptotische eigenschappen, resistentie tegen kankermedicijnen, invasie en kolonievorming, en tumorgroei *.
Veel andere soortgelijke experimenten laten geen basis voor de bewering dat kanker begint met schade aan het nucleaire DNA van de cel. Het is niet alleen de aanwezigheid van mutaties of de expressie van oncogenen die een cel kwaadaardig maken. De gezondheid van het interne milieu, inclusief de functionaliteit van de mitochondriën, speelt een beslissende rol. Zelfs genetische mutaties die verband houden met kwaadaardigheid kunnen een cel niet kwaadaardig maken zolang de mitochondriën en andere celorganellen adequaat functioneren.
Uitgebreid bewijs suggereert dat bij sommige vormen van kanker chromosomale en genmutaties * * * ontbreken, en in andere gevallen zijn er veranderingen gevonden in de DNA-methyleringspatronen, maar niet in de DNA-sequentie *. Tegelijkertijd vindt het ontstaan van kwaadaardige neoplasmata en verhoogde glycolyse plaats na het verlies van de mitochondriale functie *. Bovendien kunnen alle cellulaire tekenen van kanker in verband worden gebracht met disfunctie van de mitochondriën en het energiemetabolisme *.
Chronische hypoxie veroorzaakt door verschillende redenen kan leiden tot schade en vernietiging van eiwitten die nodig zijn voor de normale werking van mitochondriën. Hypoxie verhoogt de productie van vrije radicalen (oxidanten), maar hypoxie is niet de enige oorzaak van oxidatieve stress. Tijdens de mitochondriale ademhaling worden veel vrije radicalen geproduceerd, en er zijn veel factoren die de afbraak ervan beïnvloeden. Hoewel vrije radicalen belangrijke signaalmoleculen zijn, vernietigt hun overmatige concentratie alle eiwitstructuren.
Binnen de mitochondriën beschadigen vrije radicalen niet alleen het mitochondriaal DNA (mtDNA), waardoor het risico op mutaties toeneemt; ze veroorzaken ook schade aan het binnenste mitochondriale membraan en calciumlekkage van de mitochondriën naar het cytosol *. Wanneer ernstig beschadigde mitochondria niet adequaat worden verwijderd, lekt de inhoud ervan in het cytosol en verder in de extracellulaire omgeving. Omdat mitochondriaal DNA niet overeenkomt met nucleair DNA, worden mitochondriale eiwitten als vreemd herkend, wat het ontstekingsproces genereert en intensiveert *. Chronische ontstekingen zelf verhogen de genetische instabiliteit van nucleair DNA * en een verminderde mitochondriale functie *. Als gevolg hiervan voeden beide processen (productie van vrije radicalen en mitochondriale dysfunctie) elkaar wederzijds, waardoor een vicieuze cirkel ontstaat.
Mitochondriaal DNA is gevoeliger voor oxidatieve stress dan nucleair DNA. Hierdoor vertonen kankercellen hoge niveaus van mtDNA-mutaties *. Het mitochondriale genoom codeert voor veel belangrijke componenten van de eiwitten van de ademhalingsketen, dus mutaties in mtDNA kunnen de geschiktheid van de cellulaire ademhaling negatief beïnvloeden door de pyruvaatfermentatie te stimuleren *. Het aantal mtDNA-kopieën kan ook afnemen en onder een kritisch niveau komen, wat de groei en metastase van tumoren *, inclusief borsttumoren *, bevordert.
Verstoring van de mitochondriale functie kan niet alleen worden veroorzaakt door oxidatieve stress en hypoxie, en de mitochondriale DNA-mutaties die daardoor worden veroorzaakt, maar ook door vele andere redenen. Bijvoorbeeld natuurlijke veroudering van mitochondriën, chemicaliën, straling, virussen en andere kankerverwekkende stoffen.
Tenslotte, het laatste maar belangrijkste. Mitochondriale disfunctie wordt grotendeels veroorzaakt door hoge glucosewaarden in het bloed als gevolg van overvoeding. Om het bloed te ontdoen van overtollige suikers, dwingt insuline de cellen om glucose op te nemen, zelfs als ze die eigenlijk niet nodig hebben. Suiker is plakkerig van aard en het deel van de suiker dat niet deelneemt aan de glycolyse blijft plakken aan de eiwitten die in de cel aanwezig zijn. Het hecht zich bijvoorbeeld aan enzymen, waardoor alle stofwisselingsprocessen worden verstoord. De hechting van glucose aan andere eiwitten veroorzaakt ook verstoring van hun functie. Bovendien kunnen dergelijke (geglyceerde) eiwitten door het immuunsysteem als een vreemd agens worden beschouwd, waardoor de mate van systemische ontsteking toeneemt.
Cellen proberen overtollige glucose kwijt te raken door het te metaboliseren tot vetzuren, die vervolgens direct in de cel worden opgeslagen. De intracellulaire accumulatie van triglyceriden wordt echter ook in verband gebracht met mitochondriale schade of dysfunctie van oxidatieve fosforylatie *.
Als gevolg van chronische stress ondergaan de mitochondriën morfologische veranderingen, wat resulteert in atrofie van gebieden die betrokken zijn bij oxidatieve fosforylering. Omdat de structuur van een orgaan zijn functie bepaalt, neemt de ATP-productie af. Door een gebrek aan energie vertragen alle processen die ATP vereisen. De synthese van enzymen en het werk van membraantransporters zijn verzwakt; cellen verliezen hun natuurlijke vorm, organisatie en adequate intercellulaire communicatie.
Mitochondriën zenden chemische signalen uit dat ze niet in staat zijn voldoende energie te leveren en dat er alternatieve energieproductieroutes nodig zijn. Als reactie hierop worden zogenaamde oncogenen geactiveerd in nucleair DNA, die de glycolyse verhogen en daardoor de kwaadaardige degeneratie van cellen* bevorderen *.
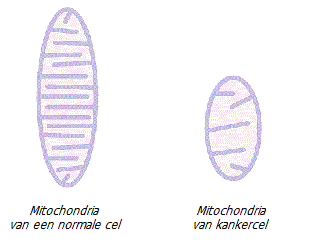
Over het algemeen bepaalt de mitochondriale functionaliteit de expressie van veel nucleaire DNA-genen die het energiemetabolisme, tumoronderdrukkers, intracellulaire calciumniveaus, medicijnresistentie, productie van vrije radicalen en vele andere genen controleren die het celgedrag fundamenteel kunnen veranderen * *.
Mitochondria zijn ook een belangrijke controleplaats voor autofagie en apoptose *. Met autofagie kun je slecht functionerende cellen verwijderen; ze worden eenvoudigweg opgegeten door immuuncellen. Apoptose (het proces van celzelfmoord) vindt plaats wanneer nucleair DNA defect is geraakt. Een verslechtering van de mitochondriale functie kan er echter voor zorgen dat abnormale cellen met gemuteerd DNA in leven blijven. En breng dezelfde abnormale nakomelingen * met hetzelfde hoge gehalte aan vrije radicalen * ter wereld, die nieuwe kwaadaardige mutaties zullen veroorzaken, enzovoort, in een vicieuze cirkel.
Een verzwakking van de mitochondriale ademhaling en een toenemende glycolyse verminderen de celdifferentiatie en stimuleren de celdeling. Bovendien zijn genen en signaalroutes die betrokken zijn bij verhoogde glycolyse zelf anti-apoptotisch * en zullen ze de onderdrukking van apoptose in glycolytische cellen versterken. Interessant genoeg kan het totale aantal mitochondria in getransformeerde cellen zelfs toenemen, maar hun functionaliteit blijft nog steeds laag.
Gebrek aan energie leidt tot een afname van de productie van enzymen die beschadigde DNA-moleculen repareren, wat bijdraagt aan de accumulatie van mutaties. Bovendien zorgt de verzwakking van de mitochondriale functie ervoor dat telomerase migreert van de mitochondriën naar de kern, waar het de nucleaire DNA-telomeren versterkt, die het aantal celdelingen beperken *. Hierdoor krijgt een glycolytische cel, in tegenstelling tot een normale cel, de mogelijkheid om een onbeperkt aantal keren te delen. Of, zoals vaak wordt gezegd: de cel verwerft «onsterfelijkheid».
Mitochondriale disfunctie leidt dus tot ernstige problemen met de cellulaire gezondheid. Het is een sleutelfactor in de kwaadaardige transformatie van een cel, omdat het de cel dwingt zijn toevlucht te nemen tot enzymatische energieproductie. Niet alle kankerverwekkende factoren veroorzaken genmutaties, maar bijna allemaal beïnvloeden ze op de een of andere manier de werking van de mitochondriën. Het lijkt erop dat de verstoring van de mitochondriën de gemeenschappelijke biologische basis is van de hele diversiteit aan kankertumoren.
Afname van het transmembraanpotentieel. Een gebrek aan cellulaire energie belemmert de werking van ionenpompen die de vereiste concentratie van bepaalde stoffen in de cel handhaven. Hierdoor wordt de verhouding tussen extracellulaire en intracellulaire ionen verstoord. Het aantal negatieve ionen in de cel daalt, waardoor de elektrische potentiaal op het celmembraan, de transmembraanpotentiaal (Em) genoemd, afneemt.
Cellen zijn niet alleen een chemische machine, maar ook een elektrische machine. De biochemie van processen in een levende cel kan niet los worden gezien van bio-elektrische signalen. Ionenstromen, spanningsgradiënten (transmembraan of transepitheliaal) en elektrische velden zijn belangrijke regulatoren van celgedrag en weefselorganisatie, waarbij ze het celaantal (proliferatie en apoptose), celpositie (migratie en oriëntatie) en celidentiteit (differentiatietraject) controleren *.
Het transmembraanpotentieel wordt beschouwd als een sleutelparameter die de controle van de proliferatie, de differentiatietoestand en de kwaadaardige transformatie van cellen bemiddelt * *. In de rusttoestand hebben volwassen, gedifferentieerde cellen hogere Em-waarden vergeleken met hun Em-waarden bij het delen, en ook vergeleken met ongedifferentieerde cellen zoals embryonale, stam- of kankercellen. Een daling van Em (depolarisatie) veroorzaakt een aantal veranderingen die verband houden met de transcriptie van genen die belangrijk zijn voor de fenotypische transformatie van een normale cel in een kankercel *.
Vanuit dit perspectief kan kanker worden gezien als een ontregeling van het informatieveld dat de activiteit van individuele cellen richting normaal functioneren stuurt *.
Verlies van intercellulaire communicatie. Een toename van de concentratie van metabolische producten van glycolytische cellen (melkzuur en barnsteenzuur) als gevolg van een verhoogde zuurgraad van het weefsel ondersteunt chronische lokale ontstekingen.
Ontsteking verhoogt de hoeveelheid eiwitten en polysachariden waaruit de extracellulaire matrix (ECM) bestaat, zoals collageen en hyaluronzuur. De ECM fungeert als een microsteiger waardoor cellen zich eraan kunnen hechten en een elastisch weefselvolume kunnen vormen in plaats van zich als gelei uit te spreiden. Overmatige accumulatie van extracellulaire matrix compliceert echter het transport van signaalmoleculen uit naburige en verre cellen. Verbeterde adhesie van epitheelcellen aan de matrix vermindert hun gevoeligheid voor intercellulaire signalen en omzeilt veel van de normale routes van groeiremming *. Dit is goed bij acute ontstekingen, waarbij cellen zich dringend moeten delen om dode cellen te herstellen. Maar het is slecht voor chronische ontstekingen, die kunnen bijdragen aan de ontwikkeling van tumoren.
Epitheelcellen zijn bedekt met zogenaamde glycocalix. Dit is een wollige dunne laag van oligosachariden, polysachariden, glycolipiden en glycoproteïnen ingebed in de cel, evenals celadhesiemoleculen – immunoglobulinen, integrinen, cadherinen, selectinen. De glycocalyx verbindt de cel met de extracellulaire matrix en beïnvloedt het vermogen van cellen om onderling chemische of elektrische signaalkanalen te vormen. De glycocalyx zelf beïnvloedt dus hoe informatie wordt gefilterd en van de ene cel naar de andere wordt verzonden.
Overtollig glycoproteïneslijm kan worden aangetast door proteolytische enzymen of zwakke alkaliën. In normale weefsels die enigszins alkalisch zijn, en nog meer met voldoende enzymen, is de glycoproteïnelaag dun en zorgt voor directe cellulaire communicatie met behulp van celadhesiemoleculen, enz. «gap-contacten». Het standaardverlangen van een cel is verdeling, en niet rust *, zoals nog steeds algemeen wordt aangenomen. Een normaal verdeelde cel van een meercellig organisme, die signalen ontvangt van nauw contact met aangrenzende gedifferentieerde cellen, begrijpt echter dat hij nergens verder kan groeien en stopt zijn verdere deling.
In gebieden met hyperplasie kan een ander beeld worden waargenomen. Een agressieve extracellulaire omgeving dwingt cellen zichzelf ertegen te beschermen, onder meer door hun glycocalyx te vergroten. Dit wordt mogelijk gemaakt door de verhoogde zuurgraad van de intercellulaire ruimte, wat het werk van proteolytische enzymen die overtollige glycocalyx kunnen oplossen, schaadt. De ophoping van glycoproteïne en extracellulaire matrixeiwitten in de intercellulaire ruimte belemmert de directe overdracht van chemische signalen tussen cellen via speciale kanalen die ze verbinden. De nauwe contactsignalen die de celdeling tegenhielden, worden verzwakt. Zo krijgen de cellen een extra stimulans voor hun groei.
Een toename van het aantal immuun- en andere aangetrokken cellen op de plaats van ontsteking kan ook de signaalinteractie van borstepitheelcellen negatief beïnvloeden.
Langdurige verslechtering van de intercellulaire signalering beïnvloedt de genetische mechanismen van cellen in het brandpunt van hyperplasie *. Dankzij de genetische en epigenetische invloed van de micro-omgeving zijn oncogenen in staat het celfenotype in een kwaadaardig fenotype te transformeren, waarbij de controle over groei, differentiatie en apoptose verloren gaat.
Het lijkt er allemaal op dat de transformerende cel terugkeert naar haar pre-collectieve verleden. Met het verlies van interactie met andere cellen gaan de voordelen van het leven in een cellulaire gemeenschap verloren, terwijl egoïsme de cel gunstiger omstandigheden kan bieden om te overleven. In feite worden cellen onder omstandigheden van hoge zuurgraad en gebrek aan zuurstof geprimitiviseerd en keren ze terug naar hun primitieve fenotype, dat bestond in pre-zuurstof, pre-multicellulaire tijden van evolutie.
Verlies van differentiatie. Differentiatie omvat de verwerving door een onvolwassen cel van bepaalde structurele en functionele kenmerken die hem in staat stellen zijn gespecialiseerde taak in een meercellige gemeenschap uit te voeren *.
Dit proces kan worden vergeleken met de menselijke «coming of age»-fase. Net als mensen verwerft een pasgeboren, onrijpe cel fenotypische specialisatie voor zijn dienst in een specifiek orgaan en weefsel. Embryonale cellen zijn aanvankelijk primitief, ongedifferentieerd, grotendeels anaëroob en vermenigvuldigen zich snel en zonder beperking, terwijl volledig gedifferentieerde, gespecialiseerde cellen in normale weefsels aëroob zijn en hun deling en groei strikt beperkt zijn *.
Naarmate het embryo groeit, ondergaan de embryonale cellen morfologische veranderingen, waarbij ze steeds meer van elkaar gaan verschillen, om bepaalde organen van het nieuwe lichaam te vormen. Een heel klein deel ervan blijft in een slecht gedifferentieerde staat. Dit zijn de zogenaamde stamcellen van een bepaald orgaan.
Gelegen in afgelegen hoeken, in zogenaamde nissen, onder de bescherming van een dicht netwerk van extracellulaire matrix, fungeert de stamcel als een bijenkoningin in de korf, waarbij hij indien nodig nieuwe klonen van zichzelf produceert. In een nis is slechts ruimte voor één cel, en na deling verlaat één van de dochtercellen de nis en migreert naar de plek waar het verzoek vandaan kwam. Daar wordt de nieuwe cel gefixeerd, krijgt zijn functionaliteit en begint zijn taken.
De vorming van specifieke celvaardigheden vindt plaats door de expressie van zijn genen te veranderen onder invloed van algemene en lokale signalen. In onderstaande figuur kun je zien hoe gespecialiseerde immuuncellen door sequentiële differentiatie uit één stamcel ontstaan.
Verdichting van de extracellulaire matrix belemmert de communicatie tussen cellen en zorgt ervoor dat het mechanisme van hun wederzijdse controle wegvalt *. De situatie wordt verergerd door de ophoping van gifstoffen in de cellen. Dit alles verstoort het mechanisme van sequentiële genexpressie dat volledige celrijping garandeert. In gebieden met hyper- en metaplasie neemt het aantal cellen met verminderde (in verschillende mate) differentiatie toe, en de mate van cellulaire differentiatie kan worden gebruikt om de progressie van kanker te beoordelen.
Door de onvolledige rijping van de epitheelcel vervult deze zijn functionele rol niet goed genoeg in het daarvoor bestemde orgaan. Dit kan de celdeling stimuleren om te proberen de slechte efficiëntie van werknemers te compenseren door hun aantal te vergroten.
De inferioriteit van de ontwikkeling van celstructuren schaadt het functioneren van al zijn andere functies, inclusief die welke lokale weefselcontrole over de reproductie ervan bieden. Epitheelcellen vernieuwen zichzelf zeer snel (binnen een paar dagen, maximaal een paar weken), en defecte cellen kunnen hun aantal zeer snel vergroten.
Verdere primitivisering, het negeren van commandovereisten en uiteindelijk de onbeheersbaarheid van individuele cellen leidt ertoe dat ze op eencellige parasieten beginnen te lijken. Met andere woorden, cellen die differentiatie hebben verloren (geprimitiviseerde cellen), ondanks het meercellige genotype, verwerven een eencellig fenotype. Dergelijke cellen vervullen hun sociale functie zeer slecht of vervullen hun sociale functie helemaal niet, maar consumeren actief hulpbronnen, vergiftigen het milieu en vermenigvuldigen zich krachtig.
Tot op zekere hoogte is de omgeving van normale cellen nog steeds in staat voldoende signalen te leveren die onvolwassen cellen ervan weerhouden openlijk asociaal gedrag te vertonen. En hen dwingen de bevelen van apoptose, controle over deling en differentiatie te gehoorzamen. Een geleidelijke toename van de omvang van hyperplasieknopen in de borstklier, of de fusie van nabijgelegen hyperplasieknopen, verzwakt deze remmende signalen echter steeds meer.
Dergelijke cellen zijn doof voor externe commando's en kunnen migreren naar plaatsen waar ze niet nodig zijn. Of blijf op hun plaats en vorm lokale opeenhopingen van hun eigen soort (mammosferen). Wanneer de oestrogeenspiegels in het weefsel hoog zijn (of onder andere omstandigheden die de bloedstolling verhogen), bedekt fibrine de mammosferen, waardoor het moeilijker wordt voor immuundodende cellen om niet-functionele cellen te herkennen en te vernietigen.
Chronische verdichting en desorganisatie van de extracellulaire matrix geven aanleiding tot veel tumorvormende gebeurtenissen * *. Cellen die worden blootgesteld aan een stijvere extracellulaire matrix prolifereren meer als reactie op groeifactoren *. Het binden van cellen aan de extracellulaire matrix kan de activiteit onderdrukken van veel tumoronderdrukkers die de cel in een staat van celrust houden, waardoor beperkingen op de celdeling worden opgeheven *. Bovendien schaadt een verhoogde adhesie aan de extracellulaire matrix direct of indirect de functie van bepaalde tumoronderdrukkers die de controlepunten van de celcyclus controleren *. Om deze reden wordt het apoptosemechanisme verstoord wanneer er fouten optreden tijdens de celdeling, en is de kans groter dat defecte cellen defecte nakomelingen produceren.
De cyclus van alle onderling verbonden verschijnselen die hierboven zijn besproken, versnelt en verergert geleidelijk: ontsteking; fibrose; zuurstoftekort; een toename van het aandeel van glycolyse in cellulaire energie en verzuring van de cellulaire omgeving; desorganisatie van enzymwerk; verlies van wederzijdse cellulaire regulatie; ongecontroleerde verdeeldheid; onvoldoende celdifferentiatie; verminderde mitochondriale functie, wat leidt tot genetische mutaties en negatieve evolutionaire selectie. Dit proces is niet eenmalig, maar beweegt zich in vertakte, gesloten lussen, steeds weer intensiverend en verdiepend, of omgekeerd: verzwakkend.
Wanneer compensatiemechanismen er niet in slagen de groeiende uitdagingen het hoofd te bieden, beginnen biologische processen in het weefsel uit de hand te lopen.
Chronische ontsteking. Elke wond, zowel acuut als chronisch, veroorzaakt een natuurlijke reactie om beschadigd weefsel te regenereren *. In het geval van mechanische weefselschade is de allereerste fase van herstel hemostase. In dit geval vernauwen de bloedvaten en vormen bloedplaatjes, in contact met beschadigde cellen van de bloedvaten, bloedstolsels (klonters). Met behulp van bloedstolsels wordt bloedverlies voorkomen en wordt er een tijdelijke fysieke barrière gevormd tussen de plaats van het letsel en onbeschadigd weefsel.
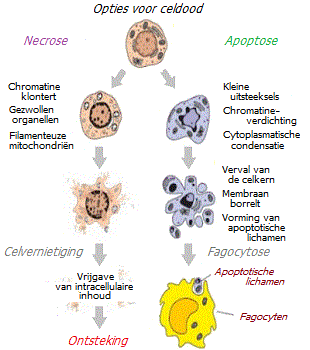
Schade of stress kan door andere oorzaken worden veroorzaakt dan ernstig lichamelijk trauma, zoals een infectie. In dit geval kan de dood van lichaamscellen plaatsvinden zonder bloedverlies.
Vrijwel onmiddellijk na hemostase begint de volgende herstelfase: ontsteking. Schade aan cellen gaat gepaard met mechanische vernietiging of dood door necrose. Tijdens necrose komt de inhoud van dode cellen in de intercellulaire ruimte terecht, waardoor ontstekingen ontstaan. De ontstekingsreactie gaat gepaard met lokale verschijnselen zoals zwelling, roodheid, warmte en pijn.
Bloedvaten op de plaats van het letsel verwijden zich en hun endotheelcellen worden geactiveerd. De afstand tussen hen neemt toe en de snelheid van de bloedstroom vertraagt. Hierdoor lekken signaalmoleculen en immuuncellen door de endotheellaag het weefsel in.
Immuuncellen van de eerste verdedigingslinie – leukocyten (witte bloedcellen) absorberen en verwijderen vreemde micro-organismen, en natuurlijke killercellen verwijderen dode en beschadigde cellen en hun fragmenten *. Beschadigde epitheel- en endotheelcellen en fibroblasten geven pro-inflammatoire moleculen vrij (cytokinen en chemokinen) die leukocyten (neutrofielen, macrofagen en eosinofielen), lymfocyten (T-cellen, B-cellen) en bloedvatcellen op de plaats van ontsteking rekruteren en activeren *.
Chemische signalen van beschadigd weefsel verhogen de expressie van genen die verband houden met celgroei. Door zich op te hopen op de plaats van letsel scheiden mestcellen, T-cellen, macrofagen en fibroblasten groei- en herstelfactoren af die de celdeling en het herstel van beschadigd weefsel bevorderen. Dit zijn bijvoorbeeld transformerende groeifactor (TGF-β), van bloedplaatjes afgeleide groeifactor (PDGF), fibroblastgroeifactor (FGF) en epidermale groeifactor (EGF). Opmerkelijk genoeg dragen dezelfde genen en groeifactoren bij aan het ontstaan en de progressie van kanker.
Bloedstolsels als gevolg van een bloeding belemmeren de vloeistofbeweging en de zuurstoftoevoer. Dit verhoogt de concentratie van door hypoxie geïnduceerde groeifactor (HIF-1α), wat de cellen verder stimuleert om te delen. Tegelijkertijd belemmert een tijdelijk zuurstofgebrek het proces van celdeling waarbij gebruik wordt gemaakt van glycolytische energieproductie niet.
Na haastig het reparatiegebied en de plaatselijke ontsteking af te schermen, begint de volgende fase van reparatie: proliferatie.
In de wondlaag stimuleren macrofagen de synthese van extracellulaire matrixmoleculen (ECM) door fibroblasten – collageen en glucosamine, die een betrouwbaardere en langdurigere isolatie creëren van de plaats van herstel van beschadigd weefsel. Als gevolg hiervan wordt de plaats van de verwonding dichter en neemt de druk daarbinnen toe.
Overmatige ophoping van gerecruteerde cellen en bindweefsel (fibrose) schaadt de beweging van speciale signaaleiwitten (kelons), die worden geproduceerd door volwassen cellen. Keylons blokkeren het deel van het DNA dat het delingsproces (mitose) initieert, waardoor hun uitputting de blokkering van het proces van weefselceldeling verder verzwakt. Hormonen kunnen ook de snelheid van de celgroei beïnvloeden: oestrogeen stimuleert de proliferatie van borstweefsel, terwijl androgeen dit remt *.
Gestimuleerd door groeifactoren verdelen epitheelcellen actief beschadigde slijmvliezen en herstellen ze. Terwijl ze groeien, bewegen ze zich langs het oppervlak van de schade, van de rand naar het midden, en wanneer ze elkaar ontmoeten, stoppen ze met delen als gevolg van de werking van contactsignalen. Geactiveerde fibroblasten (myofibroblasten) stimuleren het samentrekken van de wondranden; het beschadigde weefsel wordt vervangen door bindweefsel, waardoor littekens ontstaan. En endotheelcellen vormen nieuwe bloed- en lymfevaten, die zorgen voor de zuurstofstroom en de circulatie van stoffen die nodig zijn voor deze processen. Alles bij elkaar draagt dit bij aan het snelle herstel van het weefsel van het gewonde gebied.
Als de bron van de verwonding niet langer aanwezig is, stopt na voltooiing van de proliferatiefase de expressie van oncogenen (groei- en reparatiegenen) en begint de expressie van tumorsuppressorgenen. De laatste fase van herstel begint – hermodellering en rijping, waarbij ontstekingscellen op de plaats van het letsel worden verwijderd, nieuw gecreëerde cellen uiteindelijk worden gedifferentieerd, de processen van ontbinding van de extracellulaire matrix beginnen te prevaleren boven de processen van de synthese ervan, overtollig bloedvaten en collageen worden opgelost, en littekenweefsel verhoogt de sterkte.
In eerder beschadigde weefsels worden de normale organisatie van vezels, de bloedtoevoer en de lymfestroom hersteld en wordt de weefseldichtheid genormaliseerd. Deze herstelfase vindt ongeveer 3-4 weken na acuut letsel plaats en duurt gewoonlijk maximaal 2 jaar. Het weefsel herstelt echter meestal nooit naar zijn oorspronkelijke uiterlijk, en de resterende littekens verdwijnen mogelijk pas aan het einde van het leven.
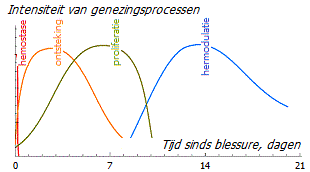
Genezing wordt gekenmerkt door een strikte opeenvolging van nauwkeurig geprogrammeerde biologische processen. Alle vier de fasen en hun fysiologische functies moeten op een bepaald tijdstip en gedurende een bepaalde periode met optimale intensiteit plaatsvinden. Als dit proces zonder falen verloopt, zoals hierboven beschreven, dan duurt in dit geval de periode van ontsteking en de productie van groeifactoren een beperkte tijd, waarna een korte ontstekingsremmende periode optreedt en de homeostase wordt hersteld.
Als de genezing echter niet goed plaatsvindt, of de bron van het letsel niet verdwijnt, of als weefselbeschadiging vaker voorkomt dan het herstelproces is voltooid, is de volgorde van fysiologische herstelprocessen verward *. In het natuurlijke verloop van het proces, aan het einde van de regeneratie, klinkt het commando «ophangen» voor de cellen die eraan deelnemen, en zij stoppen hun activiteit. Wanneer de fasen van het genezingsproces echter door elkaar worden gehaald, ontstaat er een managementchaos.
In dit geval kunnen signalen van de ontstekings- en proliferatieve stadia van genezing elkaar overlappen. Het proces van weefselherstel kan niet begrijpen wanneer het precies moet stoppen. Het zal strakker worden, waardoor een overmatige ophoping van cellen ontstaat. En als de verbouwingsfase nooit plaatsvindt, kan het proces lange tijd in deze onzekerheid blijven hangen.
Als er geen genezing plaatsvindt, worden ontstekingen en fibrose permanent en gaat de productie van groeifactoren door, waardoor de constante deling van cellen die vatbaar zijn voor glycolyse wordt gestimuleerd en de omstandigheden worden gecreëerd voor tumorvorming. De massa cellen neemt sneller toe dan hun aanbod, en sommige sterven door necrose, waardoor de ontsteking in stand blijft en toeneemt *. Deze gesloten cyclus wordt gehandhaafd totdat het weefsel volledig is genezen * of totdat het lichaam volledig is uitgeput.
Soortgelijke, hoewel minder voor de hand liggende, processen zullen optreden bij langdurige blootstelling aan andere eerder besproken carcinogene factoren die fibrose kunnen veroorzaken.
Ontoereikendheid van autofagie. Autofagie (uit het Grieks vertaald als «zelfetend») is een natuurlijk proces waarbij cellen worden gereinigd van interne reserves, van overtollige of ongewenste elementen in cellen; evenals het proces van het wegwerken van zwakke, beschadigde of disfunctionele cellen. Dit is een soort kannibalisme dat op zichzelf gericht is. De niet-functionele eiwitten van het lichaam worden gerecycled en hergebruikt binnen hetzelfde organisme.
Autofagie wordt alleen geactiveerd en werkt adequaat wanneer de cel een tijdelijk gebrek aan energie ervaart en zich tot interne bronnen moet wenden. Lange pauzes in de voeding (vasten gedurende de dag, 12 uur durende nachtelijke onthouding, enz.) of beperking van de calorie-inname (caloriearm dieet, caloriemimetica, enz.) bevorderen de interne celreiniging, evenals de verwijdering van kanker cellen .
Omgekeerd dragen een calorierijk dieet en een hoog gehalte aan circulerende voedingsstoffen (glucose, aminozuren, vetzuren) bij aan de kwaadaardige degeneratie van cellen en het bevorderen van kanker. Wanneer het lichaam voldoende voedsel van buitenaf ontvangt, is het niet nodig om zijn toevlucht te nemen tot het zoeken naar interne mogelijkheden. Aan de andere kant kan een overmatige intensivering van autofagie ertoe leiden dat volledig functionele cellen worden vernietigd.
Autofagiestoornis gaat niet noodzakelijkerwijs gepaard met het kankerproces, maar heeft er een vrij aanzienlijke negatieve invloed op.
Vorming van een precancereuze niche. Bij chronische ontstekingen treedt er een lokale verandering in de weefselstructuur op. Zoals reeds besproken wordt een chronische wond gekenmerkt door een grote hoeveelheid granulatieweefsel, dat bestaat uit een netwerk van haarvaten en extracellulaire matrix, en dat verrijkt is aan fibroblasten, ontstekingscellen, endotheelcellen, pericyten en myofibroblasten. Wanneer ontstekingscellen zoals macrofagen worden gerekruteerd op de plaats van ontsteking, produceren ze grote hoeveelheden groeifactoren, cytokines en vrije radicalen.
Hoewel vrije radicalen een effectieve manier zijn om acute infecties te doden, brengt de voortdurende activering van macrofagen de dreiging van weefselschade * en genetische mutaties * met zich mee. Sommige cytokinen kunnen transformerende cellen ook beschermen tegen apoptose door het p53 * -gen te onderdrukken. Bovendien kunnen ontstekingscellen transformerende cellen helpen de immuunrespons te omzeilen * *.
Het agressieve eindproduct van anaërobe ademhaling, melkzuur (lactaat), stimuleert samen met door hypoxie geïnduceerde groeifactor de productie van extracellulaire matrix. Chronische overmatige productie van collageen, proteoglycanen en fibronectine aan de ene kant, en een verzwakking van het proces van vernietiging van de extracellulaire matrix aan de andere kant, leidt tot de accumulatie ervan. Een teveel aan extracellulaire matrix bevordert op zijn beurt de celgroei.
Wanneer celdeling sneller plaatsvindt dan celdifferentiatie, vindt er lokale accumulatie van ongedifferentieerde cellen plaats. Ongedifferentieerde cellen verhogen de productie van groeifactoren, die kunnen helpen bij het genezen van verwondingen, maar bij chronische verwondingen/ontstekingen bevordert dit de tumorvorming. Aan de andere kant komen signalen om de deling te stoppen sterker van volwassen cellen, dus de verrijking van de precancereuze niche met onrijpe cellen versterkt de carcinogene neiging. Hierdoor ontstaat er een zichzelf in stand houdende cyclus van ongecontroleerde reproductie van onrijpe (transformerende, tumorvormende en vervolgens kankervormende) cellen.
Een onuitputtelijke bron van vernieuwing van normale weefselcellen zijn stamcellen, die zich verbergen in een dicht netwerk van extracellulaire matrix, net zoals jonge vissen zich verstoppen in de dichte algen. De extracellulaire matrix creëert niet alleen een betrouwbare omheining voor de niche van een normale stamcel. Het zorgt ervoor dat er biochemische processen plaatsvinden die bescherming, overleving en verder verblijf in een ongedifferentieerde staat bevorderen.
Op dezelfde manier verhoogt chronische, abnormaal hoge fibrose geassocieerd met ontstekingen het volume en de dichtheid van de matrix, die dezelfde veilige haven vormt die ongedifferentieerde en gemuteerde cellen herbergt *.
Dankzij deze twee processen – ontsteking en de daardoor veroorzaakte fibrose – wordt dus een specifieke lokale micro-omgeving gevormd – een precancereuze niche, die cellen ertoe aanzet de glycolyse en deling te verhogen en de mate van hun differentiatie te verminderen.
Schending van de morfologie. Als gevolg van de beschreven processen verliezen cellen in de brandpunten van tumortransformatie geleidelijk hun normale uiterlijk en structuur, wat onder een microscoop te zien is. De hoeveelheid bindweefsel neemt toe en structurele afwijkingen van het gehele weefselcomplex (dysplasie) beginnen duidelijk te verschijnen.
Milde dysplasie is echter nog steeds een omkeerbare aandoening. Het kan niet alleen vooruitgaan, maar in de loop van de tijd stabiliseren en zelfs achteruitgaan. Ernstige dysplasie kent al weinig verschillen met het ontstaan van een goedaardige of kwaadaardige niet-agressieve tumor.
Precancereuze aandoeningen komen zeer vaak voor. Een postmortemonderzoek naar de borstklieren van Deense vrouwen van middelbare leeftijd, uitgevoerd in 1987, toonde een wijdverbreide prevalentie aan van ziekten zoals goedaardige hyperplasie (55%), atypische hyperplasie (9%), metaplasie (85%), fibroadenoom (23%) *. Het grootste deel van de laesies kwam voor bij vrouwen ouder dan 40 jaar, en ze hebben zich kennelijk in de loop van vele jaren daarvoor ontwikkeld. De meeste tumoren waren niet groter dan 5 mm en het merendeel van deze laesies werd pas ontdekt na het overlijden van deze vrouwen. In de afgelopen 33 jaar sinds de publicatie van dit onderzoek is de situatie met de prevalentie van precancereuze aandoeningen, te oordelen naar de statistieken over de incidentie van kanker, alleen maar verslechterd.
In de Verenigde Staten werd in dezelfde jaren bij 50% van de vrouwen tijdens hun leven de diagnose fibrocystische aandoeningen gesteld, en bij 90% van de vrouwen werd de diagnose postmortem gesteld *. Het probleem is zo ver gegroeid dat er, als gevolg van de snelle toename van de incidentie, zelfs voorstellen zijn gedaan om fibrocystische aandoeningen niet als een ziekte te beschouwen als er geen atypie is *. Met andere woorden, er werd voorgesteld om de status van de ziekte te verminderen vanwege het onvermogen om de epidemie het hoofd te bieden.
Terloops merken we op dat de veroudering van het lichaam met dezelfde gebeurtenissen gepaard gaat: weefseloxidatie, verminderde mitochondriale functies, latente chronische algemene ontsteking * en weefselfibrose in veel organen *. Daarom kunnen alle maatregelen gericht op het verjongen van de mitochondriën, het verminderen van vrije radicalen, het tegengaan van fibrose en het verminderen van ontstekingssignalen in het lichaam mogelijk ook het verouderingsproces remmen.
Genetische modificaties kunnen het hele proces van carcinogenese begeleiden, dat al lang vóór het verschijnen van de tumor zelf begint. Ze zijn een gevolg van de genomische instabiliteit van cellen, veroorzaakt door hun ongunstige externe omstandigheden, en de poging van cellen om zich aan deze omstandigheden aan te passen door middel van genetische en epigenetische veranderingen.
Genetische modificaties kunnen een belangrijke rol spelen bij tumorvorming en -persistentie, maar mutaties zijn eigenlijk slechts een deel van het probleem en niet de kern ervan. In veel gevallen kunnen somatische mutaties niet worden gedetecteerd in tumorcellen, wat duidelijk niet overeenkomt met de algemeen aanvaarde theorie. In de meeste gevallen vordert het kwaadaardige proces echter zo ver dat het leidt tot mutaties, onder meer in genen die bijdragen aan het verschijnen, overleven en reproduceren van kankercellen (zogenaamde oncogenen).
Ondanks hun naam komen oncogenen en proto-oncogenen niet alleen tot uiting bij kanker * en, zoals eerder besproken, tijdens de beginfase van de genezing van verwondingen *, maar ook tijdens de zwangerschap en de embryonale ontwikkeling * *. En de eiwitten die door deze genen tot expressie worden gebracht, nemen tijdelijk deel aan natuurlijke, niet-kankerachtige processen.
Het probleem met oncogenen is dus niet dat deze genen die het lichaam nodig heeft, in principe tot expressie komen. Het probleem is dat ze op ongecontroleerde wijze tot uiting komen – op het verkeerde moment en op de verkeerde plaats. Aanpassing aan externe omstandigheden als gevolg van genetische aanpassing met het verder voortbestaan van de meest succesvolle opties is precies het mechanisme waardoor de evolutie van de levende natuur plaatsvindt. Maar in gevallen als kanker is dit mechanisme destructief.
Ondanks het feit dat de ontwikkeling van tumoren gepaard gaat met een steeds groter aantal genomische veranderingen, kan niet worden beweerd dat deze de oorzaak van kanker zijn. Integendeel, ze zijn een gevolg van dit proces. Elke afzonderlijke zieke of abnormale cel in het lichaam, inclusief kanker, zal onmiddellijk worden herkend en vernietigd door gezonde immuuncellen. De ontwikkeling van een tumor is alleen mogelijk als er sprake is van een zekere samenloop van verschillende ongunstige factoren; en de genetische factor alleen is hiervoor duidelijk niet voldoende.
Ondergeschiktheid van de micro-omgeving. Het overwinnen van het beperkende effect van de micro-omgeving van de pretumor-niche en het ondergeschikt maken ervan aan iemands belangen is een belangrijke fase in de ontwikkeling van kanker. De invloed van de micro-omgeving kan een sterkere invloed hebben op de vorming van het fenotype van een cel dan de instructies van het genoom *. Zelfs meerdere mutaties in een enkele cel leiden, gezien de adequate micro-omgeving, niet tot tumorvorming. Expressie van oncogenen produceert alleen een kwaadaardig fenotype in een specifieke micro-omgevingscontext *. Tijdens chronische ontstekingen wordt bijvoorbeeld de methylering van DNA-gebieden verstoord, wat de expressie van pro-tumorgenen kan activeren of de expressie van antitumorgenen kan onderdrukken.
Glycolytische cellen dompelen niet alleen zichzelf, maar ook andere normale cellen om hen heen onder in een giftige omgeving. De productie van glycolytische energie verhoogt de extracellulaire zuurgraad, en een hoge zuurgraad leidt tot zuurstofgebrek. Hypoxie en ontstekingen in de precancereuze niche onderdrukken de immuuncontrolefunctie, waardoor defecte cellen detectie en vernietiging kunnen omzeilen. Een hoge lokale weefseldichtheid bevordert dit omdat de functie van immuun-T-cellen en natural killer-cellen onder deze omstandigheden wordt aangetast.
In de pretumor-niche neemt de signaalcommunicatie tussen cellen door direct contact af, maar tegelijkertijd neemt de communicatie via exosomen – extracellulaire blaasjes (EV, extracellulaire blaasjes) – toe. Exosomen, geproduceerd door tumorproducerende cellen, dragen bepaalde soorten immuunregulerende moleculen naar immuuncellen, waardoor ze immuunbewaking kunnen omzeilen. Exosomen produceren ook kwaadaardige fenotypes in andere epitheelcellen door oncogene eiwitten en microRNA's over te dragen. Zo modificeren tumorvormende cellen, met behulp van exosomen, de omliggende cellen van de precancereuze niche en creëren ze een gunstige micro-omgeving die de ontwikkeling van tumoren bevordert *.
Sommige cellen in de micro-omgeving kunnen pyruvaat produceren uit lactaat geproduceerd door glycolytische cellen, waardoor ze schaarse grondstoffen krijgen *. Als gevolg van interacties tussen de tumor en de gastheer, in de micro-omgeving van het transformerende borstweefsel, en vervolgens in de micro-omgeving van de tumor, ontstaat er een unieke symbiose van orgaanvormende cellen met verschillende graden van differentiatie en normale cellen, inclusief macrofagen, fibroblasten, neutrofielen, mestcellen *… Cellulaire en moleculaire elementen dit complexe lokale ecosysteem beïnvloedt de ontwikkeling en de aard van kanker evenzeer als de kankercellen zelf *.
Uiteindelijk wordt de micro-omgeving van de tumor een uniek milieu dat alle moleculaire en cellulaire gebeurtenissen in het omringende weefsel regelt. In dit stadium van cellulaire en weefseltransformaties leiden alle voorheen verborgen processen uiteindelijk tot een tumor die we op de een of andere manier kunnen detecteren.
Verzwakking van de immuuncontrole. De opkomende tumor, onder het mom van een ontsteking, onderwerpt ook lokale immuuncellen *.
Het is moeilijk voor het immuunsysteem om zijn natuurlijke doelwit in defecte cellen te herkennen. Ten eerste zijn het voor haar slechts onvolwassen cellen van haar eigen lichaam. Ten tweede is de identificatie van die antigenen van gemuteerde cellen die op het celoppervlak voorkomen moeilijk vanwege de ophoping van glycoproteïne erop. Bovendien kunnen exosomen die vrijkomen door hypoxische cellen de expressie veranderen van oppervlaktereceptoren die dodelijke immuuncellen activeren en antigeenherkenning door dendritische cellen kunnen belemmeren. Maar dit is slechts een deel van het probleem.
De verhoogde dichtheid van de extracellulaire matrix en de verhoogde druk in de ontstekingszone belemmeren de instroom van zuurstof en de uitstroom van lactaat, het zure afvalproduct van snel delende (glycolytische) cellen. De dikke extracellulaire matrix zelf belemmert de beweging en activiteit en bemoeilijkt het binnendringen van antitumor-immuuncellen zoals cytotoxische T-cellen en NK-cellen (natural killer-cellen). Bovendien recruteren extracellulaire matrixeiwitten immuunonderdrukkende cellen zoals tumor-geassocieerde macrofagen (TAMs) * en regulerende T-cellen. Ze bevorderen allemaal de overleving van onrijpe cellen, in de overtuiging dat het proces van weefselherstel aan de gang is.
Een verhoogde zuurgraad van de micro-omgeving van de tumor kan op verschillende manieren de immuunbewaking van tumoren belemmeren. Het verzwakt bijvoorbeeld de activiteit van de meeste enzymen, vermindert de zuurstofverzadiging van het weefsel en neigt cellen naar anaërobe energieproductie. Bovendien hebben antitumorcellen zoals T-cellen en NK-cellen de neiging hun functie te verliezen onder zeer zure omstandigheden *.
Door hypoxie hoopt extracellulaire adenosine zich op in de ontstekingszone, waardoor de activiteit van T-cellen * wordt onderdrukt. Bovendien belemmert een dichte matrix de uitstroom van het eindproduct van anaerobe ademhaling – lactaat, dat een sterke verstoorder is van de normale functies van T-lymfocyten en natuurlijke killercellen – cellen met een hoog glycolytisch metabolisme *.
Langdurige hoge lactaatconcentraties veranderen het gedrag van lokale macrofagen van antitumor naar protumor. In een poging om chronische ontstekingen te verminderen, bevorderen tumorgeassocieerde fibroblasten de verwerving van een immunosuppressief fenotype door lokale macrofagen, neutrofielen, dendritische cellen en mestcellen, evenals een afname van de cytotoxische functie van natuurlijke killercellen *.
Ze bevorderen ook de rekrutering en differentiatie van myeloïde suppressorcellen *. Op hun beurt remmen myeloïde suppressorcellen de hoge activiteit van cytotoxische T-cellen en natural killer-cellen, bevorderen ze angiogenese en trekken ze ook andere immuunonderdrukkende cellen aan, zoals regulerende T-cellen *. Gezien de focus van transformatie als een plaats van verwonding en ontsteking, dragen ze bij aan het herstel van beschadigd weefsel door proliferatie en angiogenese, d.w.z. werken feitelijk voor de ontwikkeling van de tumor, en niet ertegen.
We kunnen zeggen dat immuuncellen, als gevolg van een ontoereikend begrip van de situatie en hun rol daarin, op de plaats van transformatie voor defecte cellen kunnen zorgen in plaats van ze te beschadigen. Dit alles maakt het problematisch om gemuteerde en defecte cellen te vernietigen door het immuunsysteem te stimuleren. Het eenvoudigweg stimuleren van immuuncellen zal weinig goeds opleveren. Het resultaat kan zoiets zijn als de hectische, onproductieve activiteit van een domme werknemer.
Kwaadaardige transformatie. In de precancereuze niche worden dus ontstekingen en afzettingen van collageen en andere extracellulaire matrixeiwitten waargenomen. De hoge dichtheid van collageen en de daaruit voortvloeiende hoge zuurgraad en onvoldoende toevoer van zuurstof en voedingsstoffen * bevorderen de metabolische herprogrammering van sommige borstcellen in de richting van verhoogde glucolyse en glutaminolyse *. Overtollige extracellulaire matrixsignalen dragen bij aan verlies van differentiatie, d.w.z. celprimitivisatie *; hun zelfvernieuwing *; verhoogde glycolyse *; ontduiking van apoptose *; genomische instabiliteit * en «onsterfelijkheid» *.
Met andere woorden, chronische ontsteking gevolgd door fibrose bevordert de weefselreorganisatie in de precancereuze niche en onrijpe epitheelcellen verwerven alle kenmerken van kwaadaardige cellen * *. Lokale kwaadaardige transformatie van cellen maakt het mogelijk de productie van groeifactoren te verhogen en weefselherstel te bewerkstelligen als laatste kans om een wond te genezen die niet geneest *. Het resultaat is echter compleet anders, omdat de wond niet geneest, maar integendeel, dankzij de ondernomen restauratie-inspanningen, alleen maar groeit.
Transformerende cellen delen zich en vormen een cluster van cellen met een specifieke lokale omgeving. Deze omgeving wordt gekenmerkt door een hoge zuurgraad; hypoxie; verminderde cellulaire communicatie; hoge oxidatieve stress; hoge concentratie van toxines, proliferatieve en inflammatoire moleculen. Dat wil zeggen, er verschijnen omstandigheden waaronder het kwaadaardige fenotype zich in gunstiger omstandigheden bevindt, en om deze reden uiteindelijk wordt geconsolideerd. Vervolgens keren de getransformeerde cellen en hun nakomelingen, zelfs onder gunstige omstandigheden (bijvoorbeeld met voldoende zuurstof), niet langer vrijwillig terug naar hun vorige fenotype (Warburg-effect) *.
Er wordt een positieve feedbacklus gevormd: sommige cellen in een bepaalde ruimte die wordt beschermd en beperkt door de matrix, proberen zich aan te passen en te overleven in vijandige omstandigheden voor hen, blijven deze vijandige omstandigheden ondersteunen en verergeren. Bovendien niet alleen voor jezelf, maar ook voor andere cellen van deze beperkte micro-omgeving, inclusief immuuncellen. Door verschillende moleculaire signalen vrij te geven, dwingen ze de cellen om hen heen zich aan te passen, hun fenotype te veranderen en zich zorgen te maken over overleven in plaats van hun functies uit te voeren. Op deze plaats begint een niet-functionele ophoping van cellen te verschijnen, waarvan de verwijdering problemen heeft.
Wanneer de snelheid van deling van getransformeerde cellen de snelheid van hun dood of vernietiging overschrijdt, hopen ze zich op en vormen ze eigenaardige clusters (mammosferen) – groeipunten van een toekomstige tumor. Een omgeving die bestaat uit normale epitheelcellen kan de kwaadaardige transformatie van cellen die daarvoor vatbaar zijn remmen *. Het verschijnen van een cluster van transformerende cellen verandert echter de micro-omgeving en heft deze rem op. De concentratie van getransformeerde (glycolytische) cellen verhoogt de lokale zuurgraad, hypoxie, ontsteking en fibrose verder. Bij uitdijende mammosferen wordt de controle over weefselprocessen verstoord of verloren.
Uiteindelijk ontstaat er wat een tumor (neoplasie) wordt genoemd – een neoplasma met een weefselarchitectuur en -omgeving die de normale toevoer en werking/ontwikkeling van de cellen waaruit het bestaat niet garandeert, en die een vitale bedreiging vormen voor het hele organisme.
Vroege kanker (stadium 0) beperkt zich tot het slijmvlies. Voor de borst is de vroege tumor carcinoma in situ, letterlijk kanker ter plaatse. Dit is al een tumor die een gevaarlijk vervolg kan krijgen. In de meeste gevallen worden dergelijke tumoren pas ontdekt nadat autopsie of groei een onmiskenbare diagnose mogelijk maakt. Uit een onderzoek uit 1997 bleek dat ~9% van alle vrouwen in situ tumoren in de borst heeft, terwijl bij slechts 1,3% van de vrouwen van dezelfde leeftijd de diagnose borstkanker wordt gesteld *.
Invasie. Ongedifferentieerde cellen, bijvoorbeeld pasgeboren cellen, vertonen geen hechting en vertonen als gevolg daarvan een zekere mobiliteit. Hierdoor kan een normale epitheelcel naar weefsel migreren, bijvoorbeeld naar de plaats waar een dode cel wordt vervangen, waar hij verder differentieert en zijn vermogen om te migreren verliest. Gedifferentieerde cellen worden op hun plaats gefixeerd door moleculaire bindingen te vormen met naburige cellen en met het eiwitraamwerk van het weefsel – de extracellulaire matrix. De extracellulaire matrix is direct betrokken bij zowel de genezing van letsel als de tumorvorming.
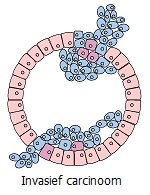
De dichte eiwitlaag rond de tumor, die bestaat uit collagenen, proteoglycanen en hyaluronzuur, wordt het basaalmembraan genoemd. Aan de ene kant creëert het basaalmembraan rond de tumor een fysieke barrière die de penetratie van zuurstof, veel stoffen die in het bloed zijn opgelost, waaronder chemotherapie, en circulerende cellen verhindert. Aan de andere kant biedt dit hek niet alleen externe bescherming voor de tumor, maar remt het ook de verspreiding ervan.
Getransformeerde cellen die tot op zekere hoogte differentiatie hebben behouden, zullen een goedaardige tumor vormen. Goedaardige tumorcellen die groeien, worden omgeven door een basaalmembraan, dat hun migratie beperkt. Getransformeerde cellen die de differentiatie aanzienlijk hebben verloren, zullen een kwaadaardige tumor vormen, waarvan de cellen worden gekenmerkt door invasie.
Macrofagen die in de tumor aanwezig zijn (TAM) kunnen verschillende proteolytische enzymen afscheiden om het basismembraan te vernietigen, waardoor tumorcellen uit de omgeving kunnen ontsnappen en aangrenzende weefsels en organen kunnen binnendringen (invade).
Hoe meer het proces van celreproductie het proces van hun differentiatie inhaalt, hoe primitiever ze zijn, hoe glycolytischer ze zijn, hoe invasiever de tumor is en hoe slechter de prognose van de ziekte. Hoewel het enkele jaren kan duren voordat dit agressieve gedrag zich ontwikkelt, is dit een indicatie dat de tumor kankerachtig is geworden.
Zelfvoorziening van proliferatie. Celduplicatie vereist voldoende bouwmateriaal om dochtercellen te bouwen. Als er een tekort is aan het benodigde materiaal, kan de deling van normale cellen vertragen. Glycolytische cellen kunnen echter overleven zonder externe benodigdheden. Ze verkrijgen de meeste noodzakelijke grondstoffen uit de metabolische producten van tussenreacties van glycolyse in het cytosol van de cel *. Bovendien worden sommige van de daarvoor benodigde moleculen geleverd door mitochondriën uit bijproducten van glutaminolyse en oxidatieve fosforylering.
Hierdoor verkrijgen glycolytische (kanker)cellen in een tumoromgeving concurrentievoordelen voor hun reproductie ten opzichte van normale cellen. Voor hun leven en voortplanting hebben ze alleen glucose nodig, terwijl voor het leven en de voortplanting van normale cellen zuurstof en andere stoffen nodig zijn, waarvan de afgifte aan het tumorgebied moeilijk is.
Hardheid van de tumor. Onder de verscheidenheid aan kwaadaardige cellen worden soms ongedifferentieerde tumor-initiërende cellen (TIC) geïsoleerd. Omdat deze cellen veel van de functionele kenmerken van normale stamcellen vertonen, worden ze ook wel kankerstamcellen (CSC) genoemd. CSC's zijn tumorcellen met stamcelkenmerken en initiëren de vorming van kanker.
De definitie van «kankerstamcellen» is gebaseerd op drie functionele kenmerken van deze cellen, namelijk:
1) het vermogen om onder bepaalde omstandigheden tumoren te initiëren;
2) het vermogen om zichzelf te vernieuwen, wat wordt gemeten aan de hand van de vorming van tumoren wanneer ze in een ander organisme worden getransplanteerd;
3) het vermogen om te differentiëren tot niet-zelfvernieuwende cellen, die het grootste deel van de tumor uitmaken.
Volgens deze theorie is slechts een subset van CSC's verantwoordelijk voor het ontstaan, in stand houden en terugkeren van tumoren, terwijl andere cellen van het aangetaste orgaan, die het grootste deel van de tumor uitmaken, zichzelf niet kunnen vernieuwen of tumorvorming kunnen initiëren * *. En hoewel CSC's een klein deel uitmaken van het totale aantal kwaadaardige cellen, zijn ze een belangrijke factor in het voortbestaan en de progressie van kanker * *.
Kankerstamcellen zijn veilig verborgen in hun niches; ze zijn het grootste deel van de tijd in rust; ze hebben geen zuurstof nodig; ze hebben een verhoogde werkingsintensiteit van membraanpompen; ze hebben een lage mate van differentiatie. Dankzij hun kenmerken vertonen CSC's wonderen van overleving. Ze kunnen zichzelf vernieuwen door epigenetische veranderingen, nieuwe mutaties verwerven en zich snel aanpassen aan de omgeving, waardoor ze een nieuwe tumorstructuur vormen met moleculaire kenmerken die heel anders zijn dan die van de oorspronkelijke tumor. Ze zorgen ervoor dat tumoren bestand zijn tegen bestraling en chemotherapie, nieuwe klonen van behandelingsresistente cellen creëren en uiteindelijk een recidief veroorzaken bij de meeste soorten kanker *.
De theorie over de aanwezigheid van CSC is misschien verkeerd, maar het maakt een eenvoudige en gemakkelijke manier mogelijk om de resultaten van observaties van processen die in de tumor plaatsvinden te verklaren.
Natuurlijke selectie en evolutie. Door een slechte afvoer van gifstoffen (producten van glycolyse), onder andere veroorzaakt door chronische fibrose, creëren glycolytische cellen een steeds giftiger milieu om zich heen. Dit dwingt hen om hun fenotype verder te verbeteren, aangezien alleen de meest veerkrachtige en sterkste overleven en bloeien. Met andere woorden: een zure en vijandige micro-omgeving bevordert de selectie van cellen die deze extreme omstandigheden kunnen overleven, waardoor een steeds agressiever tumorfenotype ontstaat.
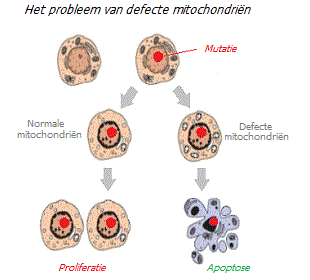
Wanneer het zuurstofniveau laag is, werkt het DNA-schadeherstelmechanisme van de cel niet goed. Verslechtering van de omgevingsomstandigheden draagt ook bij aan een verhoogde genomische instabiliteit van cellen, en genomische instabiliteit veroorzaakt mutaties. In normale cellen leiden genetische fouten tijdens de celdeling ertoe dat de mitochondriën het proces van apoptose in gang zetten, en de mutatie sterft samen met de cel.
Maar in kankercellen wordt de mitochondriale functie onderdrukt en het mitotische controlemechanisme verstoord, waardoor kankercellen beter bestand zijn tegen interne signalen van apoptose. En externe signalen die kankercellen ertoe aanzetten zelfmoord te plegen, zoals hierboven besproken, worden met succes geblokkeerd in de tumorzone, en de immuunroute voor het elimineren van gemuteerde cellen wordt verzwakt.
Door gebruik te maken van zulke gunstige omstandigheden krijgen mutaties de kans om zich voort te zetten in dochtercellen. De meeste vormen van kanker bij de mens vertonen twee tot acht opeenvolgende genetische veranderingen die zich over een periode van tien tot dertig jaar ontwikkelen *. Elk van deze veranderingen vergroot direct of indirect de onbalans tussen celgeboorte en celdood in de richting van onverminderde groei.
Het mutatieproces heeft een vertakkend karakter. Elke gemuteerde cel in de volgende generatie erft niet alleen de ouderlijke mutatie, maar kan ook nieuwe originele mutaties verwerven *. Daarom vermenigvuldigt het aantal verschillende genetisch gemodificeerde populaties (zijsubklonen) in de tumorzone. Het vergroten van het aantal van dergelijke populaties kankercellen vergroot de kans dat sommige van de klonen zullen kunnen overleven onder de meest ondraaglijke omstandigheden, inclusief die veroorzaakt door bestraling en chemotherapie.
Bovendien kan chemotherapie de kwaadaardigheid van de tumor vergroten. Terwijl de groei van normale cellen in een giftige omgeving wordt geremd, blijven onrijpe cellen, die beter zijn aangepast aan dergelijke ongunstige omstandigheden, zich delen. Chemotherapiemedicijnen die zich richten op snelgroeiende cellen vernietigen de meeste kankercellen waaruit de tumormassa bestaat. Niet alle cellen sterven echter, maar alleen de zwakste. Natuurlijke selectie laat alleen de meest succesvolle cellen over, in feite de meest kwaadaardige, die in staat zijn tot terugval, beter in staat zijn weerstand te bieden aan chemotherapie en de prognose van de uitkomst van de ziekte aanzienlijk verslechteren.
Genetische veranderingen in nucleair DNA zijn echter niet dodelijk. Bij normaal functioneren van intra- en intercellulaire signalering zijn mutaties in nucleair DNA alleen niet voldoende om kanker te veroorzaken. Het lijkt erop dat met adequate celfunctionaliteit oncogene mutaties geen kans hebben om gerealiseerd te worden, en dat de weefselstructuur het genoom domineert. Als ze niet ernstig beschadigd zijn, zal er zich geen kwaadaardige tumor ontwikkelen, zelfs niet in de aanwezigheid van meerdere chromosomale mutaties *.
Een groeiend aantal bewijzen wijst elk jaar op de conclusie dat kanker meer een stofwisselingsziekte is dan een genetische ziekte. Dat genomische mutaties in feite niet de oorzaak van kanker zijn. Ze veroorzaken geen kwaadaardige degeneratie van cellen, maar dragen er alleen aan bij en begeleiden deze.
Uitgebreid bewijs suggereert dat bij sommige vormen van kanker chromosomale en genmutaties ontbreken * * *, en in andere gevallen zijn er veranderingen gevonden in de DNA-methyleringspatronen, maar niet in de DNA-sequentie *. Tegelijkertijd volgt het optreden van maligniteiten en aerobe glycolyse het verlies van de mitochondriale functie *. Bovendien kunnen alle cellulaire tekenen van kanker in verband worden gebracht met disfunctie van de mitochondriën en het energiemetabolisme *.
Zelfs transplantatie van de kern van een kwaadaardige cel in een normaal functionerend celcytoplasma dat gezonde mitochondriën bevat, maakt deze laatste niet tot een kwaadaardige cel – er worden vervolgens normale weefsels uit gevormd * * *. Het vervangen van de kern van een normale kiemcel door de kern van een kankercel (met gemuteerde genen) maakt deze niet kankerachtig; uit zo’n cel worden vervolgens normale organismen geboren *. Gezonde klonen van muizenembryo’s werden verkregen uit de kernen van kankercellen van hersentumoren *. Kankercellen die in vroege embryo’s worden ingebracht, vormen gezonde weefsels en organen *. Omgekeerd zorgt het vervangen van de kern van een kankercel door de kern van een gezonde cel (zonder mutaties) voor kanker. Dat wil zeggen dat de kernen van normale cellen in ongezond celcytoplasma de kwaadaardigheid van de cel niet kunnen wegnemen.
Aan de andere kant kan het introduceren van functionele mitochondriën in een kankercel de verschillende kwaadaardige kenmerken ervan omkeren, waaronder celproliferatie, levensvatbaarheid bij hypoxie, anti-apoptotische eigenschappen, resistentie tegen kankermedicijnen, invasie en kolonievorming, en tumorgroei *. Dit is een ander bewijs ten gunste van het feit dat de kwaadaardige toestand van een cel niet afhangt van de celkern, maar van zijn organellen * * *.
Ten slotte kan kanker worden veroorzaakt zonder het DNA te veranderen, bijvoorbeeld door blootstelling aan niet-genotoxische carcinogenen (zoals chloroform en dichloorbenzeen) *. Een kwaadaardige tumor zonder enige DNA-mutatie kan ook worden uitgelokt door niet-mutagene vreemde materialen in de lichaamsweefsels te introduceren die de cellulaire interactie verstoren *.
Dit alles leidt tot de conclusie dat, in tegenstelling tot de heersende theorie, het niet de genetische mutaties van nucleair of mitochondriaal DNA zijn die de oorzaak zijn van het ontstaan van kanker in een cel *. Het is niet de aanwezigheid van mutaties of de expressie van oncogenen die een cel kwaadaardig maken. Het is eerder het cytoplasma, en niet de celkern, dat de kwaadaardige toestand van de cel * * bepaalt, en tumorvorming vereist de aanwezigheid van ineffectieve mitochondriën in de cellen.
Genetische mutaties vormen dus niet de kern van het probleem, maar slechts een deel van het totale proces. En het tumorfenotype kan in principe worden teruggedraaid naar het normale fenotype * * *.
Angiogenese. Een toename van de productie van melkzuur door glycolytische cellen, en als gevolg daarvan, verzuring van de omgeving, vermindert de zuurstofconcentratie in de intercellulaire ruimte.
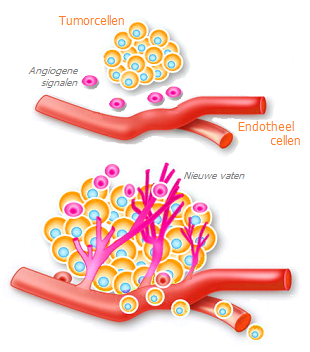
Als reactie op chronisch zuurstofgebrek en overtollige gifstoffen geven cellen hun chemische signalen af, wat erop wijst dat ze extra bloed- en lymfevaten nodig hebben. En deze vaten beginnen met hun vorming (angiogenese). Naast hypoxie zijn er nog andere signalen die angiogenese bevorderen. Bijvoorbeeld oestrogeen of chronische ontstekingen die het tumorproces begeleiden.
Angiogene verschijnselen zijn typisch voor trauma en kunnen al in het allereerste stadium van tumorvorming in het weefsel optreden *. De bloedsomloop begint nieuwe bloedvaten aan te leggen, in reactie op de aanhoudende verzoeken van al 100-200 cellen. Hoewel de bloedvaten in de tumor groeien en de lokale bloedtoevoer enigszins verbetert, wordt de met het bloed aangevoerde glucose weer besteed aan glycolyse en een toename van het aantal glycolytische cellen.
De zuurgraad van het weefsel blijft dus nog steeds hoog en het probleem van zuurstofgebrek wordt niet opgelost, zo niet verergerd. Het toegenomen aantal glycolytische cellen heeft nog luider vasculaire ondersteuning nodig.
Bovendien zijn nieuw gevormde bloedvaten in het getroffen gebied, als gevolg van de vervorming van de signalering tussen cellen, onvolwassen en onvolledig. Een hoog percentage vloeistoflekkage uit defecte bloedvaten en een slechte afvoer van lymfevaten creëren een gebied met lokaal verhoogde druk. En dit schaadt op zijn beurt de toevoer van cellen en verhindert ook de stroom van medicijnen en sommige moleculen die intercellulaire communicatie op afstand garanderen.
Cellen die zich ver van de bloedvaten bevinden, ontvangen door diffusie de chemische voeding die ze nodig hebben. Dit beperkt enigszins de hoge glucosebehoefte van kankercellen. Er wordt aangenomen dat tumoren met de diffuse methode om voeding te verkrijgen niet groter kunnen worden dan 1 mm, en dan worden ze gedwongen hun groei te stoppen vanwege een gebrek aan middelen. Wanneer kankercellen worden voorzien van toevoerroutes in de vorm van bloedcapillairen, krijgen ze gemakkelijk toegang tot glucose en kunnen ze dus hun proliferatieve potentieel aanzienlijk vergroten.
Veel voedingscomponenten hebben anti-angiogene eigenschappen †, dus aanpassingen in het voedingspatroon, zoals het verhogen van het aandeel planten en volle granen, kunnen de groeisnelheid van de tumoren verminderen. Bovendien is vetweefsel zeer rijk aan bloedvaten. Vetcellen scheiden grote hoeveelheden angiogene factoren uit en daardoor verhoogt de groei van vetophopingen het risico op kanker.
Metastase. Gedifferentieerde cellen zijn op hun locatie stevig aan de matrix bevestigd. Om volwassen cellen te laten migreren, zullen ze een aantal fenotypische transformaties moeten ondergaan waardoor ze motiliteit kunnen verwerven. Dergelijke transformaties worden epitheliale-mesenchymale transitie (EMT) genoemd. Maar hoe primitiever de cellen zijn, des te minder zijn ze verbonden met de extracellulaire matrix, en des te waarschijnlijker is het dat ze met lymfe of bloed naar nabije en verre delen van het lichaam worden getransporteerd, en daar nieuwe kolonies vormen (metastase). Kankercellen hebben precies zo'n vermogen, en hoe agressiever een kankercel is, des te vatbaarder is hij voor expansie.
In normale weefsels zijn de mogelijkheden voor celmigratie dus uiterst beperkt. Cellen van het ene orgaan migreren niet vrijwillig naar een ander orgaan, en als dit op de een of andere manier gebeurt, zullen ze door immuuncellen worden geïdentificeerd als lichaamsvreemd en vernietigd. Hetzelfde gebeurt met circulerende kankercellen. In dit geval doen zich echter verschillende problemen voor.
De getransformeerde cellen die de primaire tumor verlaten en naar andere organen migreren, dragen een dikke eiwitlaag die de rol speelt van camouflage en pantsering (e). Camouflage verbergt moleculaire markeringen op het buitenoppervlak van een kankercel die door immuuncellen kunnen worden herkend als hun legitieme prooi. En de verdikking van het membraan bemoeilijkt de taak van het verslaan en absorberen van de metastaserende cel door immuuncellen – natuurlijke moordenaars en fagocyten.
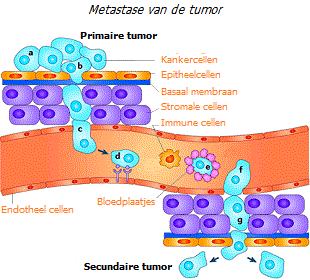
Met een normaal functionerend immuunsysteem zal echter één enkele metastatische cel buiten de tumor worden herkend (d), aangevallen en uiteindelijk geëlimineerd. Nadat hij aan de grenzen van zijn micro-omgeving (b) is ontsnapt, bevindt hij zich in ongunstige externe omstandigheden. Hier valt het niet onder de jungle van de extracellulaire matrix en ontstekingssignalen die de immuunactiviteit onderdrukken, en heeft daarom zeer weinig overlevingskansen. Succesvolle metastasen vereisen niet de migratie van een enkele kankercel, maar van een microscopisch klein deel van de tumor als geheel.
Ten eerste zijn kankercellen in dit geval, nauw vergezeld van andere cellen van de micro-omgeving van de tumor, beter beschermd tegen agressieve externe factoren. Ten tweede maakt dit het voor hen gemakkelijker om anoxie te vermijden, een vorm van apoptose die wordt veroorzaakt door verlies van hechting aan andere cellen *. En ten derde helpt het betreden van een nieuwe niche samen met hun micro-omgeving hen om signalen te ontwijken die afkomstig zijn van naburige cellen van niet-tumorweefsel, wat hen ertoe zou kunnen neigen hun proliferatie te beperken, tot apoptose of tot verlies van kwaadaardigheid (differentiatie). Een dikke laag kleverig glycoproteïne op het oppervlak van kankercellen bevordert de vorming van zo'n meercellig cluster, en lipoproteïnen dichten bovendien de gaten daartussen af.
Tumor-geassocieerde macrofagen (TAM's) kunnen tot de helft van het totale tumorvolume uitmaken. De micro-omgeving van de tumor is in staat het fenotype van macrofagen zodanig te veranderen dat ze het vermogen verliezen om onrijpe (waaronder kanker) cellen te absorberen en te verteren. Terwijl ze inactief blijven, blijven ze de kankercellen stevig omringen en beschermen ze tegen nog steeds functionele killercellen. Door zich samen met kankercellen van de tumormassa af te scheiden, kunnen macrofagen tijdens hun reis dezelfde bescherming bieden.
Als de penetratie van kankercellen in de bloedbaan (c) gepaard gaat met schade aan de wand van het bloedvat, zal het fibrine dat op de plaats van de verwonding verschijnt bloedplaatjesstolsels rond het migrerende kankercluster vormen, waardoor deze microformatie bij elkaar wordt gehouden.
Nadat hij zijn gevaarlijke reis heeft overleefd en vastzit in een klein bloedcapillair, verliest de migrerende microstolsel met kankercellen een deel van zijn externe bescherming. Door het oppervlak bloot te leggen, kan de kankercel zich gemakkelijker aan de lokale matrix hechten, als hij dit vermogen niet volledig heeft verloren. Als het microstolsel waarin het zich verplaatst groot genoeg is, kan het de lokale bloedtoevoer en dus de zuurstoftoevoer belemmeren, waardoor een gunstig klimaat ontstaat voor de ontwikkeling van tumoren. Als kankercellen op een nieuwe locatie arriveren, vergezeld van immuuncellen die overwegend glycolytisch zijn, kunnen ze de lokale zuurgraad en hypoxie verder verhogen.
Omdat de penetratie van een binnendringende cel vanuit een bloedvat in een weefsel en het behoud van de kwaadaardige kenmerken ervan een combinatie van bepaalde omstandigheden vereist, groeien foci van micrometastasen niet noodzakelijkerwijs onmiddellijk. Ze kunnen lange tijd in een bevroren, inactieve toestand blijven, wachtend op hun mooiste uur. Maar meestal verdwijnen ze als gevolg van ongunstige omstandigheden voor hen en door het werk van functionele immuuncellen.
Metastase vindt het gemakkelijkst plaats via de lymfevaten. Maar langeafstandsroutes van metastasen lopen nog steeds door de bloedvaten, ondanks ongunstigere externe omstandigheden.
Op een plaats ver van de primaire tumor moeten kankercellen terugreizen van het bloedvat om lokaal weefsel binnen te dringen (f). Hier is de omgeving echter anders dan de tumoromgeving. In een tumor zijn de bloedvaten slecht gevormd, gecorrodeerd door agressieve metabolieten van kankercellen en hebben ze een hoge permeabiliteit. Daarom laten ze kankercellen gemakkelijk in het bloed doordringen. In gezond weefsel bevorderen de wanden van bloedvaten de invasie van kankercellen niet, tenzij ze hier eerst op voorbereid zijn.
Volgens een alternatieve theorie vindt de overdracht van kankercellen naar verre locaties plaats met behulp van macrofagen. De absorptie van vijandige middelen met hun verdere ontbinding en assimilatie is het routinewerk van macrofagen. Wanneer de functionaliteit van macrofagen in de micro-omgeving van de ontstoken tumor echter wordt verstoord, wordt dit proces mogelijk niet in de mate uitgevoerd die zou moeten. Terwijl ze bijvoorbeeld het vermogen behouden om een pathogeen object te absorberen (fagocytose), kunnen macrofagen het vermogen verliezen om het op te lossen (lysis).
Om deze reden kunnen macrofagen het membraan van een epitheliale kankercel oplossen, maar de kern ervan behouden. Als resultaat van deze fusie wordt een meerkernige hybride gevormd *, die de eigenschappen heeft van zowel een epitheelcel als een macrofaag *. Bij een nog grotere disfunctie, waarbij hij de verzwolgen cel niet kan assimileren, kan de macrofaag deze volledig vasthouden. Macrofagen kunnen dus dienen als transportvoertuigen om kankercellen in zichzelf te dragen.
Iets soortgelijks gebeurt bij sommige parasitaire ziekten, wanneer parasieten zich op betrouwbare wijze verbergen voor detectie en dood in gezonde cellen van het lichaam, bijvoorbeeld in rode bloedcellen. Metastase als fenomeen kan dus optreden vanaf de allereerste momenten waarop de tumor verschijnt. En de reden hiervoor kunnen juist de immuuncellen zijn die zijn ontworpen om ons te beschermen.
Ten slotte zijn, volgens de meest radicale versie *, metastatische cellen zelf afkomstig van macrofagen of andere soortgelijke cellen van myeloïde oorsprong (dendritische cellen of lymfocyten). Kwaadaardige transformaties treden daarin op als gevolg van respiratoire insufficiëntie en de agressieve micro-omgeving van de tumor waarin ze zich bevinden.
Macrofagen zijn cellen die zich niet aan de matrix hechten. Ze zijn genetisch geprogrammeerd om in de bloedbaan te voorkomen en op natuurlijke wijze gemakkelijk weefsel binnen te dringen. Onder hun omhulsel kunnen kankercellen uit de tumor ontsnappen en door de lymfestroom naar de lymfeklieren worden getransporteerd. En via de bloedbaan is het veilig om zich tot ver buiten de grenzen van de primaire tumor te verspreiden, omdat de bloedomgeving voor hen natuurlijk is.
Het risico op metastase neemt toe met de groei van celprimitivisatie, en dit proces begint blijkbaar al bij het begin van de tumor. Zelfs de kleinste tumor is in staat ongedifferentieerde, tamelijk mobiele tumor-initiërende cellen uit te spuwen die zich tot ver buiten zijn grenzen kunnen verspreiden.
Naarmate de omvang van de primaire tumor groeit, neemt het aantal en de omvang van het migrerende tumor-initiërende puin toe. En hoewel hun kansen om op een afgelegen locatie een kolonie kankercellen te creëren minuscuul zijn (volgens verschillende schattingen slaagt slechts één op de tien- of zelfs honderdduizenden van dergelijke pogingen), vanwege het enorme aantal pogingen zal dit vroeg of laat, gebeurt.
Op het moment dat de primaire tumor wordt gediagnosticeerd, heeft ongeveer 50% van de patiënten al niet-gedetecteerde micrometastatische tumorkolonies, die zich uiteindelijk kunnen uitbreiden en ervoor kunnen zorgen dat de ziekte na de behandeling terugkeert. Hoe groter de omvang van de gedetecteerde primaire tumor, hoe groter de kans op de aanwezigheid van dergelijke kolonies *.
Als metastase de groei is van kankercellen van een primaire tumor op een nieuwe locatie, dan zou elke tumor, zoals in de longen, die volgt op een borsttumor, worden beschouwd als een uitgezaaide borsttumor, in plaats van als een nieuwe longtumor. Maar er zijn ook alternatieve opvattingen. Volgens een van hen ontstaan metastasen door de activering van overeenkomstige oncogenen op afgelegen plaatsen door voortdurend circulerende signaalmoleculen die afkomstig zijn van de primaire tumor *.
Deze versie wordt ondersteund door het feit dat de tijd van ontwikkeling van metastasen te kort is vergeleken met de tijd van ontwikkeling van de primaire tumor. En ook het feit dat plasma afkomstig van muizen met tumoren een hoge concentratie aan groeifactoren bevat, en wonden sneller geneest dan plasma van gezonde muizen *. Dit standpunt is echter niet in tegenspraak met het heersende standpunt. Misschien kan, op een manier die nog niet is opgehelderd, het verwijderen van de primaire tumor door de huidige behandelingsprotocollen de beperkingen op de ontwikkeling van reeds verspreide metastasen die zich voorheen in een «slapende» toestand bevonden, wegnemen.
Afhankelijk van de mate van invasie en metastase worden verschillende stadia van kanker onderscheiden, die verder zullen worden besproken. Ondertussen vormt de primaire tumor geen dodelijk gevaar, in tegenstelling tot uitzaaiingen, die de belangrijkste doodsoorzaak zijn bij kankerpatiënten. Dit betekent dat we met een tijdige diagnose de tijd hebben om maatregelen te nemen om het tumorproces te vertragen en het uur uit te stellen waarop uitzaaiingen zich ontwikkelen en de patiënt overlijden. Tot het moment waarop de dood door kanker andere doodsoorzaken overtreft.
Gevaarsniveau. Gezien de overvloed aan risico's en negatieve factoren die we kunnen zien, lijkt het verrassend dat we niet allemaal kanker krijgen. Gelukkig is het lichaam uitgerust met een groot aantal compensatiemechanismen om dit te voorkomen. Daarom is het hierboven beschreven drama met een tragisch einde een extreem geval en geen regel. Hoewel de hierboven geschetste processen bij bijna elke volwassen vrouw voorkomen, overwint het lichaam meestal met succes de problemen die zich voordoen. Als dit niet zo zou zijn, zouden tumoren pas enkele jaren lang hoeven te rijpen * * voordat ze ontdekt werden. De strijd kan met wisselend succes verlopen en de uitkomst hangt grotendeels af van het gedrag van de patiënt zelf.
Kwaadaardige karaktereigenschappen nemen cellen niet absoluut over. Kankercellen blijven tot op zekere hoogte nog steeds gevoelig voor externe signalen van apoptose, groeiremming, differentiatie en «nederzetting». Ze kunnen in een relatieve rusttoestand terechtkomen en daar vele jaren blijven *. En ze kunnen zelfs vanzelf spoorloos verdwijnen – dit zeldzame fenomeen wordt spontane remissie genoemd. Aangenomen kan worden dat op microniveau overgangen van goedaardige naar kwaadaardige aandoeningen en terug herhaaldelijk en onmerkbaar kunnen optreden, zowel voor de persoon zelf als voor de diagnose.
Voor de manifestatie van weefseltransformaties die kanker veroorzaken en in stand houden, is een tijdelijke lokale verstoring van het weefsel/cellulaire evenwicht niet voldoende. Proliferatie kan zich uiten in de vorm van eelt, wratten of papillomen, maar is op zichzelf niet de oorzaak van de tumor. Lokale ontstekingen kunnen vele jaren aanhouden zonder tumoren te veroorzaken. Fibrose kan de processen van ontsteking en veroudering begeleiden, waardoor merkbare weefseltransformatie ontstaat, maar zonder tekenen van tumoren te vertonen. Genetische modificaties zijn ook niet voldoende om kanker te veroorzaken.
Er is een gelijktijdige combinatie van verschillende intra- en extracellulaire aandoeningen nodig, die op de lange termijn in staat zijn zichzelf in stand houdende kankerverwekkende lussen te vormen. Het elimineren van zelfs maar één ervan in een zeer vroeg stadium kan de progressie van de maligniteit vertragen. Door er meerdere te elimineren wordt de beweging richting niet-kwaadaardige aandoeningen verlegd, of zelfs het proces van tumorvorming omgedraaid. Wat feitelijk alleen maar het gevolg is van een verstoring van het normale functioneren van cellen en weefsel.
De situatie is anders wanneer er al een tumor is gevormd. De multi-circuit en multifactoriële aard van het kankerproces laat geen hoop op het vinden van een enkele medicijnformule, een enkele therapie of een enkel doelwit dat het hele mechanisme ervan zou kunnen doorbreken. Het verbreken van een of twee oorzaak-en-gevolg-relaties zal weinig nut hebben, omdat kankercellen dankzij hun flexibiliteit en aanpassingsvermogen mechanismen zullen vinden om deze te omzeilen. Om kanker te verslaan zul je alle mogelijke oncogene ketens moeten doorbreken om het geen enkele kans te geven. En zelfs het scheppen van de gunstigste omstandigheden betekent niet noodzakelijkerwijs de vrijwillige terugkeer van kankercellen naar een normaal fenotype, wat de noodzaak impliceert om ze te vernietigen.
De vorming en ontwikkeling van een tumor is niet onvermijdelijk. Van de enkele duizenden brandpunten van hyperplasie vormen slechts enkele tumoren. Bovendien zijn de meeste ervan niet invasief en begeleiden ze de meeste vrouwen gedurende hun lange en gelukkige leven. En ze laten je zelfs toe om niet na te denken over de asymptomatische pijnlijke processen die zich in de borst voordoen. Maar dit is precies wat kanker zijn verraderlijkheid geeft en de kans geeft om te winnen.
“Kanker is een genetische ziekte. Het ontstaat uit een enkele gemuteerde cel en doorloopt de stadia van initiatie, groei en metastase.” Dit wordt nog steeds onderwezen in medische leerboeken. Maar zoals we uit alles wat hierboven is besproken zien, is dit niet helemaal waar. Carcinogenese is geen lineaire keten, maar een ingewikkeld netwerk van onderling verbonden gebeurtenissen. Mutaties zijn bij het proces betrokken en vormen slechts een van de onderdelen van de ontwikkeling van een kwaadaardige tumor. Kanker kan niet worden gekarakteriseerd als een abnormaal proces in het lichaam, maar als een abnormale combinatie van natuurlijke cellulaire processen.
Terugkerend naar de fundamentele standpunten van de theorie van somatische mutaties, uiteengezet aan het begin van deze paragraaf †, kunnen we opmerken dat het hier voorgestelde beeld van de ontwikkeling van kanker er in veel opzichten mee in tegenspraak is:
- de normale toestand van menselijke cellen is expansie (deling en migratie), en niet rust;
- het verschijnen van een tumor is geen ongeluk, maar het resultaat van een schending van de orde van natuurlijke processen;
- een tumor ontstaat niet uit een enkele cel met één of meerdere mutaties, maar uit een groep dicht bij elkaar gelegen weefselcellen die zijn blootgesteld aan traumatische signalen die ze niet met gewone mechanismen kunnen verminderen;
- mutaties van tumorcellen worden veroorzaakt door de omstandigheden van het huidige proces en zijn niet de oorspronkelijke oorzaak ervan;
- de negatieve gevolgen van mutaties kunnen worden beperkt door een normale intracellulaire toestand en een normale extracellulaire omgeving.
Laten we nu terugkeren naar het standpunt dat de keuze van een werktheorie over de oorsprong van kanker direct de strategie voor de behandeling ervan bepaalt. Als kanker het resultaat is van hopeloze fouten in genen, zoals het dogma nog steeds beweert, dan is het elimineren van alle kankercellen de enige en niet bemoedigende benadering van de behandeling. Dit is de weg van de moderne geneeskunde.
Als veranderingen in genexpressie slechts een begeleidend onderdeel van dit proces zijn, en kanker zelf het resultaat is van disfunctie van intercellulaire interacties, dan kan kanker theoretisch worden teruggedraaid. Door cellulaire signalen te normaliseren kan een tumor worden aangezet om af te sterven, zijn ontwikkeling te stoppen of aanzienlijk te vertragen, primitieve cellen te differentiëren en volledig normale weefsels te vormen.
Als we een tumor in het bijzonder beschouwen als gevolg van slecht functioneren, dan impliceert deze visie op het probleem een combinatie van de volgende lokale therapeutische manipulaties om het probleem op te lossen:
- chirurgische verwijdering van het grootste deel van de tumor;
- het verminderen van het niveau van traumatische signalen, inclusief hormonale signalen;
- het verminderen van het niveau van ontstekingssignalen;
- herstel van de mitochondriale ademhaling;
- verminderde weerstand van kankercellen;
- stimulering van de uiteindelijke celdifferentiatie;
- het weefsel voorzien van zuurstof en bouwstoffen die nodig zijn voor het proces van weefselherstel;
- vorming van gezonde microflora in het epitheel;
- adequate aanpassing van immuuncellen.
Ter afsluiting van dit hoofdstuk is het onmogelijk om van het gevoel van understatement af te komen. We kunnen voor onbepaalde tijd nadenken over de mechanismen van het kankerproces, maar we kunnen niet met zekerheid zeggen wat precies de werkelijke oorzaak is en niet het gevolg. En bestaat het überhaupt?
Er zijn veel onbeantwoorde vragen. Waarom worden sommige mensen, onder ogenschijnlijk identieke omstandigheden, er het slachtoffer van, en anderen niet? Waarom krijgen sommige mensen uit het niets kanker, terwijl anderen het niet krijgen, zelfs als er veel kankerverwekkende factoren zijn? Kanker blijft nog steeds een mysterie en ondanks alle groeiende kennis erover ontgaat iets onbegrijpelijks onze blik. We zien het proces, maar we zien niet de drijvende kracht. Net zoals we achter de drukte van de bouwers het plan van de architect niet in zijn hoofd zien. Net zoals we de aanwezigheid van de Heilige Geest niet zien in natuurlijke verschijnselen.